带鱼肠道中芽孢杆菌的分离鉴定及其发酵液抗菌性质研究
许本宏,林俊芳,叶志伟,郭丽琼,陆雅琴,林金德
(华南农业大学 食品学院,食品生物技术研究所,广东省微生态制剂工程技术研究中心,广东 广州 510640)
近年来,我国的水产养殖业得到了迅速发展,养殖规模日益扩大。但过度依赖提高养殖密度和过量投饵的养殖方式使得养殖业出现较多严重问题,如养殖动物的排泄物、残饵及死亡残体等对水质的污染,使得有害藻类及病菌大量繁殖,从而导致养殖水域生态环境日益恶化,各种水产动物疾病爆发,甚至出现水产动物大面积的死亡,给整个水产养殖业造成了巨大的经济损失,严重制约了我国水产养殖业的健康发展[1-2]。目前,抗生素和化学药物在解决这一问题上发挥着重要作用。然而,抗生素和化学药物只能暂时抑制病害的发生,而且会产生耐药菌株、药物残留、破坏养殖环境的微生态平衡和降低养殖动物的免疫力等问题[3]。因此研究开发高效、广谱、安全的新型水产养殖用抗生素替代品具有重要意义。
益生菌是一类对宿主有益的活性微生物,具有促进宿主营养物质的消化吸收、调节宿主肠道菌群平衡、提高机体免疫能力和避免耐药性菌株的产生等优点,被广泛应用于食品、畜牧和水产等领域[4]。芽孢杆菌(Bacillus)被公认是一种有发展前景的应用于水产养殖的益生菌,有稳定性高(耐高温、耐酸碱、耐干燥)、易加工、能分泌产生多种酶类(如蛋白酶、淀粉酶、脂肪酶等)、营养代谢物质、多种抗菌活性物质以及可作为一种水质调节器,净化养殖水环境等优点[5-8],使其有望在水产养殖中逐步替代抗生素的使用。
本研究从带鱼肠道中分离到1株菌株JFL15,通过形态特征、生理生化特征、16S rDNA序列分析及系统发育树的构建,初步鉴定为暹罗芽孢杆菌(B.siamensis)。本研究采用牛津杯法对15种水产常见病原菌进行抑菌效果试验。此外,对菌株的发酵上清液的性质进行相关研究,发现其发酵产物性质稳定,适合开发成微生物制剂应用于水产养殖业。
1 材料与方法
1.1 材料
1.1.1 供试动物及菌种
带鱼(Trichiurushaumela)购自广东省广州市某市场,约1~2 kg。
指示菌:嗜水气单胞菌(Aeromonashydrophila)4001、美人鱼发光杆菌(Photobacteriumdamsela)4002、哈维氏弧菌(Vibrioharveyi)4003、溶藻弧菌(V.alginolyticus)4004,由中山大学惠赠;嗜水气单胞菌(5101、5102、5103)、大肠杆菌(Escherichiacoli)5105、迟钝爱德华氏菌(Edwardsiellatarda)5111、铜绿假单胞菌(Pseudomonasaeruginosa)5112、溶藻弧菌(V.alginolyticus)5201、哈维氏弧菌(V.harveyi)5203、副溶血弧菌(V.parahaemolyticus)5205、创伤弧菌(V.vulnificus)5206、查氏弧菌(V.chagasii)5209由海南大学海洋学院提供。
1.1.2 培养基
细菌基础培养基(1 L):胰蛋白胨10 g,酵母提取粉5 g,NaCl 5 g,pH 7.27.4。
MSM培养基(1 L):蔗糖20 g,NH4NO32 g,KH2PO43 g,Na2HPO410 g,MgSO40.2 g,酵母膏0.2 g,CaCl20.7 μg,MnSO41 μg。
1.2 方法
1.2.1 菌株的分离和纯化
采用平板稀释法,取带鱼肠道内含物于10 mL无菌的蒸馏水中,制备悬浊液,分别梯度稀释获得浓度为10-7、10-8、10-9的样品溶液,移取0.1 mL样品溶液涂布于固体初筛培养基(细菌基础培养基)平板上,37 ℃培养24 h。挑取单菌落反复划线纯化2~3次,4 ℃冰箱保藏、备用。
1.2.2 筛选菌株的鉴定
1.2.2.1 生理生化鉴定
参照《伯杰氏细菌鉴定手册》[9]和《常见细菌系统鉴定手册》[10]中的试验方法,对菌株形态及生理生化特性进行鉴定。
1.2.2.2 16S rDNA序列测定
提取菌株的基因组总DNA。16S rDNA的克隆采用细菌的通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1495R(5′-CTACGGCTACCTTGTTACGA-3′)进行PCR扩增。扩增产物经1%琼脂糖凝胶电泳,样品经切胶回收后送深圳华大基因有限公司进行测序。将测序的16S rDNA基因序列与GeneBank中已知的核酸序列进行Blast分析,同源性较高的序列,用4.1软件进行分子系统学分析并构建系统发育树。
1.2.3 菌株JFL15发酵上清液的性质研究
以哈维氏弧菌[11-12]4003为指示菌,采用牛津杯法测定上清液的抑菌活性,将指示菌与冷却至50 ℃的细菌基础培养基混匀倒平板,培养皿内放置直径为6 mm的无菌牛津杯,向牛津杯中加入150 μL上清液,置于37 ℃培养箱中培养12 h,测量抑菌圈直径(mm)。以孔中加入空白培养液为对照,每个处理重复3次。分别考察发酵上清液对酶、温度、pH、紫外线耐受性以及储存稳定性[13],以初步判断菌株JFL15产生的抗菌活性物质的稳定性。
1.2.3.1 酶对发酵上清液抑菌活性的影响
将发酵上清液分别用终质量浓度为1 mg/mL 的胰蛋白酶、木瓜蛋白酶、蛋白酶K、胃蛋白酶、脂肪酶37 ℃中水浴1 h,以未经酶处理的发酵上清液为对照,测定抑菌活性,每个处理重复3次。
1.2.3.2 温度对发酵上清液抑菌活性的影响
将发酵上清液分别置于40、60、80、100 ℃处理30 min,另取一份121 ℃高压灭菌30 min,待冷却至室温后,过滤除菌,以未经温度处理的发酵上清液作为对照,测定抑菌活性,每个处理重复3次。
1.2.3.3 pH对发酵上清液抑菌活性的影响
将发酵上清液分别用1 mol/L HCl和1 mol/L NaOH分别调节pH为1、3、5、7、9、11,室温处理2 h,再将pH调回7.0,过滤除菌,以未经处理的发酵上清液作为对照,测定抑菌活性,每个处理重复3次。
1.2.3.4 紫外线对发酵上清液抑菌活性的影响
将发酵上清液置于无菌培养皿中,在超净台紫外灯下(功率20 W辐照强度, 样品与光源距离40 cm)分别照射15 min、30 min、45 min、1 h、2 h、3 h,过滤除菌,以未经处理的发酵上清液作为对照,测定抑菌活性,每个处理重复3次。
1.2.3.5 储存时间对发酵上清液抑菌活性的影响
将发酵上清液置于4 ℃冰箱里分别储存1、7、14、21、28 d,以新鲜发酵上清液为对照,测定抑菌活性,每个处理重复3次。
1.2.4 菌株JFL15发酵上清液的抗菌谱测定
以嗜水气单胞菌、美人鱼发光杆菌、哈维氏弧菌、溶藻弧菌、大肠杆菌、迟钝爱德华氏菌、铜绿假单胞菌、副溶血弧菌、创伤弧菌、查氏弧菌15株水产常见病原菌为指示菌,采用牛津杯法测定上清液的抗菌谱,具体操作同1.2.3。
1.3 数据分析
试验数据采用SPSS 17.0 软件进行单因素方差分析,显著性分析采用Turkey和Duncan检验法进行多重比较,显著性水平设为P<0.05,数据以平均值±标准差表示。
2 结果与分析
2.1 拮抗菌株的分离与筛选
通过对带鱼肠道内含物中微生物的分离筛选,共获得30株细菌菌株,其中有7株为芽孢杆菌。经过3次MSM培养基液体发酵培养,测定其发酵液的抑菌活性,最终选定一株抗菌活性强的菌株,命名为JFL15。
2.2 菌株JFL15的鉴定
2.2.1 形态特征
菌株JFL15在LB固体培养基上培养,菌落为圆形,乳白色,边缘不规则,表面皱褶,边缘翘起,中间内陷,不透明,干燥;液体培养后4 ℃静止放置时有菌膜形成。革兰氏染色阳性,呈杆状(图1)。

图1 菌株JFL15的菌落形态(左)和革兰氏染色(右)
2.2.2 生理生化特征
菌株JFL15生理生化特征检测结果显示,该菌株能利用葡萄糖、蔗糖、淀粉、山梨醇、甘露醇等多种碳水化合物作为唯一碳源进行生长,能利用硫酸铵、草酸铵、酪氨酸、组氨酸等多种无机或有机氮作为唯一氮源进行生长,能水解淀粉和明胶,分别能在45 ℃、pH 58、7.5% NaCl环境下生长,主要生理生化特性见表1。
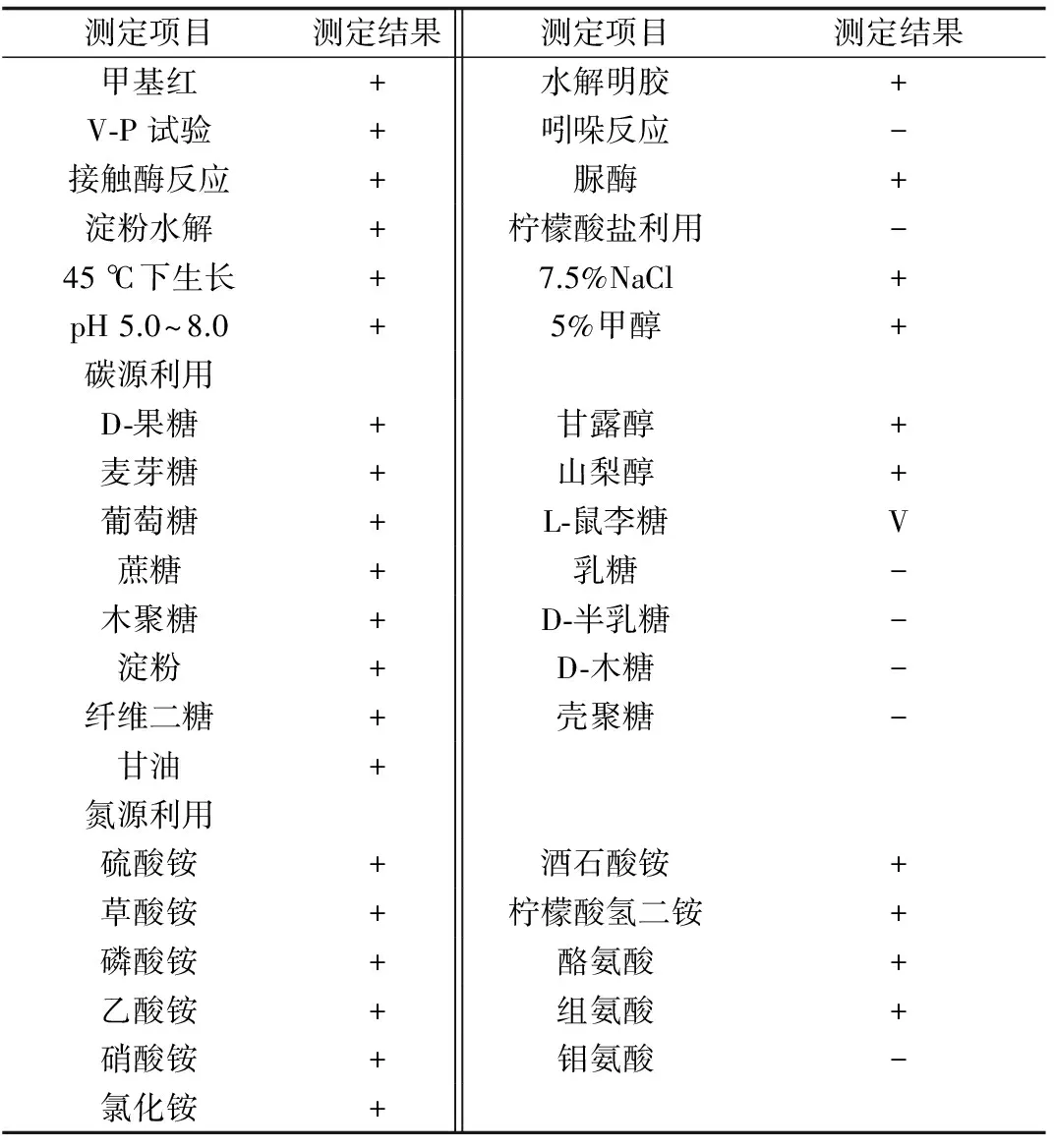
表1 菌株JFL15的生理生化特征
注:“+”:阳性;“-”:阴性;“V”:不明显.
2.2.3 16S rDNA序列测定及系统发育学分析
菌株JFL15 16S rDNA基因序列测序结果表明,其大小为1538 bp。将测序获得的序列在NCBI上进行核苷酸同源性比对,结果显示,其与解淀粉芽孢杆菌(B.amyloliquefaciens)、贝莱斯芽孢杆菌(B.velezensis)、暹罗芽孢杆菌和枯草芽孢杆菌(B.subtilis)的16S rDNA核苷酸序列同源性最高,均在97.5%以上。采用邻接法构建系统发育树,结果(图 2)显示,菌株JFL15与暹罗芽孢杆菌在同一分支,亲缘关系最近。结合形态学和生理生化特征,初步确定菌株JFL15为暹罗芽孢杆菌。
2.3 暹罗芽孢杆菌JFL15发酵上清液的理化性质研究
2.3.1 对酶的稳定性
暹罗芽孢杆菌JFL15的发酵上清液经各种蛋白酶和脂肪酶处理1 h后,其抑菌活性(抑菌圈直径大小)有少许下降,但能保持86.8%的抑菌活性(图3)。说明暹罗芽孢杆菌JFL15的发酵上清液中的抗菌活性物质对酶不敏感,同时说明发酵上清液中的抗菌活性物质中蛋白质的成分很少,主要成分可能为性质稳定的脂肽类化合物。
2.3.2 对热的稳定性
暹罗芽孢杆菌JFL15的发酵上清液分别经40、60、80、100 ℃和121 ℃处理30 min后,活性随着温度的升高呈现缓慢下降的趋势,结果见图4。在100 ℃下处理30 min,抑菌活性还能保持75.1%,而121 ℃高压灭菌30 min后发酵液完全失活,这可能是由于温度100 ℃时暹罗芽孢杆菌JFL15的发酵上清液中抗菌活性物质的结构遭到破坏从而失去活性,但温度低于100 ℃时发酵液具有较好的热稳定性。说明暹罗芽孢杆菌JFL15的抗菌活性物质具有较强的热稳定性。
2.3.3 对酸碱的稳定性
暹罗芽孢杆菌JFL15的发酵上清液经不同pH处理后,pH 7时,暹罗芽孢杆菌JFL15的发酵上清液的抗菌活性最强。这是因为暹罗芽孢杆菌JFL15的发酵液的初始pH为7.4,所以在pH 7下处理2 h对其抑菌活性造成影响。在pH低于或高于7时,发酵液活性明显下降,但在pH 3~9范围内,发酵液至少还能保持73.1%的活性。但当pH低于3或高于9时,发酵液抑菌活性显著快速降低,在pH为1或11时,发酵液完全失去活性(图5)。说明暹罗芽孢杆菌JFL15的发酵上清液对酸碱具有一定程度的耐受性。
2.3.4 对紫外线的稳定性
暹罗芽孢杆菌JFL15的发酵上清液在紫外线下照射15~120 min,其抗菌活性略有下降,保持85.3%的活性;120 min后随着照射时间的延长抑菌活性明显下降,照射180 min后还能保持62.4%的活性(图6)。表明暹罗芽孢杆菌JFL15的发酵液中的抗菌活性物质对紫外线不敏感。

图2 基于16S rDNA序列同源分析的系统进化树

图3 发酵上清液对酶的耐受性注:图中不同字母表示抑菌活性达到显著水平,下同.
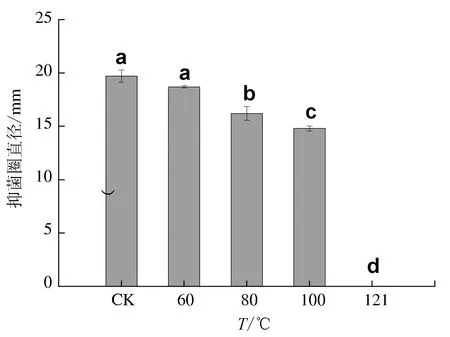
图4 发酵上清液对温度的耐受性
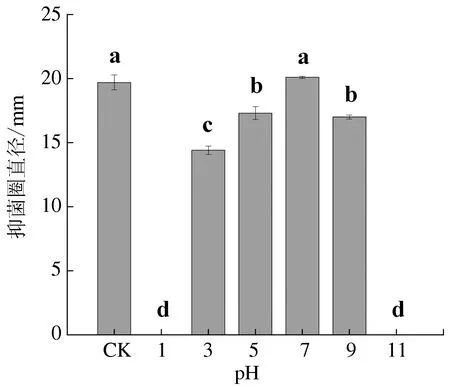
图5 发酵上清液对酸碱的耐受性
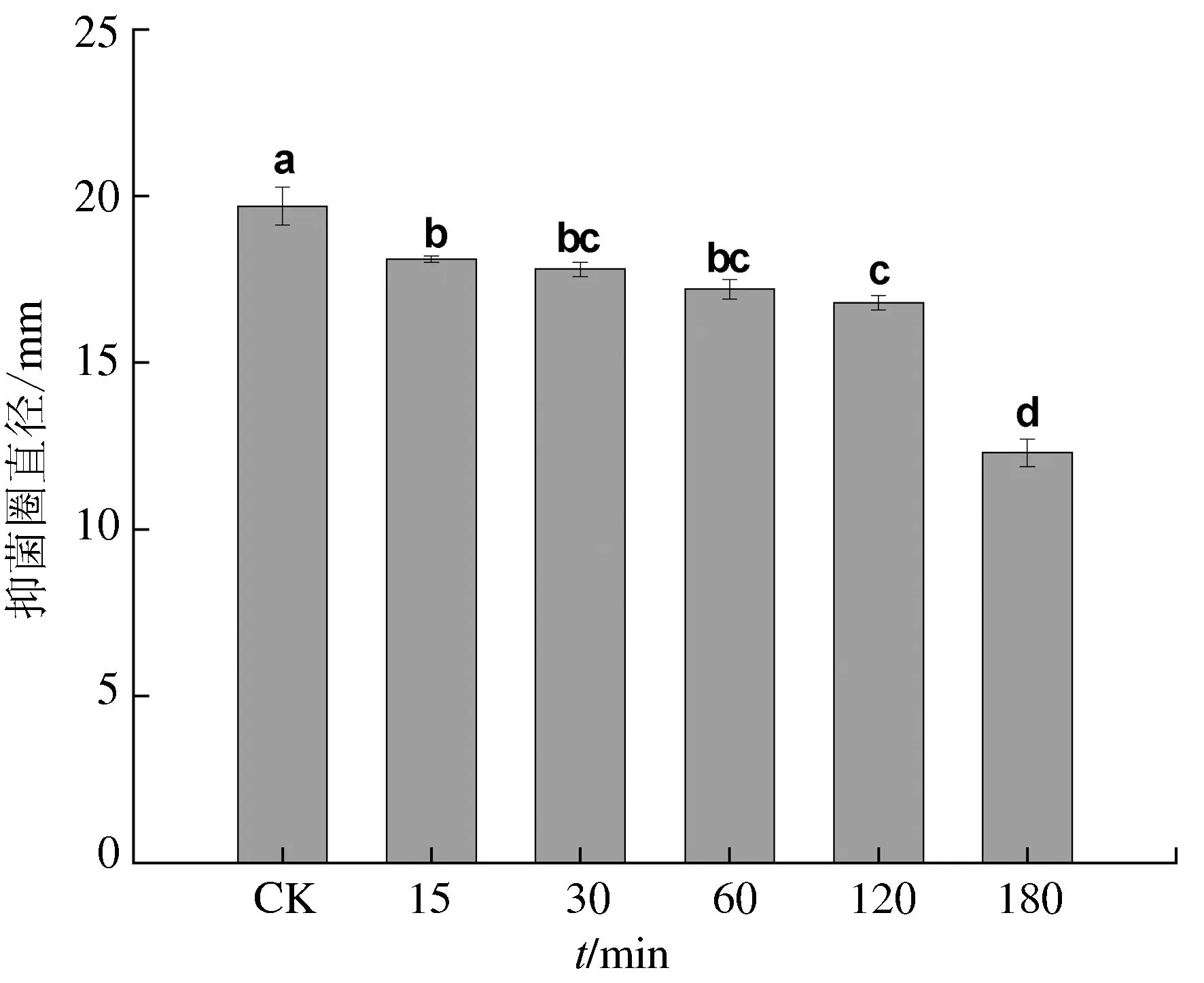
图6 发酵上清液对紫外线的耐受性
2.3.5 储存时间的影响
暹罗芽孢杆菌JFL15的发酵上清液置于4 ℃下储存1、7、14、21、28 d后,其抑菌活性随着储存时间的增加呈现缓慢降低的趋势。储存时间在7 d内,发酵上清液的抑菌活性显著降低,均保持在对照组的95%以上;而从储存8 d开始,其抑菌活性下降较为明显,但发酵液在储存28 d后,活性不低于82.2%(图7)。表明暹罗芽孢杆菌JFL15发酵液中的抗菌活性物质性质稳定,储存28 d还能保持较高的抑菌活性,大大增加了其开发成微生物制剂应用于水产养殖业的价值。
2.4 暹罗芽孢杆菌JFL15发酵上清液的抗菌谱测定
测定了暹罗芽孢杆菌JFL15的发酵上清液对15株水产常见病原菌的抑菌活性,结果表明,暹罗芽孢杆菌JFL15的发酵上清液对嗜水气单胞菌、美人鱼发光杆菌、哈维氏弧菌、溶藻弧菌、大肠杆菌、迟钝爱德华氏菌、铜绿假单胞菌、副溶血弧菌、创伤弧菌、查氏弧菌均有较强抑制活性(表2),其中对美人鱼发光杆菌、哈维氏弧菌、溶藻弧菌、嗜水气单胞菌和迟钝爱德华氏菌的抑菌效果尤为突出。说明暹罗芽孢杆菌JFL15对水产病原菌具有广谱抑菌活性,其在水产动物疾病防治方面具有广阔的应用前景。
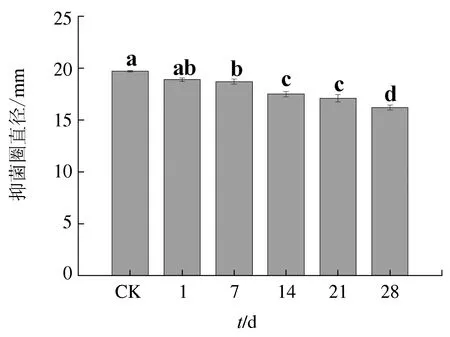
图7 储存时间对发酵上清液抑菌活性的影响
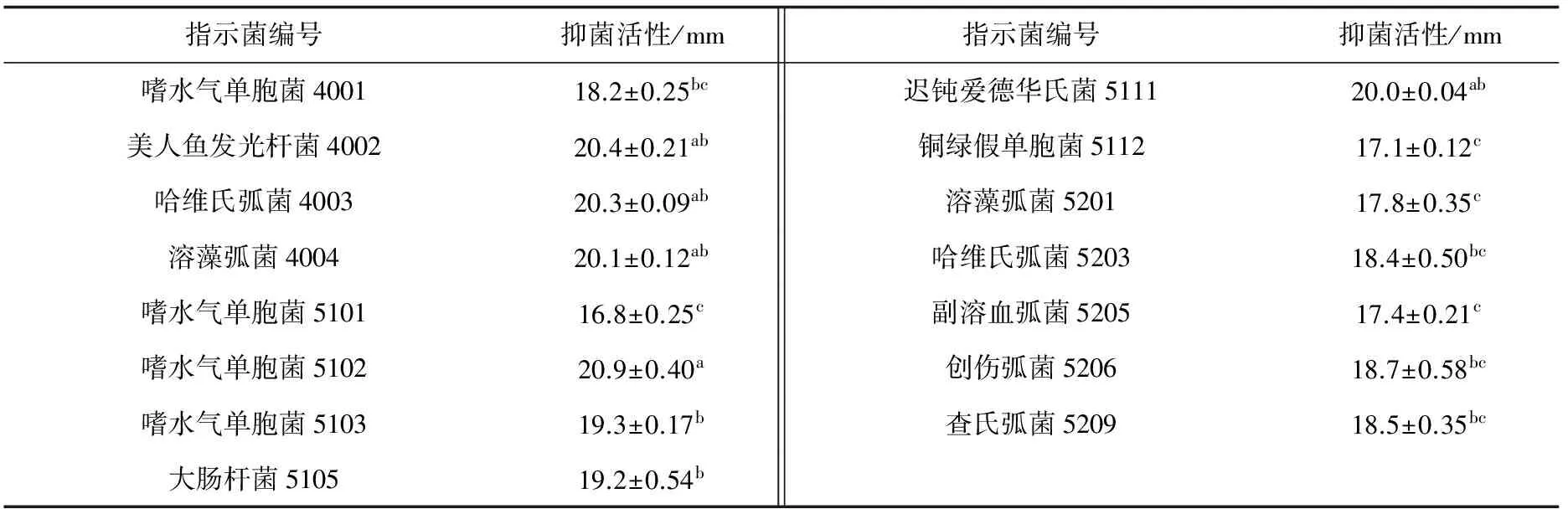
表2 暹罗芽孢杆菌JFL15发酵上清液的抗菌谱
3 讨 论
水产养殖生态环境的破坏和抗生素滥用引起耐药性细菌出现是制约我国水产养殖业健康发展的主要因素,因此,寻找高效低毒、安全绿色的水产养殖用抗生素替代品在现阶段显得尤为重要。芽孢杆菌是一类好养产芽孢的革兰氏阳性细菌,在自然界中分布广泛,其中部分菌株已经成为应用广泛的益生菌[14]。以芽孢杆菌作为抗生素替代品相对于乳酸菌和双歧杆菌来说具有许多优势:第一,稳定性好,具有耐高温、耐酸碱、耐干燥等特点,可以满足饲料加工和运输、储存过程中的要求。且芽孢一旦形成,便能耐受热、压力、紫外线、强酸、强碱、有机溶剂、真空干燥等各种不利环境[15]。第二,芽孢杆菌能产生多种酶[16](如蛋白酶、淀粉酶、脂肪酶等)和营养物质(如氨基酸、维生素B、维生素C、维生素K等),不仅能为水产动物提供营养,而且能提高水产动物的消化能力,从而促进养殖动物的生长。第三,芽孢杆菌能产生更多种抗菌活性物质,据报道,芽孢杆菌能产生细菌素[17-18]、肽类、酶类、抗菌蛋白类[19-20]、大环内酯类[21]、脂肽类[22]和聚酮类化合物[23]等多种抗菌活性物质。因此,芽孢杆菌能更有效的抑菌水产病原菌,提高水产动物的防病能力和免疫力。第四,菌种的来源是进行拮抗菌筛选的一个重要指标,直接关系到拮抗菌的应用效果。从宿主本身或者其生存环境中筛选到的拮抗菌的作用远远优于从异种或者完全不同的环境中分离到的拮抗菌;而且拮抗菌要发挥抗菌活性必须定殖到水产动物肠道的特定部位,这个过程中拮抗菌必须要耐受水产动物上消化道的各种不利环境[24]。因此,本试验从带鱼肠道内分离筛选具有广谱抗菌活性的芽孢杆菌,这样筛出来的菌株才能更好的发挥益生作用。第五,芽孢杆菌不仅能产生抗菌活性物质抑制病原菌,而且能迅速降解和转化养殖环境中的有机物,有效降低水体中的氨氮、亚硝酸盐、硫化物等有害物质的含量,从而有效的改善水质,维持良好的生态环境[25]。
芽孢杆菌家族菌株种类繁多、数量庞大,对其进行分类鉴定非常复杂。传统的芽孢杆菌的分类方法主要有经典分类法(表型特征)、分子分类法和化学分类法[26]。现在的分类研究大多采用多相分类法,即将形态、生理生化、化学、分子等方法相结合,对其进行综合分析,从而得出相对精确的分类结果。但由于芽孢杆菌种类繁多,不同种之间亲缘关系非常接近,以至于在形态、生理生化特征、化学以及16S rDNA序列都非常相似,从而无法对其进行准确分类鉴定;甚至一些分类学家对某些已经鉴定完成的芽孢杆菌的分类地位仍存在争议[27-28]。本研究中对菌株JFL15进行分类鉴定过程中发现,菌株JFL15在形态、生理生化特征及16S rDNA序列与解淀粉芽孢杆菌、贝莱斯芽孢杆菌、暹罗芽孢杆菌和枯草芽孢杆菌都非常接近,虽然在构建系统发育进化树中菌株JFL15与暹罗芽孢杆菌在同一分支,亲缘关系最近,并结合形态学和生理生化特征,将其初步确定为暹罗芽孢杆菌;但实际上暹罗芽孢杆菌JFL15的16S rDNA序列与解淀粉芽孢杆菌、贝莱斯芽孢杆菌、暹罗芽孢杆菌和枯草芽孢杆菌之间只有几个(甚至个别)碱基的不同,而这少数几个碱基的不同有可能是菌株在生长或基因测序过程中突变引起的,造成菌株分类鉴定出现偏差。因此,多相分类法在分类鉴定芽孢杆菌方面还存在一定的局限性。近年来,随着基因组测序技术的飞速发展,大量代表性的模式生物基因组计划和微生物基因组计划相继开展,截止目前,已经有超过1000株芽孢杆菌完成全基因组测序并将序列上传至NCBI数据库中。基于基因组和比较基因组序列分析逐渐成为判定微生物分类及亲缘进化关系的一个常规方法。平均核苷酸同源性[29]是基于物种全基因组序列,通过比较基因组学分析不同物种之间同源基因序列来判定物种间的遗传关联性。平均核苷酸同源性的计算涉及大量的基因,与单基因(如16S rDNA、管家基因gyrB等)相比,具有全面性和精确性优点,可以弥补多相分类法在分类鉴定芽孢杆菌方面的局限性。对本试验中筛选出来的暹罗芽孢杆菌JFL15进行了全基因组测序,并将序列上传至NCBI数据库中(登录号:LFWQ00000000)。接下来将对菌株JFL15进行基于全基因组的平均核苷酸同源性分析,以期获得更准确的分类地位。
本试验中对暹罗芽孢杆菌JFL15的发酵上清液进行了性质研究,结果表明,发酵上清液中的抗菌活性物质对酶、温度、酸碱度、紫外线都很稳定,并且在4 ℃下储存28 d后还能保持较高的活性,说明暹罗芽孢杆菌JFL15产生的抗菌活性物质具有较强的稳定性和环境适应性。对暹罗芽孢杆菌JFL15的抗菌谱的测定发现,暹罗芽孢杆菌JFL15的发酵上清液对嗜水气单胞菌、美人鱼发光杆菌、哈维氏弧菌、溶藻弧菌、大肠杆菌、迟钝爱德华氏菌、铜绿假单胞菌、副溶血弧菌、创伤弧菌、查氏弧菌均具有较强抑制活性,说明暹罗芽孢杆菌JFL15产生的抗菌活性物质具有广谱抑菌活性。Liu等[30]对莫海威芽孢杆菌(B.mojavensis)J7和短小芽孢杆菌(B.pumilus)B16的发酵液进行抗菌活性测定,发现其对副溶血弧菌和创伤弧菌的抑菌活性较弱(抑菌圈直径小于14 mm)。Nair等[31]对蜡样芽胞杆菌(B.cereus)TC-2的发酵液进行抗弧菌研究,发现对哈维氏弧菌和副溶血弧菌的抑菌活性分别13 mm和12 mm。Thongjun等[32]对7株芽孢杆菌的抗菌物质进行粗提取,而粗提物对副溶血弧菌的抑菌圈小于14 mm。以上研究表明,不同种类的芽孢杆菌产抗菌活性物质的能力可能不同,且培养条件和提取方法对抗菌活性有较大影响。本研究中暹罗芽孢杆菌JFL15的发酵上清液在未进行任何培养条件优化和抗菌物质粗提取的条件下对15株水产常见病原菌的抑菌圈直径最低为17 mm,说明暹罗芽孢杆菌JFL15具有高产抗菌活性物质和抗菌谱广等优点。综上所述,暹罗芽孢杆菌JFL15的这些突出特性有利于其被开发成微生物制剂,部分或者完全取代抗生素,广泛应用于水产养殖领域,这将成为今后水产动物疾病防治方面的研究热点。
[1] 胡梦红,王有基.传统抗生素替代物抗菌肽在水产养殖中的应用前景[J].北京水产,2007(1):47-49.
[2] 王熙涛,卢燕丹,王丽丽,等.新型抗生素替代品防治水产动物细菌性疾病的研究进展[J].饲料与畜牧,2015(4):18-22.
[3] 张正文,韩宏.几种替代抗生素的新型水产饲料添加剂[J].科学养鱼,2012(11):71-72.
[4] 张家国,刘翠玲.乳酸菌代替抗生素在水产养殖上的应用[J].中国水产,2014(7):66-68.
[5] 施伟达,章文敏,周冬仁,等.芽孢杆菌研究进展及其在水产养殖中的应用[J].现代农业科技,2012(2):310-311.
[6] Liu X,Li Y,Li J,et al.Isolation and characterisation ofBacillusspp.antagonistic toVibrioparahaemolyticusfor use as probiotics in aquaculture[J].World Journal of Microbiology and Biotechnology,2015,31(5):795-803.
[7] Zhao J,Chen M,Quan C S,et al.Mechanisms of quorum sensing and strategies for quorum sensing disruption in aquaculture pathogens[J].Journal of Fish Diseases,2015,38(9):771-786.
[8] Boopathy R,Kern C,Corbin A.Use ofBacillusconsortiumin waste digestion and pathogen control in shrimp aquaculture[J].International Biodeterioration & Biodegradation,2015,102(s1):159-164.
[9] 东秀珠,蔡妙英.常见细菌鉴定手册[M].北京:科学出版社,2001.
[10] Buchanan R E,Gibbons N E.伯杰氏细菌签定手册[M].8版.北京:科学出版社,1984:375-378.
[11] 郝贵杰,沈锦玉,潘晓义,等.32种常用渔药对大黄鱼致病菌哈维氏弧菌的体外抗菌试验[J].中国兽药杂志,2008(5):36-39.
[12] 张晓华,钟英斌,陈吉祥.哈维氏弧菌的生物学特性、流行病学及检测技术[J].中国海洋大学学报:自然科学版,2007(5):740-748.
[13] 黄静,赵佳,陈哲,等.抗草莓灰霉病的芽孢杆菌CM3的分离与筛选[J].北方园艺,2016(11):113-116.
[14] Pérez-Sánchez T,Ruiz-Zarzuela I,de Blas I,et al.Probiotics in aquaculture: a current assessment[J].Reviews in Aquaculture,2014,6(3):133-146.
[15] 曹海鹏,何珊,王会聪,等.我国水产拮抗芽孢杆菌的研究进展[J].食品科学,2012(9):314-318.
[16] Seo J,Park T S,Kim J N,et al.Production of endoglucanase,beta-glucosidase and xylanase byBacilluslicheniformisgrown on minimal nutrient medium containing agriculture residues[J].Asian-Australasian Journal of Animal Sciences,2014,27(7):946-950.
[17] Benitez L B,Caumo K,Brandelli A,et al.Bacteriocin-like substance fromBacillusamyloliquefaciensshows remarkable inhibition ofAcanthamoebapolyphaga[J].Parasitology Research,2011,108(3):687-691.
[18] Leite J A,Tulini F L,Reis-Teixeira F B D,et al.Bacteriocin-like inhibitory substances (BLIS) produced byBacilluscereus: preliminary characterization and application of partially purified extract containing BLIS for inhibitingListeriamonocytogenesin pineapple pulp[J].LWT - Food Science and Technology,2016(72):261-266.
[19] Chang W,Chen C,Wang S.An antifungal chitinase produced byBacilluscereuswith shrimp and crab shell powder as a carbon source[J].Current Microbiology,2003,47(2):102-108.
[20] Wang N N,Yan X,Gao X N,et al.Purification and characterization of a potential antifungal protein fromBacillussubtilisE1R-J againstValsamali[J].World Journal of Microbiology and Biotechnology,2016,32(4):63-72.
[21] Yuan J,Li B,Zhang N,et al.Production of bacillomycin- and macrolactin-type antibiotics byBacillusamyloliquefaciensNJN-6 for suppressing soilborne plant pathogens[J].Journal of Agricultural and Food Chemistry,2012,60(12):2976-2981.
[22] Mnif I,Grau-Campistany A,Coronel-León J,et al.Purification and identification ofBacillussubtilisSPB1 lipopeptide biosurfactant exhibiting antifungal activity againstRhizoctoniabataticolaandRhizoctoniasolani[J].Environmental Science and Pollution Research,2016,23(7):6690-6699.
[23] Wu L,Wu H,Chen L,et al.Difficidin and bacilysin fromBacillusamyloliquefaciensFZB42 have antibacterial activity againstXanthomonasoryzaerice pathogens[J].Scientific Reports,2015(5):12975.
[24] 于明超,李卓佳,文国樑.芽孢杆菌在水产养殖应用中的研究进展[J].广东农业科学,2007(11):78-81.
[25] 付天玺,魏开建,许国焕.芽孢杆菌在水产养殖中的研究和应用概况[J].水利渔业,2007,27(3):102-104.
[26] 陈蕾,王倩,张惠军.芽孢杆菌最新分类研究进展[J].河南化工,2011(6):14-18.
[27] Dunlap C A,Rooney A P,Kwon S,et al.Bacillusvelezensisis not a later heterotypic synonym ofBacillusamyloliquefaciens;Bacillusmethylotrophicus,Bacillusamyloliquefacienssubsp plantarum and 'Bacillusoryzicola' are later heterotypic synonyms ofBacillusvelezensisbased on phylogenomics[J].International Journal of Systematic and Evolutionary Microbiology,2016,66(3):1212-1217.
[28] Dunlap C A.Phylogenomic analysis shows that ‘Bacillusvanillea’ is a later heterotypic synonym ofBacillussiamensis[J].International Journal of Systematic and Evolutionary Microbiology,2015,65(10):3507-3510.
[29] Jiménez G,Urdiain M,Cifuentes A,et al.Description ofBacillustoyonensissp.nov.,a novel species of theBacilluscereusgroup,and pairwise genome comparisons of the species of the group by means of ANI calculations[J].Systematic and Applied Microbiology,2013,36(6):383-391.
[30] Liu X F,Li Y,Li J R,et al.Isolation and characterisation ofBacillusspp.antagonistic toVibrioparahaemolyticusfor use as probiotics in aquaculture[J].World J Microbiol Biotechnol,2015,31(5):795-803.
[31] Nair A G H,Donio M T B S,Viji V R T,et al.Isolation from coconut retting effluent ofBacilluscereusTC-2 antagonistic to pathogenicVibrio[J].Ann Microbiol,2011,61(3):631-637.
[32] Thongjun J,Taonsila N,Panthong K,et al.Inhibitory potential of biosurfactants fromBacillusamyloliquefaciensderived from mangrove soil againstVibrioparahaemolyticus[J].Ann Microbiol,2016,66(3):1257-1263.

