迟缓爱德华氏菌对大菱鲆巨噬细胞相关生物效应分子产生的影响
秦 蕾,孙玉英,毕可然,高迎莉
(淮海工学院 海洋生命与水产学院,江苏 连云港 222005)
迟缓爱德华氏菌(Edwardsiellatarda)是水产养殖鱼类的一种极其重要的致病原。随着全球水产养殖业的迅猛发展,因该菌引发的病害问题日益突出,给该产业带来了很大的经济损失[1]。鱼类迟缓爱德华氏菌病难以防控的原因是多方面的。其中,迟缓爱德华氏菌是胞内寄生菌,对其致病机理和胞内寄生机制不清楚是主要原因之一。研究表明,鱼类主要通过巨噬细胞参与对迟缓爱德华氏菌感染的炎症应答[2-5]。迟缓爱德华氏菌可以逃避巨噬细胞的吞噬并在巨噬细胞内繁殖,最终导致宿主全身感染[6]。 迟缓爱德华氏菌与巨噬细胞的相互作用是该菌感染致病过程的重要环节,针对其互作机制的研究,对鱼类迟缓爱德华氏菌病的防治具有重要意义。
目前较为集中深入的工作是关于迟缓爱德华氏菌各种毒力因子的研究,包括T3SS、T6SS、双组份系统、溶血素和外膜蛋白等[7-12], 但对迟缓爱德华氏菌复杂的胞内寄生机制仍缺乏足够了解,对迟缓爱德华氏菌与巨噬细胞的互作关系也仍然不明确,这在很大程度上限制了对鱼类迟缓爱德华氏菌病的防治。 巨噬细胞主要通过凋亡、产生活性氧和一氧化氮等效应分子的方式来清除病原微生物[13-15]。本研究通过对不同毒力迟缓爱德华氏感染巨噬细胞后产生的Caspase-3、活性氧和一氧化氮等相关生物效应分子进行测定,探讨不同毒力菌株对巨噬细胞免疫应答的影响,旨在为明晰迟缓爱德华氏菌的致病机理和胞内寄生机制奠定基础,同时也为寻找根除鱼类迟缓爱德华氏菌病的关键靶点开辟新的思路。
1 材料与方法
1.1 试验材料
试验用健康大菱鲆(Scophthalmusmaximus)取自江苏赣榆某大菱鲆养殖场,充氧运回实验室暂养3 d后用于分离巨噬细胞,迟缓爱德华氏菌强毒株和弱毒株分离自不同养殖场患病的大菱鲆,其半数致死密度分别为3.2×102cfu/mL和1.7×106cfu/mL。
1.2 试验试剂
L-15培养基(Gibco);胎牛血清(Gibco);Percoll(Pharmacia);青链霉素、庆大霉素(碧云天);MS-222(杭州动物药品厂);TrypLE(Invitrogen);Caspase-3检测试剂盒(BioVision);活性氧(ROS)测试盒(南京建成);一氧化氮检测(NO)试剂盒(碧云天)。
1.3 大菱鲆头肾巨噬细胞的分离培养
间氨基苯甲酸乙酯甲磺酸盐麻醉大菱鲆,75%酒精消毒鱼体剖取头肾。用加有双抗和庆大霉素的细胞洗涤液清洗头肾,清洗后将其置于100目的细胞筛上研磨得到细胞悬液。利用31%/45%的Percoll密度梯度,400 g,20 min,水平离心分离巨噬细胞。收集位于梯度带的巨噬细胞加入L-15培养基,200 g,5 min离心反复清洗两次。获得的巨噬细胞以1.5×106cfu/mL密度接种于24孔板,20 ℃培养24 h后换新培养基,以去除悬浮细胞,提高巨噬细胞纯度。培养的巨噬细胞TrypLE消化后计数并同时做细胞涂片,甲醛固定用于Giemsa染色观察。
1.4 迟缓爱德华氏菌侵染巨噬细胞
巨噬细胞换新培养基后加入计数好的处于对数生长期的菌液进行感染,感染复数采用50∶1 (设3个重复), 400 g离心5 min,孵育2 h,细胞培养基洗涤3次,加入含有200 μg/mL的庆大霉素处理1 h,洗涤3次后继续培养,在指定的时间点取样做各项检测。同时设不加菌液的细胞作为对照。
1.5 巨噬细胞Caspase-3活性检测
分别在感染后12 h和24 h取样,按Caspase-3检测试剂盒说明进行操作,计数细胞1×106cfu/mL,用50 μL预冷的细胞裂解液重悬细胞,冰上孵育10 min,10 000 g离心1 min,测定上清液蛋白浓度,稀释100 μg蛋白于50 μL细胞裂解液中,先后加入50 μL 2×反应缓冲液(含10 mmol/L DTT)和5 μL 4 mmol/L DEVD-pNA底物(终浓度200 mmol/L),孵育2 h后酶标仪读数A405。
1.6 巨噬细胞产生活性氧检测
活性氧检测工作在菌液加入巨噬细胞后直接进行。分别在感染后30 min和120 min添加DCFH-DA于细胞培养基中(工作浓度10 μmol/L),孵育30 min。TrypLE消化细胞2 min,培养基终止消化,600 g离心5 min收集细胞,预冷的 1磷酸盐缓冲液洗2遍,离心收集细胞沉淀物,磷酸盐缓冲液重悬后酶标仪读数A525。
1.7 巨噬细胞一氧化氮分泌量测定
于感染后6 h和24 h吸取上清培养液。按一氧化氮测定试剂盒操作分别加入Griess试剂,测定细胞培养上清液中巨噬细胞一氧化氮生成量。
1.8 统计分析
所有结果数据以均数加减标准差表示,采用SPSS17.0 软件进行单因素方差分析,P<0.05为差异有统计学意义(P<0.05,与对照组比较;P<0.05,不同毒力感染组比较)。
2 结 果
2.1 大菱鲆头肾巨噬细胞的Giemsa染色观察
培养的大菱鲆头肾巨噬细胞经Giemsa染色见图1,可见细胞形态不规则,胞质丰富,含有大小不等的空泡,胞核较小多偏向一端,符合巨噬细胞典型的形态特点。
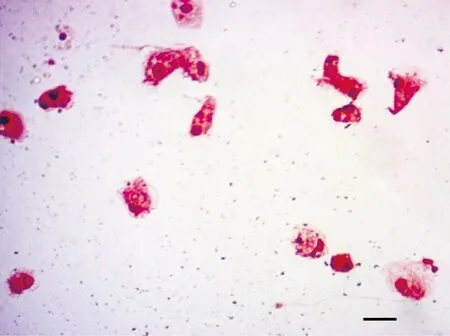
图1 大菱鲆头肾巨噬细胞的Giemsa染色(比例尺=10 μm)
2.2 不同毒力迟缓爱德华氏菌诱发巨噬细胞Caspase-3活性的比较
迟缓爱德华氏菌强毒株和弱毒株分别感染巨噬细胞12 h和24 h后,胞内Caspase-3的活性检测结果见图2。与对照组相比,两株菌感染的巨噬细胞均能检测到较高的Caspase-3活性,而且随时间延长其活性逐渐增加,其中弱毒株感染组Caspase-3的活性在各时间点均显著高于强毒株感染组(P<0.05)。
2.3 不同毒力迟缓爱德华氏菌诱发巨噬细胞产生活性氧的比较
研究结果显示,迟缓爱德华氏菌能够诱发巨噬细胞产生活性氧,感染后30 min,强毒株感染组和弱毒株感染组巨噬细胞产生活性氧差异不显著(P>0.05);但感染后120 min,与弱毒株相比,强毒株能够显著抑制活性氧的产生(P<0.05),表明强毒株未能引发巨噬细胞产生强烈的呼吸爆发(图3)。
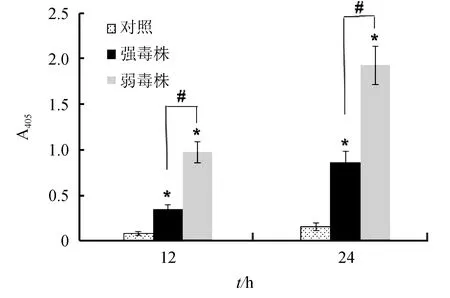
图2 迟缓爱德华氏菌强毒株和弱毒株对巨噬细胞Caspase-3活性的影响
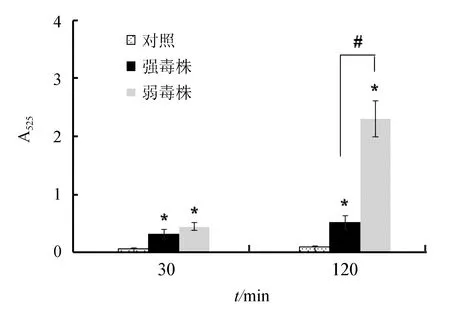
图3 迟缓爱德华氏菌强毒株和弱毒株对巨噬细胞产生活性氧的影响
2.4 不同毒力迟缓爱德华氏菌诱发巨噬细胞分泌一氧化氮的比较
迟缓爱德华氏菌能够诱发大菱鲆巨噬细胞释放一氧化氮,但与弱毒株感染组相比,在各时间点强毒株感染表现出对巨噬细胞释放一氧化氮的抑制作用(P<0.05)(图4)。

图4 迟缓爱德华氏菌强毒株和弱毒株对巨噬细胞分泌一氧化氮的影响
3 讨 论
巨噬细胞不仅是执行固有免疫重要的效应细胞,同时作为抗原呈递细胞也在适应性免疫应答中起重要辅助功能。其强大的吞噬能力能对病原菌造成很大的威胁,而病原微生物在与巨噬细胞的长期斗争过程中会逐渐形成多种逃避杀伤的有效策略,使其得以在巨噬细胞内存活并增殖[16]。已有的研究证实,迟缓爱德华氏菌能够在巨噬细胞内生存和繁殖[17-19],这说明迟缓爱德华氏菌具备适应巨噬细胞杀伤的能力,并且能够在巨噬细胞内大量繁殖并导致随后的全身性感染,而迟缓爱德华氏菌弱毒株却能被巨噬细胞吞噬后逐渐清除显示出较弱的致病能力[14]。
Caspase家族在介导细胞凋亡的过程中起着非常重要的作用,其中caspase-3是最关键的执行分子,它在凋亡信号传导的许多途径中发挥功能。在细胞凋亡的早期阶段,Caspase-3被激活裂解相应的胞浆胞核底物,最终导致细胞的凋亡。Caspase-3的活化是细胞凋亡进入不可逆阶段的标志[20]。巨噬细胞发生凋亡可杀死胞内寄生菌,阻止细菌在宿主体内的传播扩散,并能激活临近未感染的巨噬细胞增强其对病原的杀伤力[21-22]。因此,对胞内寄生菌而言,巨噬细胞的凋亡情况对其命运至关重要。本研究发现,不同毒力的迟缓爱德华氏菌侵染巨噬细胞后都能够检测到Caspase-3的活性,但与弱毒株相比,迟缓爱德华氏菌强毒株能够显著抑制Caspase-3的活性。研究结果表明,迟缓爱德华氏菌能够触发巨噬细胞发生不同程度的凋亡,但强毒株能够抑制巨噬细胞凋亡,从而在胞内存活繁殖,而弱毒株则能诱发巨噬细胞凋亡,导致其最终被清除。Okuda等[18]在迟缓爱德华氏菌感染鼠巨噬细胞的研究中也证实,迟缓爱德华氏菌能够通过上调NF-κB基因的表达来抑制巨噬细胞的凋亡从而来保护自己。 迟缓爱德华氏菌的这种抗凋亡能力可能为其逃离凋亡细胞之前提供足够的时间以改变其毒力相关的表型,从而增强其感染寄生的能力。迟缓爱德华氏菌的抗凋亡机制目前仍不十分清楚,还有待进一步研究。
活性氧在巨噬细胞介导的免疫应答中扮演着极其重要的角色,巨噬细胞受到刺激或进行吞噬作用后能够发生呼吸爆发,产生大量活性氧,并通过活性氧清除吞噬的微生物。然而其产生的氧压力同时对巨噬细胞本身也会产生重要的影响[23]。已发现迟缓爱德华氏菌能够抑制蓝曼龙头肾巨噬细胞和牙鲆腹腔巨噬细胞活性氧的释放[14,17]。同样,本研究结果显示迟缓爱德华氏菌强毒株未能引起大菱鲆头肾巨噬细胞产生强烈的呼吸爆发,进一步证实该菌株有能力阻止巨噬细胞产生活性氧,以达到保护自己和减少巨噬细胞受损从而为其提供更适居住场所的双重目的。迟缓爱德华氏菌抑制活性氧产生的机制尚不十分明确。我们之前的研究发现迟缓爱德华氏菌能够上调RhoGDI蛋白的表达(数据尚未发表), 该蛋白被证实能够抑制活性氧的主要来源-NADPH氧化酶的活化[24],或许能够解释这一现象,但迟缓爱德华氏菌抑制巨噬细胞产生活性氧的真正机制还有待探讨。
作为活化巨噬细胞产生的一种重要的细胞效应分子,一氧化氮能够介导巨噬细胞抑制和杀伤细菌、病毒及寄生虫等病原体,是巨噬细胞防御系统中的一个重要因子[25]。本研究发现,与弱毒株相比,迟缓爱德华氏菌强毒株能够显著抑制大菱鲆头肾巨噬细胞产生大量一氧化氮。与之类似,强毒力结核杆菌也表现出对巨噬细胞分泌一氧化氮的抑制作用[26]。 迟缓爱德华氏菌强毒株表现出对巨噬细胞产生一氧化氮的抑制作用可能是其能够逃避巨噬细胞杀伤的重要原因之一。然而,Ishibe等[15]研究却发现相较于弱毒株,迟缓爱德华氏菌强毒株能诱发牙鲆腹腔巨噬细胞更多的一氧化氮产生。不同来源的巨噬细胞对迟缓爱德华氏菌应答出现部分差异,可能与巨噬细胞存在的异质性有关[27],但也无法排除菌株之间的差异所导致的结果。
本研究阐明了不同毒力迟缓爱德华氏菌感染对巨噬细胞应激的调控作用,初步揭示了迟缓爱德华氏菌与巨噬细胞相互作用的机理,即强毒株和弱毒株分别对巨噬细胞的应激发挥抑制和诱导作用,从而影响了细菌的生长,繁殖和宿主的发病,为阐明迟缓爱德华氏菌病的发病机制提供了理论依据。
[1] Xu T T,Zhang X H.Edwardsiellatarda:an intriguing problem in aquaculture [J].Aquaculture,2014,431(2):129-135.
[2] Darwish A,Plumb J A,Newton J C.Histopathology and pathogenesis of experimental infection withEdwardsiellatardain channel catfish[J].J Aquat Anim Health,2000,12(4):255-266.
[3] Meagan E P,Peter E,Phelan Ⅲ,et al.Pathogenesis and inflammatory response toEdwardsiellatardainfection in the zebrafish[J].Dev Comp Immunol,2005,29(6):501-513.
[4] Padrós F,Zarza C,Dopazo L,et al.Pathology ofEdwardsiellatardainfection in turbot,Scophthalmusmaximus(L.)[J].J Fish Dis,2006,29(2):87-94.
[5] Qin L,Xu J,Wang Y G.Edwardsiellosis in farmedScophthalmusmaximus(L.),associated with unusual variant ofEdwardsiellatarda: a clinical,aetiological and histopathological study[J].J Fish Dis,2014,37(2):103-111.
[6] Leung K Y,Siame B A,Tenkink B J,et al.Edwardsiellatarda-virulence mechanisms of an emerging gastroenteritis pathogen[J].Microbes Infect,2012,14(1):26-34.
[7] 王波,莫照兰.迟缓爱德华氏菌及其致病机理[J].海洋科学集刊,2007(48):138-144.
[8] 贺扬,张晓华.迟缓爱德华氏菌致病相关因子的研究进展[J].中国海洋大学学报:自然科学版,2009,39(5):979-987.
[9] 王斌,李军伟,赵凤梅,等.迟钝爱德华氏菌Ⅲ型分泌系统效应蛋白功能域预测[J].水产科学,2013,32(7):385-390.
[10] Hu Y H,Sun L.The global regulatory effect ofEdwardsiellatardaFur on iron acquisition,stress resistance,and host infection: a proteomics-based interpretation[J].J Proteomics,2016,140(5):100-110.
[11] Chen H,Yang D H,Han F J,et al.The bacterial T6SS effector EvpP prevents NLRP3 inflammasome activation by inhibiting the Ca2+-Dependent MAPK-Jnk Pathway[J].Cell Host Microbe,2017,21(1): 47-58.
[12] Liu F,Tang X,Sheng X,et al.Comparative study of the vaccine potential of six outer membrane proteins ofEdwardsiellatarda,and the immune responses of flounder (Paralichthysolivaceus) after vaccination[J].Veterinary Immunology & Immunopathology,2017,185(2):38-47.
[13] Lancellotti M,Brocchi M,Silveira W D D.Bacteria- induced apoptos and approach to bacterial pathogenesis[J].Braz J Morphol Sci,2006,23(1):75-86.
[14] Ishibe K,Osatomi K,Hara K,et al.Comparison of the responses of peritoneal macrophages from Japanese flounder (Paralichthysolivaceus) against high virulent and low virulent strains ofEdwardsiellatarda[J].Fish and Shellfish Immun,2008,24(2):243-251.
[15] Ishibe K,Yamanishi T,Wang Y,et al.Comparative analysis of the production of nitric oxide (NO) and tumor necrosis factor-[alpha](TNF-[alpha]) from macrophages exposed to high virulent and low virulent strains ofEdwardsiellatarda[J].Fish and Shellfish Immun,2009,27(2):386-389.
[16] 罗云蔓,郭晓奎,姜叙诚.病原菌逃避单核-巨噬细胞杀灭策略的研究进展[J].微生物与感染,2010,5(2):117-120.
[17] Srinivasa R P S,Lim T M,Leung K Y.Opsonized virulentEdwardsiellatardastrains are able to adhere to and survive and replicate within fish phagocytes but fail to stimulate reactive oxygen intermediates[J].Infect Immun,2001,69(9):5689-5697.
[18] Okuda J,Arikawa Y,Takeuchi Y,et al.Intracellular replication ofEdwardsiellatardain murine macrophage is dependent on the type Ⅲ secretion system and induces an up-regulation of anti-apoptotic NF-κB target genes protecting the macrophage from staurosporine-induced apoptosis[J].Microb Pathogenesis,2006,41(6):226-240.
[19] Qin L,Sun Y Y,Zhao Y J,et al.In vitro model to estimateEdwardsiellatarda-macrophage interactions using RAW264.7 cells[J].Fish & Shellfish Immun,2017,60(1):177-184.
[20] Porter A G,Janicke R U.Emerging roles of caspase-3 in apoptosis[J].Cell Death Differ,1999,6(2):99-104.
[21] Vaux D L,Häcker G.Hypothesis: apoptosis caused by cytotoxins represents a defensive response that evolved to combat intracellular pathogens[J].Clin Exp Pharmacol Physiol,1995,22(11):861-863.
[22] 史会连,孙东平,陈澍,等.结核杆菌毒力的研究进展 [J].中华微生物学和免疫学杂志,2012,32(4):378-380.
[23] Pick E.Role of the Rho GTPase Rac in the activation of the phagocyte NADPH oxidase: outsourcing a key task[J].Small Gtpases,2014,5(1):e27952.
[24] Abo A,Webb M R,Grogan A,et al.Activation of NADPH oxidase involves the dissociation of p21rac from its inhibitory GDP/GTP exchange protein (rhoGDI) followed by its translocation to the plasma membrane[J].Biochem J,1994,298(3):585-591.
[25] O′brien L,Carmichael J,Lowrie D B,et al.Strains ofMycobacteriumtuberculosisdiffer in susceptibility to reactive nitrogen intermediates in vitro[J].Infect Immun,1994,62(11):5187-5190.
[26] 刘丹霞,董伟杰,庹清章,等.不同毒力结核分枝杆菌对感染宿主巨噬细胞应激的调控作用研究[J].中国病原生物学杂志,2013(3):217-219.
[27] Forlenza M,Fink I,Raes,R G,et al.Heterogeneity of macrophage activation in fish[J].Dev Comp Immunol,2001,35(12):1246-1255.

