鲟源迟钝爱德华氏菌的分离鉴定与药敏特性研究
孔 杰,李小义,周 洲,关 梅,石 婧
(1.贵州省水产研究所,贵州 贵阳 550025;2.贵州省疾病预防控制中心,贵州 贵阳 550004)
鲟鱼是一类古老的软骨硬鳞鱼类,素有“活化石”之称,具有巨大的经济和科研价值。鲟鱼几乎全身是宝,肉质鲜美,富含多种人体必需氨基酸;鱼鳔含有高级胶质可配制上等漆料,还可入药,而鲟鱼卵做成的鱼子酱更有“黑色黄金”的美名。强大的市强需求刺激着我国鲟鱼养殖市场的发展与扩大,然而由于没有规范的引种与养殖制度,鲟鱼养殖环境不断恶化,使鲟鱼细菌性疾病发生率不断增加。已有报道的主要致病菌包括:气单胞菌(Aeromonas)属革兰氏阴性菌,如嗜水气单胞菌(A.hydrophila)、维氏气单胞菌(A.veronii)、豚鼠气单胞菌(A.carvia)和类志贺邻单胞菌(Plesimonasshigelloides)[1-3];革兰氏阳性菌链球菌(Streptococcus),如停乳链球菌(S.dysgalactiae)、海豚链球菌(S.iniae);此外还有鲁氏耶尔森氏菌(Yersiniaruckeri)、弗氏柠檬酸杆菌(Citrobacterfreundii)[4-7]等。
迟钝爱德华氏菌(Edwardsiellatarda),属肠杆菌科爱德华氏菌属,本属细菌可分为3个种,即迟钝爱德华氏菌、鲇鱼爱德华氏菌(E.ictaluri)和保科爱德华氏菌(E.hoshinae)。迟钝爱德华氏菌和鲇鱼爱德华氏菌已被大量研究证实为重要的鱼类病原微生物,而保科爱德华氏菌不能引起鱼类疾病。迟钝爱德华氏菌最初于1962年被日本学者Hoshina在鳗鲡(Anguillajapancia)中发现[8],随后又分别在人类的排泄物和爬行类中分离到,是一种人鱼共患的条件致病菌,也是爱德华氏菌属里唯一感染人的病原菌,能引起患者腹泻、肠胃炎、败血症及黄疸等疾病。迟钝爱德华氏菌是水产养殖业中危害极大的革兰氏阴性菌之一,它能引起鳗鲡、褐牙鲆(Paralichthysolivaceus)、大菱鲆(Scophthalmusmaximus)、大鳞大麻哈鱼(Oncorhynchustshawytscha)[9-12]等数十种水产动物疾病。
2013年7月,贵州省惠水县鲟鱼养殖场养殖的杂交鲟[施氏鲟(Acipenserschrenckii♀)×达氏鳇(Husodauricus♂)]发生大量死亡,病鱼的主要症状为腹部出现血点,肛门红肿,鳃丝变白,部分尾部出现白色溃烂。剖检发现内脏器官无血色,肝脏与肾脏肿大,严重的肠坏死穿孔。笔者从具有明显发病症状的杂交鲟中分离得到一株高致病性病原菌,经过生理生化鉴定、回归感染、16S rDNA序列分析和系统发育分析对该菌进行了分类鉴定,确定该致病菌为迟钝爱德华氏菌,并研究了其药敏特性,以期为鲟鱼防治迟钝爱德华氏菌提供理论参考依据。
1 材料与方法
1.1 材料
2014年7月采集濒死病鱼于贵州省水产研究所惠水鲟鱼繁育基地;回归感染用的健康杂交鲟也来自该基地,健康杂交鲟鱼放水族箱中暂养7 d,无异常后进行试验。
1.2 主要试剂
细菌基础固体培养基、水解酪蛋白琼脂按常规方法自配,细菌基因组DNA提取试剂盒、taq DNA聚合酶、dNTP等购自TAKARA公司,药敏试纸片、细菌生化微量鉴定管均购自杭州滨和微生物试剂有限公司。
1.3 方法
1.3.1 病原菌的分离纯化
2014年7月,贵州省惠水鲟鱼养殖基地部分养殖池内发生鲟鱼规模性疾病,病死鱼头腹朝天,腹部肿胀并出现明显的血点,选取具有典型症状濒死鲟鱼,用70%酒精对鱼体表面进行消毒灭菌,无菌环境下取病鱼肾组织用于细菌分离,用经过灼烧的接种环取少量器官组织划线于细菌基础培养基平板上,置28 ℃下培养24 h后挑取形态大小、颜色等菌落特征一致的优势菌落进一步纯化,纯化后的菌株用含30%甘油的LB培养液于冰箱-80 ℃保存备用。
1.3.2 理化特性测定
选取纯化分离菌株,测定温度5、15、20、28、35、42 ℃下的生长情况;测定盐度(即NaCl质量分数)为0~7%下的生长情况;测定pH值为3.0~10.0下的生长情况。应用细菌生化微量鉴定管进行细菌的常规生理生化测定。
1.3.3 16S rDNA基因序列的测定与分析
纯化培养的菌株,按照DNA提取试剂盒说明书提取细菌基因组DNA。PCR扩增引物使用细菌16S rDNA通用引物(27f:5′-AGAGTTTGATC-CTGGCTCAG-3′,1492r:5′-GGTTACCTTGTTA-CGACTT-3′);PCR扩增产物由生工生物工程上海(股份)有限公司进行测序。用BLAST在线同源性查询软件查询菌株的16S rDNA序列属性。从GenBank数据库获得同源性为98%的8株菌的16S rDNA序列,并选择鲇鱼爱德华氏菌模式菌株、保科爱德华氏菌模式菌株共4株、与爱德华氏菌进化关系较近的阪崎肠杆菌(Enterobactursakazakii)的16S rDNA序列进行同源性序列比对分析,然后构建菌株系统发育进化树。
1.3.4 回归感染试验
选取体长10~12 cm的健康杂交鲟,设试验组、平行试验组、对照组和平行对照组,每组10尾。将纯培养的菌落制成菌悬液,用麦氏比浊法测定并调节菌密度为1×109cfu/mL,分别对试验组与平行试验组鲟鱼进行胸鳍基部注射,每尾注射0.3 mL,对照组与平行对照组注射相同剂量的无菌生理盐水。试验期间,水温控制在23~25 ℃,充氧,隔日换水,连续观察11 d至无新增死亡,记录鱼的发病和死亡情况,并对濒死鱼及时剖检并再次分离纯化鉴定致病菌。
1.3.5 药物敏感性测定
对分离并经鉴定的菌株采用琼脂扩散纸片法进行常用抗菌类药物的敏感性测定,以明确这些菌株的耐药情况并为临床防治的用药提供参考。药敏试验结果判别按照美国临床实验室标准化协会相关标准[13]执行。
2 结 果
2.1 病原菌的分离纯化
从病鱼的肾中分离到菌落形态相同的优势菌,28 ℃培养24 h的菌落在LB固体培养基上呈圆形光滑、半透明、边缘整齐、灰白色菌落。革兰氏阴性杆菌,将病原菌编号为K9。
2.2 生理生化鉴定
经测定,盐度为0~30时菌株K9生长正常,40以上盐度不生长;pH为5~8时生长正常,最适pH为7。其他生理生化特性见表1,菌株ET81126[14]、菌株HC010907-1[10]、菌株HN005[15]均为已鉴定的迟钝爱德华氏菌,除了对蔗糖的利用与ET81126和HN005不同外,菌株K9的其他特性与迟钝爱德华氏菌株表现一致。

表1 菌株K9的生理生化特性
注:+表示阳性,-表示阴性,+/-表示介于+与-之间.
2.2 病原菌的16S rDNA鉴定
菌株K9经PCR扩增所获得的16S rDNA基因序列长度为1468 bp,GeneBank 登录号为:KY489780;在GeneBank 数据库上进行同源性比对分析,结果显示,菌株K9与迟钝爱德华氏菌的同源性为98%。在EZTaxon上进行同源序列比对,结果显示,K9菌株与爱德华氏菌ET833(T) (JRGQ01000134)、鲇鱼爱德华氏菌ATCC_33202(T) (AFJI01000002)、保科爱德华氏菌NBRC105699T (BAUC01000062)、迟钝爱德华氏菌NBRC_105688(T) (BANW01000030)的相似性分别为98.34%、97.99%、97.91%、97.71%。选择以上序列以及肠杆菌科中的阪崎肠杆菌构建进化树,结果见图1,菌株K9与迟钝爱德华氏菌聚为1支。细菌分类学上,通常将16S rRNA基因同源性大于97.5%的菌株定为同种菌株[16-17],因此综合生化指标、16S rDNA基因序列分析以及进化树的分析结果,可将菌株K9鉴定为迟钝爱德华氏菌。

图1 根据菌株K9 16S rDNA基因序列同源性构建的系统发育树
2.3 回归感染试验结果
分离迟钝爱德华氏菌K9通过接种感染,显示对杂交鲟有强致病力。在11 d的感染中,试验组感染24 h后开始发病死亡,1 d内死亡4尾,之后2 d又死亡3尾,至第11 d共死亡8尾。试验过程中,死亡鱼腹部两侧出现红点,肛门红肿,鳃丝变白,在试验后期死亡的鱼背部出现白色溃烂,肠部穿孔。病症与自然发病鲟鱼基本一致。平行试验组11 d的观察中,共死亡7尾,而对照组与平行对照组在感染试验期内,没有发病死亡病例。从感染死鱼中再次分离菌株,经16S rDNA鉴定,与从自然发病鲟鱼中所分离的菌株为同一株。
2.4 药物敏感试验结果
分离迟钝爱德华氏菌K9对20种药物敏感性研究结果表明,迟钝爱德华氏菌K9对链霉素、阿米卡星、左氧氟沙星、阿齐霉素、新霉素、氯霉素(禁药)等6种抗生素敏感,对头孢噻肟、阿莫西林、头孢唑啉、氨苄西林、红霉素(禁药)等5种抗生素等中度敏感,对青霉素G、妥布霉素、麦迪霉素等9种抗生素耐药(表3)。
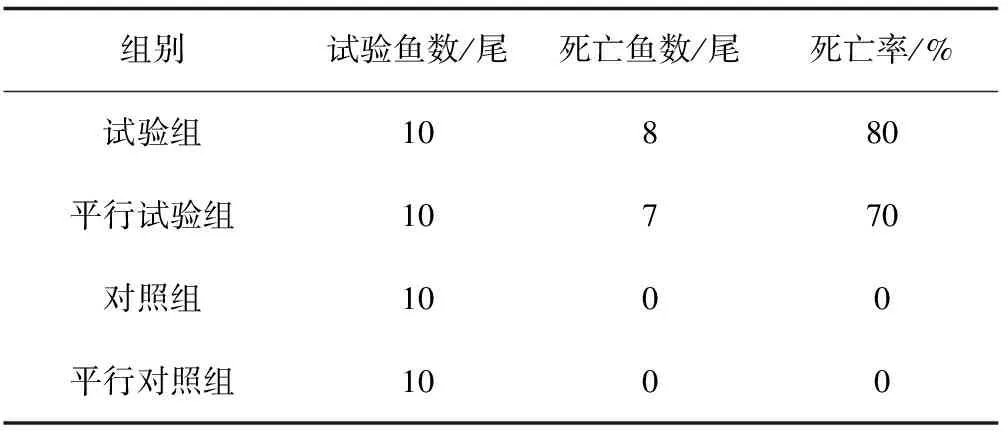
表2 迟钝爱德华氏菌K9对鲟鱼的致性病试验

表3 分离迟钝爱德华氏菌K9药敏试验结果
注:S,敏感;I,中度敏感; R,抗性.
3 讨 论
迟钝爱德华氏菌于1962年首次在鳗鲡中被发现,随后在大口黑鲈(Micropterussalmoides)[18]、美洲红点鲑(Salvelinusfontinalis)[19]、罗非鱼(Oreochromis)[20]、褐牙鲆[10]、大菱鲆[21]、黄颡鱼(Pelteobagrusfulvidraco)[15]、尖吻鲟(Acipenseroxyrinchus)[22]、斑马鱼(Daniorerio)[23]等数十种水产品种中均有报道。本研究从患病的杂交鲟肾脏组织中分离到1株革兰氏阴性杆菌K9,人工感染试验表明K9能使健康鲟鱼致病死亡,表现出与自然感染下相似的临床症状。迟钝爱德华氏菌对斑马鱼与透明四带无须鲃(Puntiustetrazona)[23]的人工感染试验表明,当菌液密度达到106cfu/mL时,能分别引起90%和80%的死亡率;在迟钝爱德华氏菌株ET81126在对欧洲鳗(A.anguilla)的致病性试验中[14],当菌液密度为106cfu/mL时,欧洲鳗的死亡率达到了100%;尖吻鲟源迟钝爱德华氏菌的死亡率为50%[22];本研究中,迟钝爱德华氏菌K9的人工感染试验结果显示,在菌液密度为109cfu/mL时,引起鲟鱼75%的死亡率,表明迟钝爱德华氏菌对鲟鱼的致病性较其他水生动物弱。
本研究的药敏结果显示,迟钝爱德华氏菌K9只对链霉素、阿米卡星、左氧氟沙星、阿齐霉素、新霉素、氯霉素等6种药物敏感,对青霉素G、妥布霉素、麦迪霉素、呋喃唑酮等9种抗生素表现出很强的耐药性。与分离自斑马鱼中菌株Z1[23]相比,在Z1表现为敏感的药物中,如青霉素G、妥布霉素、头孢唑啉、庆大霉素、红霉素、卡那霉素,K9表现均为中度敏感甚至耐受。与分离自牙鲆[10]中的迟钝爱德华氏菌相比,K9对该菌株表现为敏感的头孢曲松、妥布霉素、呋喃唑酮和耐药的青霉素、克林霉素均表现耐受性,表明K9耐药性较为强烈。葛慕湘等[24]对35株迟钝爱德华氏菌的耐药检测显示,大部分菌株耐抗菌类药物达7~9种。本次试验分离到的迟钝爱德华氏菌耐受9种抗生素,与其研究结果相同,进一步表明迟钝爱德华氏菌的耐药性严重性。本研究中迟钝爱德华氏菌表现为耐药性的抗生素,并非意味着该菌株对这些抗生素完全耐受,从刁菁等[25]的研究中可以看出,虽然迟钝爱德华氏菌在低抗生素含量下表现为耐受,但是随着抗生素含量的增加细菌的生长受到抑制。因此,迟钝爱德华氏菌K9表现为耐受的抗生素,也可能会在增加抗生素含量后表现为敏感。需注意的是,在本次药敏试验所用抗生素中,氯霉素、红霉素和呋喃唑酮为国家禁用抗生素,仅供试验研究用,严禁用于生产中。因此,防治迟钝爱德华氏菌引起的疾病,可以考虑采用其他迟钝爱德华氏菌K9敏感的抗生素,如阿米卡星、左氧氟沙星、阿齐霉素、新霉素。迟钝爱德华氏菌感染鱼体通常是由水温升高所致[22],因而建议养殖中注意控制水温,当疾病发生后,除给药外,还应同时采取相应的降温措施。
目前水产养殖中对细菌性疾病的防治仍以抗生素为主,而长期使用抗生素极易产生耐药菌株,本研究中分离到具有较强耐药性菌株K9,可能就是由于生产上长期使用抗生素导致。中草药不易产生耐药性、毒副作用小,成为研究抗菌药物的热点。杨移斌等[26]就曾对鲟源的3种致病菌进行过中草药研究,结果表明,乌梅、石榴皮、地榆、杞子对防治鲟鱼细菌性疾病效果良好。而不同来源的迟钝爱德华氏菌也开展过许多中草药抑菌研究,如五倍子与石榴皮对斑马鱼源的迟钝爱德华氏菌抑菌作用明显[23],最小抑菌质量浓度和最小杀菌质量浓度均≤6.25 mg/mL;五倍子、诃子、黄芩、秦皮和红藤对牙鲆源的迟钝爱德华氏菌抑菌作用明显[27],最小抑菌质量浓度<12.5 mg/mL,最小杀菌质量浓度<50 mg/mL;五倍子+黄芩、五倍子+大黄、黄连+黄芩和大黄+黄芩对石斑鱼源的迟钝爱德华氏模式菌具有明显的强力杀菌作用[28],最小抑菌质量浓度和最小杀菌质量浓度均≤3.125 mg/mL;陈言峰等[29]研究表明,20种中草药中五倍子的杀菌能力极强,最小抑菌质量浓度为1.5626 mg/mL;从以上数据可以看出,五倍子对防治迟钝爱德华氏菌具有明显的作用,在防治鲟源迟钝爱德华氏菌中不仅可以考虑本文中给出的抗生素药物,还可以考虑中草药的防治方法。
[1] 杨治国.鲟鱼嗜水气单胞菌的分离鉴定[J].淡水渔业,2001,31(5):40-41.
[2] 杨移斌,夏永涛,邱军强,等.鲟源维氏气单胞菌分离鉴定及药敏特性研究[J].四川动物,2014,33(3):414-418.
[3] 曹海鹏,杨先乐,高鹏,等.鲟细菌性败血综合征致病菌的初步研究[J].淡水渔业,2007,37(2):53-56.
[4] 潘厚军,刘晓勇,常藕琴,等.西伯利亚鲟停乳链球菌的分离、鉴定与致病性[J].中国水产科学,2009,16(6):891-903.
[5] 邓梦玲,耿毅,刘丹,等.西伯利亚鲟海豚链球菌的分离鉴定及毒力基因检测[J].水产学报,2015,39(1):127-135.
[6] 杨移斌,夏永涛,郑卫东,等.鲟源鲁氏耶尔森氏菌的分离鉴定[J].水生生物学报,2013,37(2):393-398.
[7] 杨移斌,夏永涛,赵蕾,等.鲟源弗氏柠檬酸杆菌分离鉴定及药敏特性研究[J].水生生物学报,2013,37(4):766-771.
[8] Hoshina T.On a new bacterium,Paracolobactrumanguillimortifn.sp.[J].Bull Jpn Soc Sci Fish,1962,28(2):162-164.
[9] Amandi A,Hiu S F,Rohovec J S,et al.Isolation and characterization ofEdwardsiellatardafrom fall chinook salmon (Oncorhynchustshawytscha)[J].Applied & Environmental Microbiology,1982,43(6):1380-1384.
[10] 张晓君,战文斌,陈翠珍,等.牙鲆迟钝爱德华氏菌感染症及其病原的研究[J].水生生物学报,2005,29(1):31-26.
[11] 王印庚,秦蕾,张正,等.养殖大菱鲆的爱德华氏菌病[J].水产学报,2007,31(4):487-495.
[12] 陈昌福,吴志新,高汉娇.日本鳗鲡爱德华氏菌病原菌的分离[J].华中农业大学学报:自然科学版,1998,17(4):382-388.
[13] Clainical and Laboratory Standards Institute.CLSI document M100-S21,Performance Standards for Antimicrobial Susceptibility Testings[S].950 West Valley Road,Suite 1400,Wayne,Pennsylvania 19087,USA: Clinical and Laboratory Standards Institute,2011.
[14] 陈强,龚晖,杨金先.欧洲鳗迟钝爱德华氏菌的分离鉴定[J].中国人兽共患病学报,2011,27(1):7-10.
[15] 邓先余,罗文,谭树华,等.黄颡鱼(Pelteobagrusfulvidraco)“红头病”病原菌迟钝爱德华氏菌(Edwardsiellatarda)的分离及鉴定[J].海洋与湖沼,2008,39(5):511-516.
[16] 鲁辛辛,黄艳飞,田晓波.细菌rDNA分类鉴定的方法学研究[J].中华检验医学杂志,2006,29(5):435-437.
[17] 蹇文婴,东秀珠.定向进化同源基因在细菌系统进化研究中的应用[J].微生物学通报,2000,27(5):377-381.
[18] Francis-Floyd R,Reed P,Bolon B.An epizootic ofEdwardsiellatardain largemouth bass (Micropterussalmoides)[J].Journal of Wildlife Diseases,1993,29(2):334-336.
[19] Uhland F C,Helie P,Higgins R.Infections ofEdwardsiellatardaamong brook trout in Quebec[J].Journal of Aquatic Animal Health,2000,12(1):74-77.
[20] Clavijo A M,Conroy G,Conroy D A.First report ofEdwardsiellatardafrom tilapias in Venezuela[J].Bull Eur Assoc Fish Pathol,2002,22(4):280-282.
[21] 秦蕾.迟钝爱德华氏菌感染大菱鲆的病理学研究[J].中国水产科学,2009,16(3):411-419.
[22] Francis-Floyd R,Dvm M S.Disease History of Cultured Sturgeon in Florida,1990-1999 [G]//Metcalf K,Zajicek P.Proceedings of the Florida Sturgeon Culture Risk Assessment Workshop,Florida: Florida Department of Agriculture and Comsumer Services,2000:33-37.
[23] 刘春,李凯彬,王庆,等.斑马鱼迟缓爱德华氏菌的鉴定、致病性及药物敏感性[J].华中农业大学学报:自然科学版,2013,32(3):105-111.
[24] 葛慕湘,靳晓敏,张艳英,等.迟钝爱德华氏菌耐药表型及4种耐药基因检测[J].水产科学,2015,34(5):300-304.
[25] 刁菁,杨秀生,叶海斌,等.一种水产迟钝爱德华氏菌快速药敏检测方法的研究[J].水产科学,2014,33(1):29-34.
[26] 杨移斌,曹海鹏,夏永涛,等.41种中草药对3种鲟源病原菌的体外抑菌效果[J].淡水渔业,2013,43(4):80-84.
[27] 朱壮春,史相国,张淑杰,等.中草药对牙鲆病原迟钝爱德华氏菌的体外抑制作用研究[J].水产科学,2007,26(5):278-281.
[28] 李瑞,白东清,郭永军,等.9种中草药及17组方对迟钝爱德华氏菌的体外抑菌试验[J].水利渔业,2008,28(4):114-116.
[29] 陈言峰,邹记兴.20种中草药对迟缓爱德华氏菌的体外抑菌试验[J].水生态学杂志,2011,32(5):110-112.

