UGT1A1基因多态性与伊立替康治疗结直肠癌疗效及安全性的关系
王 琼 肖葛琼 尉理梁
伊立替康(irinotecan,CPT-11)是一种治疗转移性结直肠癌的特效药,为喜树碱半合成衍生物,在体内被羧酸酯酶水解后抑制细胞周期S期DNA单链断裂后的修复过程,从而干扰DNA的复制和转录[1]。众多研究显示,伊立替康作为化疗药物之一能够明显提高患者无疾病进展生存时间和总生存时间,提高化疗效果[2-4]。然而有研究[5]表明,伊立替康化疗能够导致患者产生剂量依赖性毒性,产生相关不良反应,严重可导致患者死亡,这其中药物代谢的遗传因素多态性可能是造成个体间药物不良反应差异的主要原因之一。国外研究[6]显示,采用伊立替康治疗的患者,UGT1A1*28基因多态性能够影响患者不良反应的风险。有研究[7]显示,UGT1A1*6基因多态性也能够影响伊立替康治疗的患者的药物副作用。而UGT1A1*6和UGT1A1*28基因多态性可能存在种族差异,因此研究UGT1A1基因多态性与伊立替康治疗结肠癌的疗效和安全性具有非常重要的临床意义。本研究分析了72例采用伊立替康治疗结肠癌的患者UGT1A1基因多态性与伊立替康治疗的疗效和不良反应之间的关系,报道如下。
1 资料与方法
1.1 临床资料 随机选择2012年8月—2016年9月我院收治的采用伊立替康治疗结直肠癌患者72例。所有患者均经过病程或CT诊断证实为结直肠癌,体力状况评分(ECOG)[8]均在 0~1 分之间。其中男38例,女 34 例,年龄 24~75 岁,平均(56.85±7.54)岁,病程 2~12 个月,平均(6.55±4.24)个月。所有入组患者均无严重的肝、肾、肺、心脏以及造血功能障碍;消化道无梗阻;无急性感染。所有患者均签署知情同意书,本研究获得我院医学伦理委员会的批准。
1.2 方 法 所有入组患者的化疗方案均为FOLFIRI方案,化疗前血常规在正常范围内。FOLFIRI方案具体为:伊立替康180mg/m2溶于250mL生理盐水中静脉滴注90min,第1天;四氢叶酸钙静脉滴注200mg/m2,2h,第1天;5-氟尿嘧啶400mg/m2,持续静脉滴注 2400mg/m2,46h,每 2 周重复。
化疗前抽取患者空腹肘静脉血约2mL抗凝,采用购自北京方程生物科技有限公司的Qiagen全血基因组抽提试剂盒(货号:Qiagen51104),操作方法严格按照按照试剂盒说明书进行,抽提完成后将基因组DNA溶于50μL dd H2O中,并检测其浓度。采用PCR扩增UGT1A1基因的目的片段,设计PCR扩增引物序列如下:正向引物:5’-TCCCTGCTACCTTTGTGGAC-3’;反向引物:5’-ATGGCACAGGGTACGTCTTC-3’,均由金唯智合成。PCR 反应体系为:10×LA PCR Buffer Ⅱ(Mg2+Plus)5μL,dNTP mix 5μL,上下游引物各 1μL,TaKaRa LA Taq(5U/μL)0.5μL,模板DNA4μL,加水补足50μL。PCR反应条件为94℃,5min;(94℃,30s;64℃,30s;72℃,1min)×35 个循环。PCR后产物送生工生物工程(上海)有限公司测序。UGT1A1*6基因测序引物为5’-ACCTCTGGCAGG AG-3’;UGT1A1*28 测序引物为:5’-ATGGCACAGG GTACGTCTTC-3’。测序结果采用Vector NTI分析。
1.3 收集数据 在患者化疗期间查阅患者的病历资料,收集患者的医疗信息,包括病史、影像学检查结果、体格检查数据、常规实验室检测项目结果等,统计患者在化疗期间的不良反应,并评估化疗的疗效,记录肿瘤进展的时间。主要的研究终点为肿瘤进展时间,次要的研究终点为化疗方案反应率、不良反应时间和总生存时间。
1.4 评价药物的毒性 根据美国国立癌症研究所(NCI)制定的药物毒性评价和分级标准[9](NCI-CTC Classification 3.0)进行评价。
1.5 统计学方法 应用SPSS20.0软件,计数资料的表示方法为[n(%)],应用 χ2检验,生存分析采用 Ka-plan-Meier方法,采用SPSS20.0软件作不同基因型患者生存曲线,P<0.05表示差异有统计学意义。
2 结果
2.1 UGT1A1*6基因多态性分布情况 本组72例患者中UGT1A1*6基因为野生型G/G 52例,占比72.22%;UGT1A1*6基因为杂合突变型G/A 17例,占比23.61%;UGT1A1*6基因为纯合突变型A/A 3例,占比4.17%。UGT1A1*6基因野生型G/G、杂合突变型G/A以及纯合突变型A/A的测序结果见图1。
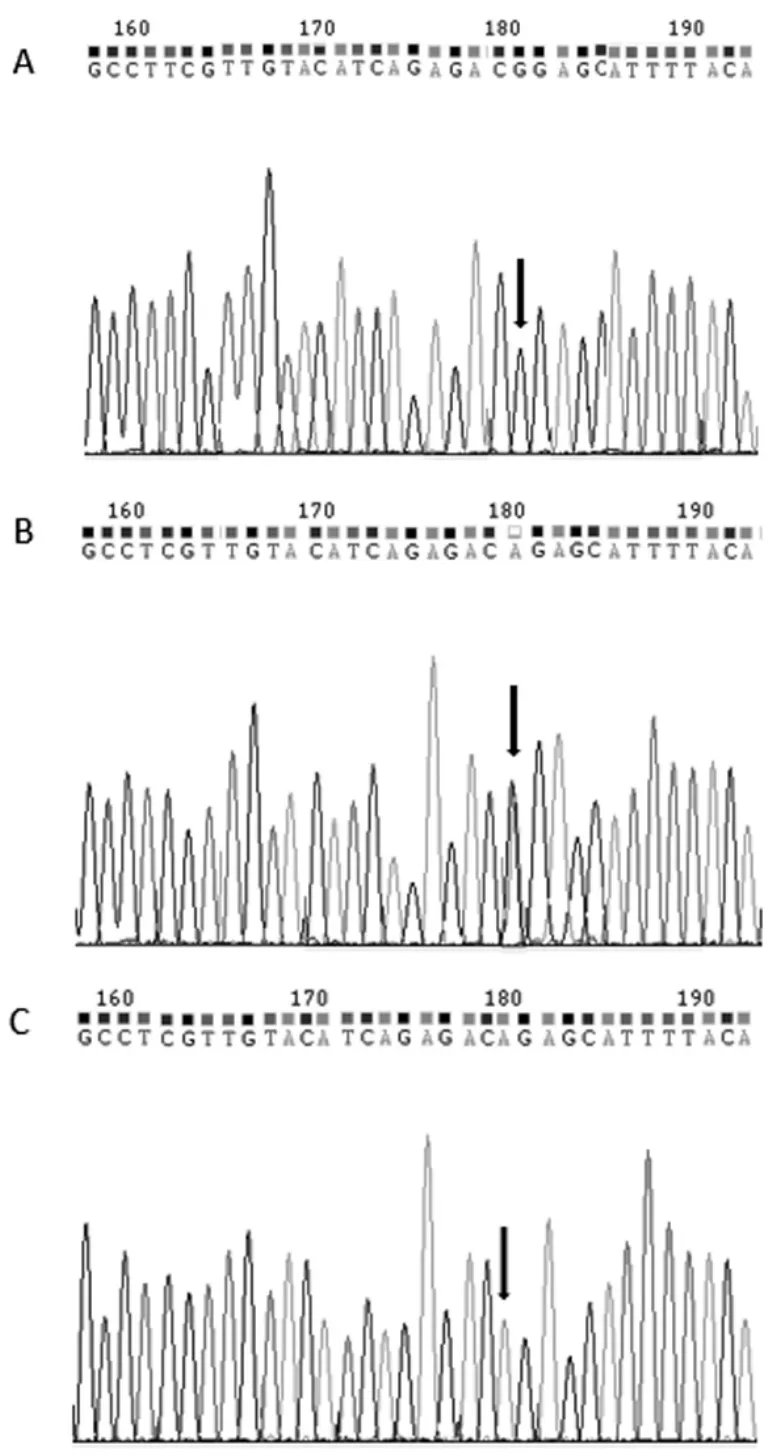
图1 UGT1A1*6基因型G/G、G/A、A/A的代表性测序图谱
2.2 UGT1A1*28基因多态性分布情况 本组72例患者中UGT1A1*28基因为野生型TA6/6 57例,占比79.17%;UGT1A1*28基因为杂合突变型TA6/7 14例,占比19.44%;UGT1A1*28基因为纯合突变型TA7/7 1例,占比1.39%。UGT1A1*28基因野生型TA6/6、杂合突变型TA6/7以及纯合突变型TA7/7的测序结果见图2。

图2 UGT1A1*28基因型TA6/6、TA6/7、TA7/7的代表性测序图谱
2.3 UGT1A1基因型与疗效的关系 72例接受伊立替康化疗的结直肠癌患者中各UGT1A1基因型疗效之间的差异无统计学意义(P>0.05),见表1。
2.4 UGT1A1基因型与药物不良反应情况 72例患者中,UGT1A1*6野生型(G/G)3~4级腹泻4例,占7.69%;3~4级白细胞减少8例,占15.38%;3~4级中性粒细胞减少15例,占28.84%;3~4级血红蛋白减少9例,占 17.31%;3~4级血小板减少 5例,占9.62%。UGT1A1*6突变型(G/A 和 A/A)3~4级腹泻 8例,占40.00%;3~4级白细胞减少5例,占25.00%;3~4级中性粒细胞减少12例,占60.00%;3~4级血红蛋白减少5例,占25.00%。UGT1A1*28野生型(TA6/6)3~4级腹泻 11例,占 19.30%;3~4级白细胞减少10例,占17.54%;3~4级中性粒细胞减少19例,占 33.33%;3~4级血红蛋白减少 10例,占17.54%;3~4级血小板减少1例,占1.75%。UGT1A1*28突变型(TA6/7和 TA7/7)3~4级腹泻 1例,占6.67%;3~4级白细胞减少 5例,占 33.33%;3~4级中性粒细胞减少10例,占66.67%;3~4级血红蛋白减少4例,占26.67%;3~4级血小板减少 5例,占33.33%。统计学分析显示,UGT1A1*6突变明显增加3级以上腹泻(χ2=11.71;P=0.00)和中性粒细胞减少的风险(χ2=8.66;P=0.01),而 UGT1A1*28 突变能够显著提高患者血小板减少的风险(χ2=16.26;P=0.00),见表2。

表1 UGT1A1基因型与疗效的关系[例(%)]

表2 UGT1A1基因型与药物不良反应情况[例(%)]
2.5 UGT1A1基因型与肿瘤进展时间的关系 UGT 1A1*6野生型和(G/G)和突变型(G/A+A/A)的平均肿瘤进展时间分别为10.9个月和9.9个月,差异无统计学意义(P>0.05)。UGT1A1*28野生型(TA6/6)和突变型(TA6/7+TA7/7)的平均肿瘤进展时间分别为8.7个月和7.9个月,差异无统计学意义(P>0.05),见图3。
3 讨论
临床数据统计[10]显示,伊立替康诱发的不良反应存在明显的个体差异,而伊立替康在体内代谢的主要酶是由UGT1A1基因表达的,因此推测UGT1A1基因与伊立替康的疗效和安全性具有相关性。

图3 UGT1A1*6和UGT1A1*28基因型肿瘤进展时间比较
本组72例结直肠癌患者,调查UGT1A1*6基因的多态性,结果显示,UGT1A1*6基因为野生型G/G 52例,占比72.22%;UGT1A1*6基因为杂合突变型G/A 17例,占比23.61%;UGT1A1*6基因为纯合突变型A/A 3例,占比4.17%。另外,UGT1A1*28基因为野生型TA6/6 57例,占比79.17%;UGT1A1*28基因为杂合突变型TA6/7 14例,占比19.44%;UGT1A1*28基因为纯合突变型TA7/7 1例,占比1.39%。UGT1A1基因多态性分布与相关报道一致,且UGT1A1*28基因突变率低于UGT1A1*6基因,说明从本研究样本来看,UGT1A1*6基因突变更为普遍,与相关研究结果[11]一致,另外,根据国外研究[12]数据,我国UGT1A1基因突变的概率较低,这也说明伊立替康在我国的用药安全相对较高。本研究结果显示,UGT1A1基因型与伊立替康的临床疗效和肿瘤进展时间并无显著相关性,说明UGT1A1基因多态性并不影响伊立替康药效的发挥,与相关研究结果一致[13],但据相关研究[14]显示,UGT1A1基因纯合突变患者伊立替康疗效较好,从其药物代谢途径可以看出,UGT1A1基因突变能够导致伊立替康在体内的活性代谢产物7-乙基-10-羟基喜树碱(SN-38)的浓度显著升高,相应毒效增加后其疗效也会随之增加。这与本研究结果不符,分析原因可能由于本研究样本量相对较少,导致统计误差较大,另外也有可能患者在采用伊立替康化疗前的健康水平不一致导致在化疗过程中的药物耐受程度不一样,随着伊立替康剂量的调整导致其误差相对较大。因此,UGT1A1基因多态性对伊立替康疗效的影响需要更大样本量进行研究以减少实验误差。另外,本研究结果显示,UGT1A1*6突变明显增加3级以上腹泻和中性粒细胞减少的风险,而UGT1A1*28突变能够显著提高患者血小板减少的风险,与相关研究结果[15]一致。因此,分析原因可能是因为伊立替康发挥活性的形式为SN-38,能够抑制拓补异构酶Ⅰ,抑制单链断裂后的修复过程,干扰DNA的复制和转录过程,而机体肝脏和小肠内存在的代谢酶UGT1A1能够将SN-38转变为灭活的产物SN-38G,而UGT1A1*6突变型的代谢酶活性降低了30%~70%[16~18],导致肠道内的SN-38转化速率明显下降而积累在肠道内产生细胞毒性,直接作用于肠道黏膜而产生损伤,继而产生腹泻。本组研究对象仅选择FOLFIRI一线化疗方案治疗的患者,以排除其他不同化疗方案给研究结果带来的影响。
综上所述,UGT1A1基因多态性与伊立替康治疗结直肠癌的疗效的关系还需要进一步扩大样本量进行研究,UGT1A1*6基因突变明显增加3级以上腹泻和中性粒细胞减少的风险,而UGT1A1*28基因突变能够显著提高患者3级以上血小板减少的风险,进行UGT1A1基因多态性检测能够为伊立替康毒性预测提供借鉴,更好的指导临床用药。
[1]Etiennegrimaldi MC,Boyer JC,Thomas F,et al.UGT1A1 genotype and irinotecan therapy:General review and implementation in routine practice[J].Fundamental&Clinical Pharmacology,2015,29(3):219.
[2]王清波,冯继锋,陆建伟,等.伊立替康联合雷替曲塞二线治疗晚期胃癌的疗效分析[J].临床肿瘤学杂志,2015,20(10):909-912.
[3]李秀芳,马媛,石朝利.顺铂联合伊立替康新辅助化疗治疗局部晚期宫颈癌的疗效观察[J].中国肿瘤临床与康复,2015,24(5):587-589.
[4]黄小红,周斌.降钙素原和C反应蛋白预测伊立替康化疗后腹泻患者肠原性细菌感染的研究[J].中国肿瘤临床,2015,42(7):382-385.
[5]肖晓光,夏曙,邹曼,等.UGT1 A1基因多态性与伊立替康治疗广泛期小细胞肺癌疗效和不良反应的关系[J].中国药师,2015,18(10):1661-1666.
[6]Chang TC,Shiah HS,Yang CH,et al.Phase I study of nano-liposomal irinotecan(PEP02)in advanced solid tumor patients[J].Cancer Chemotherapy and Pharmacology,2015,75(3):579-586.
[7]Cutsem EV,Lenz HJ,Kohne CH,et al.Fluorouracil,Leucovorin,and Irinotecan Plus Cetuximab Treatment and RAS Mutations in Colorectal Cancer[J].Journal of Clinical On -cology,2015,33(7):692.
[8]Fairclough DL,Cella DF.Eastern Cooperative Oncology Group(ECOG)[J].Journal of the National Cancer Institute Monographs,1996,278(20):73-75.
[9] Soo A,Taha S,Lally P,et al.Assessment of optic nerve development using post-mortem Magnetic Resonance Imaging(MRI) in fetuses and newborns[J].Prenatal Diagnosis,2015,35(12):1262-1264.
[10]汪皖青,缪丽燕.伊立替康不良反应与患者个体差异相关性的研究进展[J].药物不良反应杂志,2014,26(4):237-241.
[11]张勇,苏丹,郭晓川,等.UGT1A1*28和UGT1A1*6基因多态性与伊立替康不良反应的关系[J].解放军医学院学报,2014,35(5):489-492.
[12] Atasilp C,Chansriwong P,Sirachainan E,et al.Correlation of UGT1A1(*)28 and (*)6 polymorphisms with irinotecan-induced neutropenia in Thai colorectal cancer patients[J].Drug Metabolism&Pharmacokinetics,2015,31(1):90-94.
[13]郭晓玉,李智,曲秀娟,等.UGT1A1*6基因多态性与伊立替康毒性关系的Meta分析[M].中国医科大学学报,2015,44(7):596-601.
[14]张燕燕,何炜,扬子长,等.UTG1A1*28基因型指导伊立替康用药剂量选择的回顾性分析[J].中华肿瘤防治杂志,2015,22(9):709-712.
[15]张君孝,王晨亮,黄美近,等.UGT1A1基因多态性与转移性结直肠癌伊立替康化疗毒性及疗效的关系[J].中国病理生理杂志,2012,28(5):823-828.
[16] Kit OI,Vladimirova LY,Vodolazhskiy DI,et al.The role of assessment UGT1A1 gene polymorphism in the prediction of irinotecan-induced toxicity during chemotherapy for colorectal cancer[J].VoprosyOnkologii,2015,61(2):266-269.
[17] Lu CY,Huang CW,Wu I,et al.Clinical Implication of UGT1A1 Promoter Polymorphism for Irinotecan Dose Escalation in Metastatic Colorectal Cancer Patients Treated with Bevacizumab Combined with FOLFIRI in the Firstline Setting[J].Translational Oncology,2015,8(6):474-479.
[18] Butzke B,Oduncu FS,Severin F,et al.The cost-effectiveness of UGT1A1 genotyping before colorectal cancer treatment with irinotecan from the perspective of the German statutory health insurance[J].ActaOncologica,2016,55(3):1-11.

