阻断Wnt信号通路对人绒毛膜癌细胞株JEG-3迁移及侵袭能力的影响
绒毛膜癌是一种恶性度极高的滋养层细胞肿瘤,其转移、侵袭发生较早,是造成患者死亡的重要原因。上皮-间质转化(epithelial to mesenchymal transition, EMT)是指上皮细胞转化为具有间质细胞表型并具有迁移能力的过程[1]。近年来,越来越多的研究[2-3]表明,EMT在许多恶性肿瘤侵袭、转移过程中扮演着重要角色。经典的Wnt信号通路在EMT过程中发挥着重要作用[4-5],但关于其在绒毛膜癌EMT中的作用及机制研究较少。本研究采用Wnt 信号通路外源性阻滞剂DKK-1作用于人绒毛膜癌细胞株JEG-3细胞,探讨Wnt 信号通路在绒毛膜癌细胞EMT及迁移、侵袭过程的作用机制,以期为临床提供参考。
1 材料与方法
1.1材料与主要试剂人绒毛膜癌细胞株JEG-3细胞购自北京中科院动物研究所计划生育及生殖生物学国家重点实验室,RPMI-1640 培养基为美国 GIBCO 公司产品(批号为Z-SD-0018-02),DKK-1为美国Sigma公司产品(使用前用细胞培养基混合粉末配制成1 000 ng/mL,-20 ℃保存),兔抗人β-catenin抗体(批号:3170906259F)、Wnt抗体(批号:2760906248E)、Vimentin抗体(批号:170503178C)、E-cadherin抗体(批号:170712589E)均为英国Abcam公司产品,聚合酶链反应(polymerase chain reaction,PCR)扩增试剂盒(批号:303E058)为法国Transgene公司产品,北京博大泰克生物技术有限公司完成引物设计、合成,Transwell小室(批号:GR166578-6)、十二烷基硫酸钠聚丙烯酰胺凝胶电泳凝胶(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)(批号:GR157569-4)、聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF,批号:GR162467-6)购自美国costar公司,垂直电泳仪、转膜仪、D-140图像分析系统为大连竞迈仪器有限公司产品,常规试剂购自天津科密欧化学试剂公司。焦碳酸二乙酯(diethy pyrocarbonate,DEPC),1.0 mL的DEPC加入1000 mL双蒸水,过夜后备用。溴化乙锭(Ethidium bromide,EB)染液配制:将1.0 g的EB加入100 mL去离子水中,用磁力搅拌器搅拌至完全溶解,室温避光保存。
1.2方法
1.2.1细胞培养绒毛膜癌细胞复苏后,用含10%胎牛血清的RPMI-1640培养基培养至对数生长期,再用培养液将其制备成细胞浓度为5×104cells/mL的单细胞悬液。取细胞悬液4 mL接种于50 mL培养瓶中,37℃、5% CO2培养箱中常规培养,待其贴壁生长。采用2.5 g/L胰酶消化2~3 min后继续培养,再将其制备成5×104/ mL单细胞悬液,吸取悬液接种于6孔板内,密度为1×106/孔,每组设平行孔6 个,接种12 h后细胞贴壁生长[6]。
1.2.2蛋白印迹法(Western blot法)检测两组细胞中不同蛋白的表达细胞接种于6孔板内24 h后更换培养基,按完全随机法将细胞分为实验组与对照组,每组6孔,实验组给予100 ng/mL的DKK-120 μL(厂家:博士德生物工程有限公司,批号:753223A),对照组加入同体积细胞培养基。干预48 h 后取两组细胞分别经PBS漂洗、4 000 r/min离心后,加入细胞裂解液,置于冰上裂解30 min,提取总蛋白质。蛋白上样于10 %SDS-PAGE凝胶并电泳2.5 h,电压80 V;常规电转移至PVDF;将PVDF膜至于封闭液中封闭,摇床平衡1 h,每组分别加入5%牛血清白蛋白/磷酸盐吐温缓冲液(bovineserum albumin/phosphatebuffered salinewith tween 20,BSA/PBST)缓冲液(1∶1 000)稀释的兔抗人β-catenin 20 μL、Snail抗体20 μL、Vimentin抗体20 μL、E-cadherin抗体20 μL,4 ℃孵育过夜;PBST充分漂洗,加入用5%的脱脂牛奶/PBST缓冲液稀释1 000倍的二抗20 μL,室温孵育2h;取出PVDF膜用PBST充分漂洗3次;显影曝光采用ECL电发光试剂盒。用凝胶图像分析系统扫描各目标条带,记录其分子量及灰度值,待测蛋白的表达量=各目标条带与内参蛋白甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的灰度值之比[7]。
1.2.3RT-PCR法检测两组细胞中不同基因的表达所有引物均由北京赛百胜生物技术公司设计并合成,引物序列详见表1。
表1RT-PCR引物序列
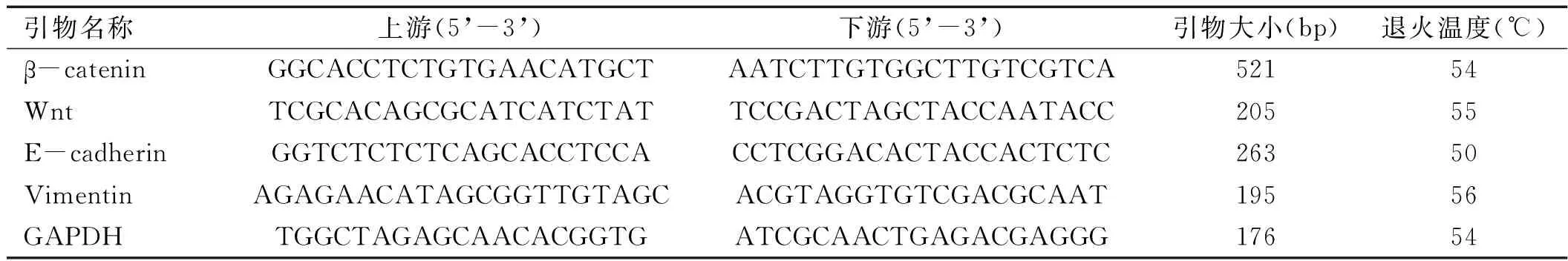
引物名称上游(5’-3’)下游(5’-3’)引物大小(bp)退火温度(℃)β-cateninGGCACCTCTGTGAACATGCTAATCTTGTGGCTTGTCGTCA52154WntTCGCACAGCGCATCATCTATTCCGACTAGCTACCAATACC20555E-cadherinGGTCTCTCTCAGCACCTCCACCTCGGACACTACCACTCTC26350VimentinAGAGAACATAGCGGTTGTAGCACGTAGGTGTCGACGCAAT19556GAPDHTGGCTAGAGCAACACGGTGATCGCAACTGAGACGAGGG17654
干预48 h 后取出两组细胞,将培养板中培养基吸出弃去,用PBS液充分洗涤3次。分别提取各组细胞总RNA,然后检测其完整性、浓度和纯度,如RNA合格则将 mRNA逆转录为模版DNA。逆转录反应体系:总 RNA 5~500 ng,T重复寡核苷酸(0.5 μg/μL)1 μL,酶系统反应混合物10 μL,即刻反应酶混合物1 μL,补DEPC水至20 μL。取2 μL用于PCR扩增反应,反应体系:模版 DNA 2 μL,正向引物1 μL,反向引物1 μL,1 mol/L Mg2+5 μL,三磷酸脱氧核糖核苷酸4 μL,DNA 聚合酶 0.5 μL,补双蒸水至50 μL。
反应条件:94 ℃预变性2 min,循环1次;95 ℃变性15 s,60℃退火30 s(引物不同退火温度也不同),72 ℃延伸1 min,共循环35次[8];72 ℃总延伸6 min。将扩增产物与缓冲液混合,然后加入2 %琼脂糖凝胶的加样孔中开始电泳,每孔5 μL,电压4~10 V,电泳后EB染色,在紫外线投射仪下观察电泳条带。数据记录及分析运用D-140图像分析系统处理,目的基因表达量=目的基因的DNA条带灰度值/内参GAPDH 的DNA条带灰度值。
1.2.4细胞划痕实验观察两组细胞的迁移能力接种细胞前用记号笔在6孔板底部画间隔均匀的网格线,以便观察细胞迁移情况。细胞接种于6孔板内24 h后更换培养基,实验组给予100 ng/mL的DKK-1 20 μL,对照组加入同体积细胞培养基。继续培养24 h 后用无菌枪头沿着6孔板正中画1条划痕,仔细刮去划痕线右侧所有的细胞,标记好划痕线。PBS 液充分漂洗以去除漂浮的肿瘤细胞,划痕后继续培养。分别在划痕后即刻、12、24及48小时时在400倍倒置相差显微镜下观察细胞迁移情况。计数方法:沿划痕线从上至下观察 5 个视野,计数每视野下越过划痕线的细胞数量,每培养孔迁移细胞数量=5个视野越过划痕线的细胞数量之和。
1.2.5Transwell小室检测两组细胞侵袭能力两组肿瘤细胞在0.2%牛血清白蛋白(bovine serum albumin,BSA)无血清培养基孵育(实验组加DKK-1,100 ng/mL 20 μL)过夜。Transwell小室置入 24 孔板,将基质胶用 0.2% BSA的无血清培养基按1∶5稀释后,吸取50 μL加入Transwell小室上室,37℃温箱过夜使稀释后的基质胶凝固。使用前再在小室上室加入无血清培养基100 μL,下室加入小鼠成纤维细胞NIH3T3的培养基600 μL[4],水化 30 min。制备细胞悬液,悬液浓主调整为5×105cells/mL,取200 μL悬液加入Transwell上室后放入细胞培养箱内进行细胞培养,培养条件为5%CO2、37℃,培养时间为24 h,然后将细胞铺片于滤膜上,苏木素染色,400倍显微镜观察。每张铺片随机选取5个视野,每张铺片侵袭细胞数=5个视野穿膜细胞数之和/5。
2 结果
2.1两组细胞各蛋白表达水平比较与对照组相比,实验组肿瘤细胞中β-catenin、Wnt、Vimentin蛋白平均表达水平明显降低,E-cadherin蛋白表达水平明显增高,差异有统计学意义(P<0.05)。详见图1、表2。
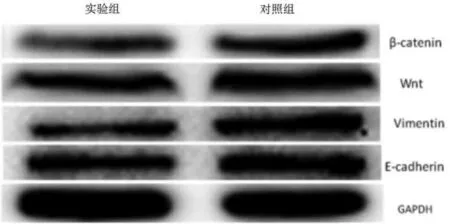
图1 Western Blot检测两组细胞中各蛋白表达水平
2.2两组细胞各基因表达情况比较与对照组相比,实验组肿瘤细胞中β-catenin、Wnt、Vimentin mRNA表达水平均降低,E-cadherin mRNA表达水平增高,差异有统计学意义(P<0.05)。详见表3。
表2 两组绒毛膜癌细胞中各蛋白的相对表达水平
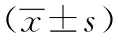
表3 两组绒毛膜癌细胞中各基因 mRNA的表达
2.3两组细胞迁移能力比较随着时间的延续,两组肿瘤细胞越过划痕线的数目逐渐增高;与对照组相比,实验组划痕后12、24及48小时越过划痕线的细胞数目均减少,组间比较差异有统计学意义(P<0.05)。详见图2、表4。
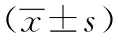
表4 两组绒毛膜癌在不同时间内迁移细胞数目比较
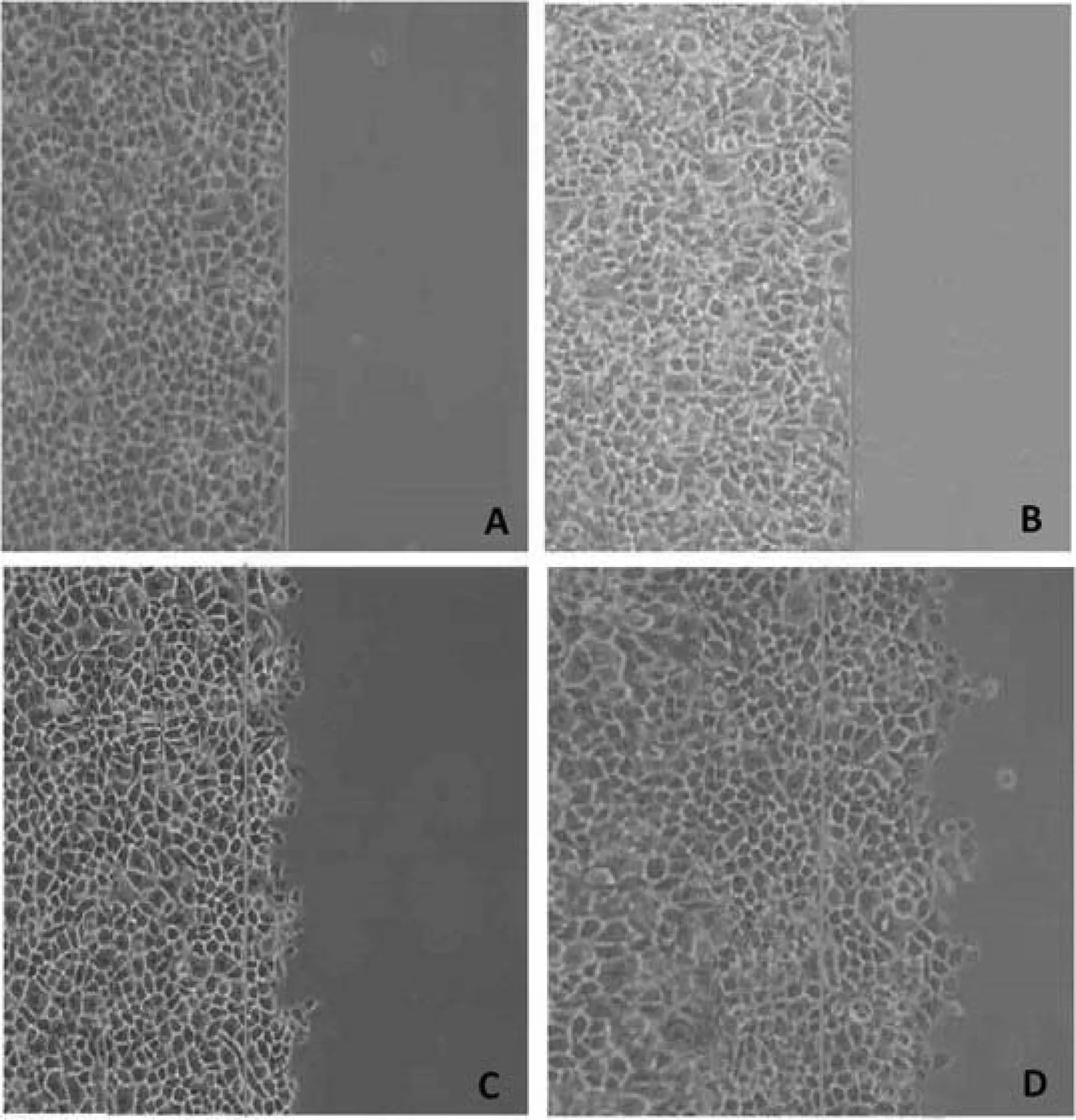
图2两组绒毛膜癌细胞迁移情况(×400)
注:A为实验组划痕后0即刻;B为对照组划痕后即刻;C为实验组划痕后48小时;D为对照组划痕后48小时
2.4两组细胞侵袭能力比较实验组穿膜细胞数为(33.71±2.21)个,低于对照组的(78.21±4.14)个,差异有统计学意义(P<0.05)。详见表5。
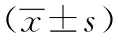
表5 两组绒毛膜癌细胞穿膜细胞数目比较
3 讨论
绒毛膜癌是滋养层细胞恶性肿瘤,生长迅速,转移早,虽然化疗可使近90%的绒毛膜癌患者病情得到控制,但部分患者仍会发生无控性的侵袭与转移,这也导致患者病情恶化或死亡。因而,如何抑制绒毛膜癌的侵袭和转移成为妇科临床重要研究课题。
EMT是上皮细胞通过骨架重塑,在形态学上向间质细胞表型转化。细胞发生EMT时,上皮性标志物E-cadherin表达量较成熟上皮表达减少,间质性标志物Vimentin 表达量较成熟上皮表达增多。王丽等[9]通过转染GV144-SCUBE2质粒使 HCT116细胞过表达SCUBE,采用RT-PCR、Western blot法检测EMT标志物E-cadherin、Vimentin等的表达发现,抑制Wnt /β-catenin信号通路后,可阻断结肠癌细胞EMT发生。李琳等[10]用熊果酸体外培养肾脏足细胞,采用免疫荧光、Western blot、RT-PCR法检测Wnt /β-catenin信号通路相关基因、EMT部分标志物的表达,发现熊果酸可通过调节Wnt /β-catenin信号通路抑制足细胞EMT。上述研究表明,EMT过程中经典Wnt信号通路(Wnt /β-catenin信号通路)起着重要作用。
本研究用Wnt 信号通路外源性阻滞剂DKK-1干扰人绒毛膜癌细胞株JEG-3细胞,采用Western blot、RT-PCR分别检测肿瘤细胞中Wnt、β-catenin、E-cadherin、Vimentin蛋白及mRNA的表达,结果显示,阻断Wnt 信号通路后,通路关键基因Wnt、β-catenin蛋白及mRNA表达水平显著低于对照组表达水平(P<0.05),同时间质细胞标志物Vimentin显著降低、上皮细胞标志物E-cadherin显著升高(P<0.05)。提爱军等[11]通过抑制人胆管癌细胞株QBC939Wnt信号通路后,发现上皮细胞标志物E-cadherin表达升高而间质性标志物Vimentin表达减少,陈海滔等[12]用姜黄素抑制结肠癌细胞Wnt/β-catenin信号通路的实验也得到与本研究类似的结果。这些都提示,经典Wnt信号通路在人绒毛膜癌细胞株JEG-3细胞的EMT过程中发挥着重要作用。
本研究在阻断Wnt 信号通路后,采用Transwell侵袭实验、划痕实验计数两种肿瘤细胞越线数目及穿膜数目,以比较两组肿瘤细胞侵袭、迁移能力改变。结果显示,实验组划痕后12、24及48 h越过划痕线的细胞数目均低于对照组(P<0.05);实验组肿瘤细胞穿膜细胞数低于对照组(P<0.05)。提示阻断Wnt 信号通路能降低人绒毛膜癌细胞株JEG-3细胞的迁移与侵袭能力。
结合Wnt 信号通路及EMT标志物检测结果,阻断Wnt 信号通路可能抑制了人绒毛膜癌细胞株JEG-3细胞EMT,进而导致肿瘤细胞迁移与侵袭能力降低。DKK-1作用于Wnt 信号通路后,β-catenin降解增加,在肿瘤细胞胞浆内逐渐堆积减少[13],并影响通路β-catenin、Snail等基因的转录,从而使得间质样表型Vimentin表达减弱、上皮样表型E-cadherin表达增强,导致肿瘤细胞出现上皮细胞样的极性,细胞间的桥粒、细胞间桥、紧密连接等增多,侵袭、迁移能力自然降低。
综上所述,阻断Wnt 信号通路后,人绒毛膜癌细胞株JEG-3细胞EMT受抑,进而出现迁移与侵袭能力降低,但EMT过程受抑的具体作用位点、肿瘤细胞迁移与侵袭能力降低的具体机制等问题还有待于进一步研究。
[1]ACLOQUE H,ADAMS M S,FISHWICK K,et al.Epithelial-mesenchymal transitions:the importance of changing cel state in development and disease[J].J Clin Invest,2009,119(6):1438-1449.
[2]PRASAD C P,RATH G,MATHUR S,et al.Expression analysis of E-cadherin,Slug and GSK3 beta in invasive ductal carcinoma of breast[J].BMC Cancer,2009,9(1):325.
[3]KAUFHOLD S, BONAVIDA B.Central role of Snail1 in the regulation of EMT and resistance in cancer:a target for therapeutic intervention[J].J Exp Clin Cancer Res,2014,33(1):62.
[4]HUANG D,DU X.Crosstalk between tumor cells and microenvironment via Wnt pathway in colorectal cancer dissemination[J].World J Gastroenterol,2008,14(12):1823-1827.
[5]包秀丽,刘婷婷,王艳艳,等.Wnt3a诱导人晶状体上皮细胞细胞外基质合成和胶原凝胶收缩的机制研究[J].中华实验眼科杂志,2016,34 (7):597-601.
[6]张延新,赵红军,宋文刚,等. TWEAK 反义寡核苷酸对人结肠癌细胞系SW480增殖及侵袭能力的影响[J].解剖学报,2014,45 (1):74-79.
[7]郝淑玲,王卫平,李建东,等.肾上腺髓质素和转化生长因子β1对肺成纤维细胞增殖及c-myc表达的影响[J].中华实用诊断与治疗杂志,2015,29(4):333-335.
[8]王科峰,柴林燕.替米沙坦对AGEs诱导人内皮细胞表达VCAM-1及MCP-1的作用和机制[J].安徽医学,2017,38(4):395-400.
[9]王丽,张宁,张龙江,等.SCUBE2 过表达通过 Wnt /β-catenin 抑制结直肠癌细胞上皮-间质转化[J].中国病理生理学杂志,2016,32 (12):2245-2250.
[10]李琳,徐莉,范秋灵,等.熊果酸通过调节Wnt/β-catenin通路抑制高糖诱导的足细胞上皮间充质转分化[J].中华肾脏病杂志,2016,32 (5):365-370.
[11]提爱军,向丹,李磊华,等.9-顺式视黄酸抑制人胆管癌细胞株QBC939Wnt信号通路和细胞迁移[J].中华实验外科杂志,2015,32 (11):2632-2635.
[12]陈海滔,徐超,姚庆华.姜黄素通过调节Wnt/β-catenin信号通路抑制结肠癌细胞上皮间质转化[J].肿瘤学杂志,2017,23(1):35-39.
[13]邹慧娟,郑航,李明君,等.Wnt信号通路在结肠癌中的表达及其作用机制[J].中国老年学杂志,2016,36 (14):3373-3374.

