治疗前NLR和PLR对上皮性卵巢癌患者预后的影响*
吴 焕,刘 洋,胡建国,周 敏(重庆医科大学附属第二医院妇产科,重庆400010)
卵巢癌是妇科最常见的恶性肿瘤之一,其发病率仅次于子宫颈癌与子宫内膜癌,但卵巢癌患者的死亡率位居首位。上皮性卵巢癌(EOC)约占卵巢恶性肿瘤的85%~90%[1],是妇科恶性肿瘤中死亡率最高的疾病,严重威胁妇女的健康。虽然近年来化疗药物不断改进,对卵巢癌的治疗也逐步规范,但晚期卵巢癌的存活率仍无明显改善,5年存活率仅为30%左右[2-3]。这主要与卵巢癌的细胞生物学行为有关,卵巢癌易复发和种植,对化疗易产生耐药性,而且其发生侵袭、转移和耐药的机制尚未明确。肿瘤可引起非特异性炎性反应,外周血中性粒细胞与淋巴细胞比值(NLR)及血小板与淋巴细胞比值(PLR)为非特异性炎症指标,目前已证实上述两种炎症指标的升高与一系列恶性肿瘤如胃癌、结直肠癌、乳腺癌的不良预后密切相关[4-5]。目前前于NLR和PLR对卵巢癌患者预后影响的研究很少,且数量有限的研究的研究对象多集中在国外患者,关于中国人群的研究尚缺乏相关报道。本研究旨在通过对112例EOC患者临床资料的回顾性分析,评价治疗前NLR和PLR与宫颈鳞癌患者预后的相关性。现报道如下。
1 资料与方法
1.1 一般资料 选取2006年1月至2011年12月在该院妇科初治并接受手术治疗的卵巢癌患者112例。所有病例均通过病理证实为EOC,且随访至少5年或至死亡,所有临床资料齐全。排除标准:(1)合并有免疫性疾病的患者;(2)治疗前合并有急性或慢性感染;(3)合并有血液系统疾病;(4)合并有严重的肝、肾疾病;(5)合并其他肿瘤患者。入组患者为112例,年龄31~69岁,平均49.3岁。根据2015年国际妇产科联盟(FIGO 2015)的临床分期标准,其中Ⅰ期患者6例(5.4%),Ⅱ期患者 15例(13.4%),Ⅲ期患者 75例(67.0%),Ⅳ期患者16例(14.3%)。术前行新辅助化疗30例(26.8%)。按组织学类型分类,浆液性囊腺癌63例(56.2%),黏液性囊腺癌32例(28.6%),子宫内膜样癌17例(15.2%),均经组织病理学证实。
1.2 方法
1.2.1 资料收集 收集纳入研究的患者的年龄和术前7 d内的血液检查结果、FIGO临床分期、组织学分型、手术完成情况、治疗方案、术后化疗及门诊随访病例等临床资料,并通过随访补充确认复发情况等必要的信息。NLR由外周血中性粒细胞和淋巴细胞的绝对值相除得出,PLR由血小板和淋巴细胞的绝对值相除得出。
1.2.2 随访 通过查阅住院病历资料、门诊随访资料及电话随访的方式获得预后资料。随访截止时间为2016年12月31日。本研究将患者从第1次入院确诊时间至随访截止时间或死亡时间定义为总生存期(OS);患者从手术时间至确诊局部复发或远处转移的时间定义为无病生存期(DFS)。通过绘制受试者工作特征曲线(ROC曲线)确定NLR和PLR与OS及DFS的相关性,使用敏感度+特异度-1所得最大值时对应的数值作为截断值。
1.3 统计学处理 应用SPSS20.0统计软件进行数据分析。采用Kaplan-Meier检验绘制生存曲线,生存率的比较采用Log-rank检验。卵巢癌患者生存预后的影响因素分析采用Cox风险回归模型。以P<0.05为差异有统计学意义。
2 结 果
2.1 NLR及PLR截断值的选取 根据入组患者NLR、PLR与 OS、DFS的关系,分别绘制 ROC曲线(图1A~D)。反映 NLR与 OS关系的 ROC曲线下面积(AUC)=0.631(P=0.025),说明NLR值与EOC患者的总生存期具有相关性。NLR与FPS关系的ROC曲线AUC=0.656(P=0.026),说明NLR与EOC患者的无病生存期具有相关性。反映PLR与OS关系的ROC曲线AUC=0.763(P=0.000),说明PLR与EOC患者的总生存期具有相关性。PLR与FPS关系的ROC曲线AUC=0.652(P=0.030),说明PLR与EOC患者的无病生存期具有相关性。依据统计学方法评估NLR和PLR对患者无复发生存率的情况,计算得出NLR和PLR的截断值分别为2.85和148.8,NLR和FLR ROC曲线最佳的灵敏度、特异度分别为63.7%、61.9%和65.9%、61.9%。
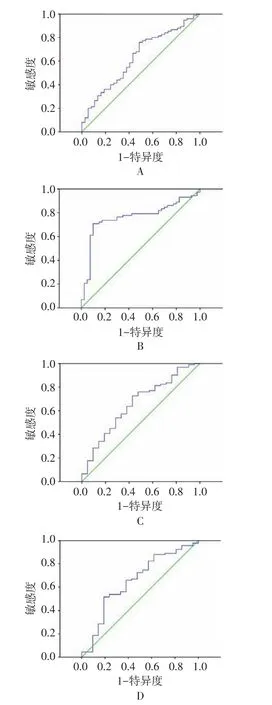
图1 治疗前NLR、PLR与OS、DFS关系的ROC曲线
2.2 NLR、PLR与EOC患者预后的相关性 根据NLR的截断值2.85,将患者分为两组,NLR<2.85者为低NLR 组(n=46),NRL≥2.85者为高 NLR 组(n=66)。低NLR组患者5年生存率为45.5%,高NLR组为25.8%,低NLR组患者5年生存率明显高于高NLR组,差异有统计学意义(P=0.005),见图2A。根据PLR的截断值148.8,PLR<148.8者为低 PLR 组(n=44),PLR≥148.8者为高 PLR组(n=68)。低 PLR组患者 5年生存率为43.2%,高PLR组为27.9%,低PLR组患者5年生存率明显高于高PLR组,差异有统计学意义(P=0.015),见图2B。
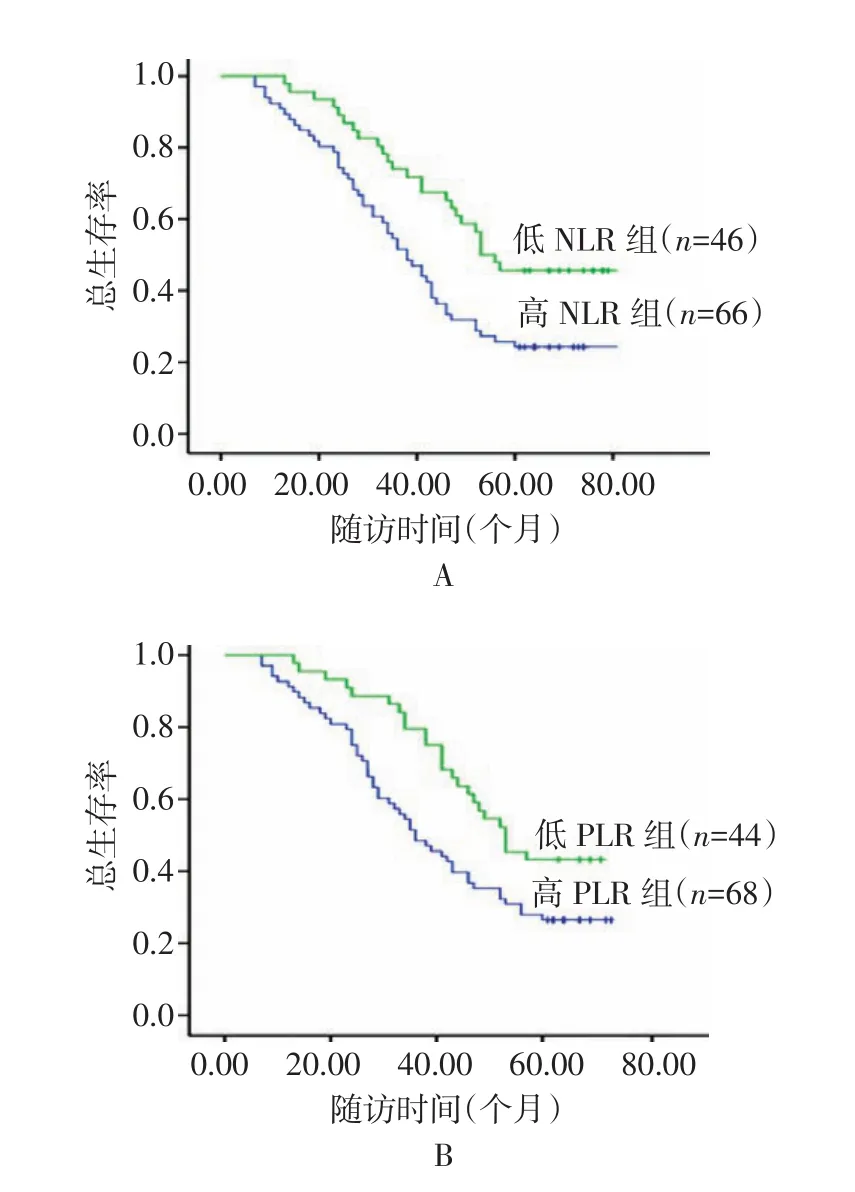
图2 NLR、PLR与EOC患者预后的相关性
2.3 NLR及PLR值与临床病理因素的相关性 通过单因素分析,高NLR组与低NLR组在EOC的FIGO分期及有无淋巴结转移方面比较,差异均有统计学意义(P=0.017、0.025)。见表 1。高 PLR 组与低 PLR 组在EOC有无淋巴结转移方面比较,差异有统计学意义(P=0.032);在患者年龄、FIGO分期、术前是否化疗、卵巢癌的病理学分型方面比较,差异均无统计学意义(P>0.05)。见表 2。
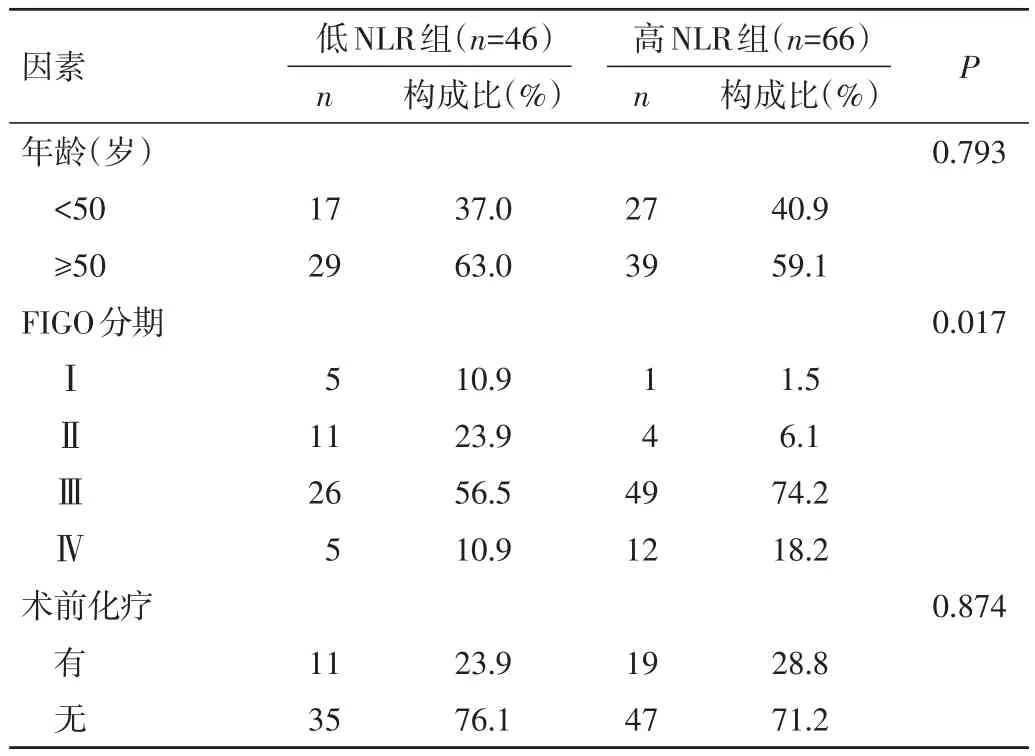
表1 低NLR组与高NLR组患者临床特征比较
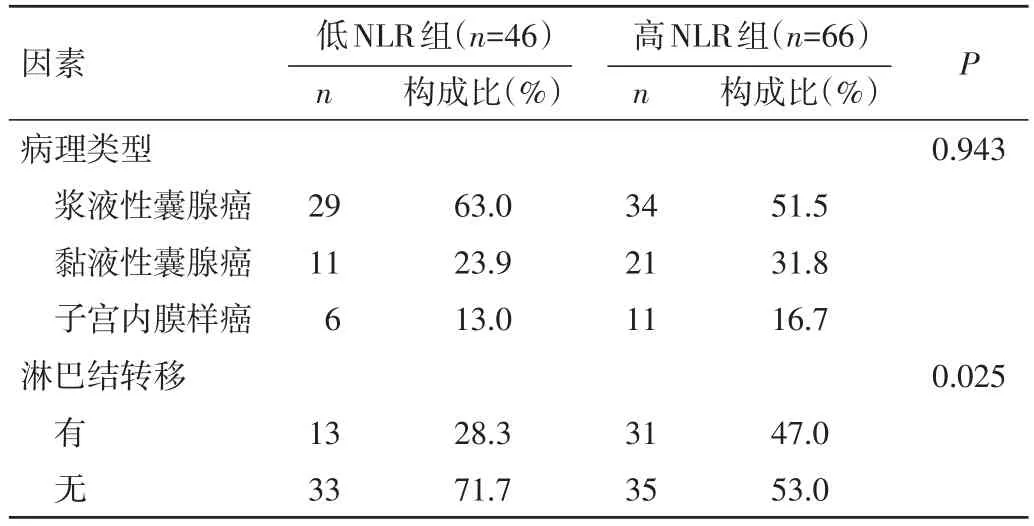
续表1 低NLR组与高NLR组患者临床特征比较

表2 低PLR组与高PLR组患者临床特征比较
3 讨 论
肿瘤的预后不仅与其恶性程度相关,也与机体自身的免疫炎症反应程度相关。流行病学研究显示,免疫性疾病及良恶性肿瘤均与机体长期的慢性炎症有关[6]。炎症细胞可以抑制或促进肿瘤的生长。此外,炎性反应在各种肿瘤的发生、发展中起着主要作用[7-9]。目前,已有较多研究证实,NLR和PLR与胃癌、小细胞肺癌、结直肠癌患者的预后呈负相关,术前NLR与PLR升高可能提示肿瘤患者的预后不良[10-12],而关于NLR及PLR在评估EOC患者预后方面的研究相对较少。
本研究旨在验证NLR及PLR能否作为有效的参考指标预测EOC患者的预后。本研究结果显示,NLR≥2.85的EOC患者5年生存率相对NLR<2.85的患者低,差异有统计学意义(P<0.05),高NLR水平提示较重的中性粒细胞炎症反应和(或)较低的淋巴细胞水平。中性粒细胞作为一种炎症细胞,可以释放血管内皮生成因子(VEGF)、趋化因子及蛋白酶刺激血管生成,这些炎症细胞因子可以促进肿瘤微环境形成,从而促进肿瘤的发生、发展[13-14]。同时,淋巴细胞可介导机体免疫反应,参与针对肿瘤的免疫监视及免疫抑制作用[15]。NLR可能通过干预肿瘤微环境及免疫系统影响EOC患者生存情况,其具体机制有待进一步研究阐明。
本研究结果提示,PLR≥148.8的EOC患者5年生存率相对PLR<148.8的患者低,差异有统计学意义(P<0.05)。高PLR提示外周血小板计数较高,血小板是机体凝血功能的主要参与者,其通过分泌多种细胞因子,直接或间接的参与机体的炎性反应,可间接反映机体炎性反应程度。血小板可通过释放血小板衍化生长因子(PDGF)、转化生长因子(TGF-β)、VEGF 及血小板反应蛋白等,这些因子可对卵巢上皮细胞起到促进细胞分裂素及黏着糖蛋白生成的作用,通过刺激卵巢肿瘤细胞增殖及粘连于其他细胞,参与肿瘤的生成与转移[16]。目前已有研究证实,术前患有血小板增多症的EOC患者,通过手术及使用紫杉醇联合铂类(TP)方案化疗后,其预后较差[17]。因此,PLR可能是通过血小板对于肿瘤的促生长能力来影响EOC患者生存情况。
综上所述,准确有效的肿瘤标志物对于肿瘤的诊断、疗效评价及预后预测具有显著意义。本研究证实,NLR及PLR对于EOC患者的预后具有一定的预测价值,但其敏感度及特异度易受手术、化疗等治疗因素的影响,故其对于初治EOC患者的预后评估价值更大。NLR及PLR获取便利,具有较高的敏感度与特异度,可作为临床预测EOC患者预后的参考指标。
[1]UTSUMI M,AOKI H,KUNITOMO T,et al.Preoperative risk factors for conversion of laparoscopic cholecystectomy to open cholecystectomy and the usefulness of the 2013 Tokyo guidelines[J].Acta Med Okayama,2017,71(5):419-425.
[2]CHÁVEZ KV,MÁRQUEZ-GONZÁLEZ H,AGUIRRE I,et al.Prognostic risk factors for conversion in laparoscopic cholecystectomy[J].Updates Surg,2017-10-04[2017-11-26].https://www.ncbi.nlm.nih.gov/pubmed/?term=Karla+V%2C+Ch%C3%A1vez%3BHoracio%2C+M%C3%A1rquez-Gonz%C3%A1lez%3BItz%C3%A9%2C+Aguirre.
[3]HU AS,MENON R,GUNNARSSON R,et al.Risk factors for conversion of laparoscopic cholecystectomy to open surgery:a systematic literature review of 30 studies[J].Am J Surg,2017,214(5):920-930.
[4]SMITH RA,BOSONNET L,RARATY M,et al.Preoperative plateletlymphocyte ratio is an Independent significant prognostic marker in resected pancreatic ductal adenocarcinoma[J].Am J Surg,2009,197(4):466-472.
[5]KWON HC,KIM SH,OH SY,et al.Clinical significance of preoperative neutrophil-lymphocyte versus platelet-lymphocyte ratio in patients with operable colorectal cancer[J].Biomarkers,2012,17(3):216-222.
[6]CHO H,HUR HW,KIM SW,et al.Pre-treatment neutrophil to lymphocyte ratio is elevated in epithelial ovarian cancer and predicts survival after treatment[J].Cancer Immunol Immunother,2009,58(1):15-23.
[7]HUSSEIN MR,AHMED RA.Analysis of the mononuclear inflammatory cell infiltrate in the non-tumorigenic,pre-tumorigenic and tumorigenic keratinocytic hyperproliferative lesions of the skin[J].Cancer Biol Ther,2005,4(8):819-821.
[8]ALTINOZ MA,KORKMAZ R.NF-kappaB,macrophage migration inhibitory factor and cyclooxygenase-inhibitions as likely mechanisms behind the acetaminophen-and NSAID-prevention of the ovarian cancer[J].Neoplasma,2004,51(4):239-247.
[9]JAISWAL M,LARUSSO NF,GORES GJ.Nitric oxide in gastrointestinal epithelial cell carcinogenesis:linking inflammation to oncogenesis[J].Am J Physiol Gastrointest Liver Physiol,2001,281(3):G626-634.
[10]PEDERSEN LM,MILMAN N.Prognostic significance of thrombocytosis in patients with primary lung cancer[J].Eur Respir J,1996,9(9):1826-1830.
[11]MONREAL M,FERNANDEZ-LLAMAZARES J,PIÑOL M,et al.Platelet count and survival in patients with colorectal cancer:a preliminary study[J].Thromb Haemost,1998,79(5):916-918.
[12]LOPES A,DARAS V,CROSS PA,et al.Thrombocytosis as a prognostic factor in women with cervical cancer[J].Cancer,1994,74(1):90-92.
[13]SHAMAMIAN P,SCHWARTZ JD,POCOCK BJ,et al.Activation of progelatinase A(MMP-2)by neutrophil elastase,cathepsin G,and proteinase-3:A role for inflammatory cells in tumor invasion and angiogenesis[J].J Cell Physiol,2001,189(2):197-206.
[14]KUSUMANTO YH,DAM WA,HOSPERS GA,et al.Platelets and granulocytes,in particular the neutrophils,form important compartments for circulating vascular endothelial growth factor[J].Angiogenesis,2003,6(4):283-287.
[15]OHTANI H.Focus on TILs:prognostic significance of tumor infiltrating lymphocytes in human colorectal cancer[J].Cancer Immun,2007,7:4.
[16]HELLSTRÖM I,RAYCRAFT J,HAYDEN-LEDBETTER M,et al.The HE4(WFDC2)protein is a biomarker for ovarian carcinoma[J].Cancer Res,2003,63(13):3695-3700.
[17]LEE M,KIM SW,NAM EJ,et al.The impact of pretreatment thrombocytosis and persistent thrombocytosis after adjuvant chemotherapy in patients with advanced epithelial ovarian cancer[J].Gynecol Oncol,2011,122(2):238-241.

