ST段抬高型心肌梗死后持续性T波倒置对心肌损伤预测价值的研究
吴多益 许和平 孙娟 李全妮
虽然ST段抬高型心肌梗死(ST segment elevation myocardial Infarction,STEMI)患者的 ECG改变的临床意义已为大家接受,但是这些电现象的基本原理仍然是有争议的[1]。STEMI后一个有趣的心电现象就是持续性T波倒置(persistence of T-wave inversion,PTI),直接经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗 STEMI时就发现:PTI是STEMI后较为常见的心电现象。Salah等研究[2]发现:STEMI后4个月时出现的PTI可作为预后较差的预测因子。然而PTI和不良事件风险增加之间相关联的病理生理机制仍然没有得到很好的阐明。超声心动图研究数据[3]显示:心肌梗死后PTI与左心室(LV)功能障碍明显相关。PTI不仅与心肌广泛坏死有关,而且与未行血运重建的心肌损伤有关[4]。然而,这些研究的一个主要缺陷是缺乏科学的方法来精确评估心肌损伤的程度。心脏磁共振成像(cardiac magnetic resonance imaging,CMRI)可一次性完成心脏结构与功能(包括冠状动脉显影、血流灌注、室壁运动、存活心肌定量等)评估,且无电离辐射,被称为心脏“一站式”无创检查,越来越广泛地应用于临床[5]。3T延迟增强磁共振成像(DE-MRI)凭借无辐射、良好的空间分辨率和任意层面成像,并可同时综合利用MRI心脏电影、心肌灌注等多种技术全面检测心肌活性等优点,在心脏结构和功能、心肌活性的评价方面具有明显优势。因此,我们利用能测定急性和慢性梗死面积(IS)的3.0T心脏磁共振成像技术,探讨STEMI后4个月时出现的持续性T波倒置与心肌损伤程度的关系。
资料与方法
1.研究对象 入组我院2016年1月至2018年1月,心血管内科、急诊内科160例STEMI患者,统一参照下列纳入标准:STEMI的诊断:有缺血症状和两个相邻肢体导联中ST段抬高至少0.1mV或在相邻两胸前导联至少抬高0.2 mV。血运重建术在症状出现后24h内,行CMR检测时肾小球滤过率估计值>30mL·min-1· 1.73m-2、Killip分级 <3级。排除标准:年龄<18岁,既往有心肌梗死或PCI治疗史,随访的4个月内有心肌再梗死,右或左束支传导阻滞的心电图表现,CMR检查禁忌(起搏器、幽闭恐怖症、眶内异物、脑动脉瘤夹,已知的或可疑的造影剂过敏)。最终纳入142例。
2.心电图分析 标准的12导联体表心电图(电压:10mm/mV;速度:25mm/s)。 心肌梗死后连续心电图记录4个月,用来诊断PTI和病理性Q波。PTI定义为:随访心电图在梗死相关的至少1个导联中出现的负向T波,如果有1个以上的梗死相关导联显示PTI,那么以T波幅度最大的作为分析导联。采用下列标准确定病理性Q波持续存在:Q波宽度≥0.04s和/或Q波振幅大于同导联R波的1/4。如果多导联出现病理性Q波,也是以波幅最深的为分析导联。超敏肌钙蛋白T(hs-cTnT)、hs-CRP和N末端B型利钠肽(NT-proBNP)分别在入院时,入院后每天1次到PCI术后4d各检测一次。所有研究对象在住院期间和随访期间均进行详细的病史记录和体格检查,并在加入研究之前签署书面知情同意书。
3.心脏磁共振成像检查 CMR扫描统一在我院3.0TMRI(Siemens,Erlangen,Germany)上进行,在梗死后第一个星期以及4个月各扫描一次。乳头肌被排除在心肌群之外,但纳入左心室容积。左心室重构定义:从基线到随访扫描的左心室舒张末期容积增加≥20%。以0.1mmol/kg的速度推注造影剂后15min,再应用具有连续短轴切片的心电触发相敏反转恢复(ECG-triggered phase-sensitive inversion recovery,PSIR)序列获得晚期钆增强(late gadolinium enhancement,LGE)图像。“超增强”定义为:相对左心室而言远端心肌节段的心肌信号阈值强度+5SD以上。心肌梗死的范围以左心室心肌质量百分比表示。心肌梗死面积>中值定义为大范围慢性梗死面积。微血管阻塞(microvascular obstruction,MVO)被定义为梗死范围内持续“低增强区”。所有图像均由影像专业副主任医师进行CMR双盲的临床数据分析。
4.统计学方法 采用SPSS22.0(美国IBM公司)、MedCalc 15.8(奥斯坦德,比利时)及R33.0(奥地利R基金会)进行统计学分析。柯尔莫可洛夫-斯米洛夫检验(kolmogorov-Smirnov)检验检测数据是否正态分布,正态分布计量资料以均数±标准差表示,非正态分布资料采用中位数(M)及四分位数间距(P25,P75)表示。两组间连续变量的差异采用曼-惠特尼(Mann-Whitney)U检验或t检验。分类变量以相应百分比表示,差异比较采用卡方检验。从基线到随访的变量变化采用Wilcoxon秩检验。连续变量的相关性分析采用皮尔森(Pearson)或Spearman分析。应用受试者工作特征(ROC)曲线分析法评估曲线下面积(AUC)来预测慢性心肌梗死的面积大小。AUC值采用非参数方法的比较。使用下面的公式确定大范围慢性梗死面积的最佳截点值(
此外,我们结合病理Q波与PTI创建了一个心电风险评分系统预测慢性心肌梗死面积,(Q/T波评分(QwTw)),采用以下积分方式:有PTI(1分)/病理性Q波(1分);PTI在ROC曲线决定的最佳临界值之上(2分)/Q波振幅超过最佳临界值(2分)。QwTw计分(0到4分),分为以下几个风险等级:低危(0 ~1分),中危(2~3分)和高危(4分)。QwTw计分来评估PTI预测大范围慢性梗死面积的价值。根据QwTw计分等级来分析风险类别的临界值。为了便于比较变量之间的比值比,根据ROC分析确定的最佳截断值对连续变量进行再次分化。对于所有的统计分析,以P<0.05为差异有统计学意义。
结 果
1.研究对象和心脏磁共振检查 连续入组了142例STEMI患者,接受急诊PCI治疗的平均时间为发病后209(145,419)min。平均年龄为(57±12)岁,详细基线及临床特征见表1。梗死后3(2,4)d以及124(120,139)d各进行一次CMR扫描,CMR参数总结在表1中。
2.STEMI后持续性T波倒置 4个月随访中检测到 PTI有 103例(72.5%)。右冠状动脉(RCA)作为罪犯血管的患者中,40例(65%)出现PTI,心电图中T波倒置最深的是III导联(最差导联)。在左前降支动脉(LAD)为罪犯血管的梗死患者中,53例(87%)出现PTI,其中最差导联分布为V3(n=24),V4(n=10),V2(n=7),aVL(n=12)。左回旋动脉(LCX)作为罪犯血管的有10例(53%)检出PTI患者,其中aVL(n=5)和III(n=5)为最差导联。
有无PTI患者特征如表1所示。PTI与病理性Q波的显著升高相关(P<0.001),同时PTI患者的Q波幅度也显着升高(P<0.001)。PTI与病理性Q波发生率显著相关(r=0.46,P<0.001)。PTI的患者的 hs-cTnT(P<0.001),hs-CRP(P<0.001)和NT-proBNP(P=0.001)的峰值水平较高。罪犯血管病变位置(P=0.004)以及介入前TIMI血流(P<0.001)均与PTI显著相关。这5个基线参数的多变量分析显示 hs-cTnT(OR=7.52,95%CI:2.89 ~19.52,P<0.001)和 hs-CRP(OR=3.90,95%CI:1.48~10.27,P=0.006)均可作为PTI的预测因子。
有PTI患者和无PTI患者的CMR参数差异见表1。除基线左心室舒张末期容积外,所有CMR参数均显示与PTI显著相关(P均≤0.02)。在包括所有基线CMR参数的多变量分析中,只有梗死面积(OR=8.33,95%CI:2.97 ~23.38,P<0.001)和梗死面积超过中值的透壁心肌梗死(OR=1.02,95%CI:1 ~1.04,P=0.047)能独立预测 PTI。
3.持续倒置T波对梗死面积估计的价值 PTI幅度与梗死面积之间的关系如图1所示,PTI幅度的增加与慢性梗死面积的扩展相关(P<0.001):无PTI=3%(IQR 1% ~7%),0~0.1mV PTI=9%(IQR 4% ~16%),0.1~0.2mV的 PTI=14%(IQR 10% ~17%),>0.2mV PTI=17%(IQR 14%~24%)。
显示具有不同PTI幅度的3例下壁梗死患者的相应CMR图像及对应的心电图(图2A~C)。能够预测梗死面积的PTI幅度的AUC为0.84(95%CI:0.77~0.90),最佳截点值为0.11mV。病理性Q波幅度的AUC为0.72(95%CI:0.63~0.80),最佳截点值为0.33 mV与PTI幅度的AUC相比显著降低(P=0.009;图3)。慢性梗死面积>11%的多变量模型如表2所示。只有PTI幅度(OR=9.02,95%CI:3.49~23.35,P<0.001)和 hs-cTnT峰值(OR=9.24,95%CI:3.56 ~24.01,P<0.001)作为大范围慢性梗死面积的预测因子。用于预测大范围慢性梗塞面积大小的hs-cTnT峰值的AUC为0.80(95%CI:0.72~0.88)。与单独 hs-cTnT峰值相比,hscTnT峰值与 PTI的组合有更大的 AUC(AUC=0.90,95%CI:0.85 ~0.95; P=0.004)。
4.Q波/T波评分与慢性梗死面积 Q波/T波评分的增加与慢性梗死面积增加显著相关(P<0.001):0 分 =2%(IQR 0.5% ~7%),1 分 =4%(IQR 1% ~9%),2分 =10%(IQR 5% ~14%),3分=13%(IQR 7% ~18%),4分 =16%(IQR 12%~22%)。因此,较高的评分与大面积慢性梗死(>11%)相关(P<0.001):0分 =8%(2/26),1分 =15%(2/13),2 分 =43%(9/21),3 分 =59%(23/39),4分=81%(35/43)。对于分数分级,大范围慢性梗塞的发生率如下:低=10%,中度=53%,高=81%。在多变量Logistic回归分析中,校正hs-cTnT峰值,hs-CRP和NT-proBNP,罪犯血管为LAD,介入前TIMI血流和 Q波幅度(OR=2.14,95%CI:1.44~3.19,P<0.001)后Q波/T波评分与大型慢性梗死面积之间的关系依然显著,但在校正PTI后明显降低(P=0.10)。
表1 入组患者临床特点[¯±s,n(%),M(QR)]

表1 入组患者临床特点[¯±s,n(%),M(QR)]
变量 总体(n=142) PTI组(n=103) 无PTI组(n=39) P值年龄/岁57±12 58±12 56±10 0.49女性 19(13.4) 11(10.7) 8(20.5) 0.12 BMI/(kg/m2) 26.2(24.5,28.3) 26.3(24.7,28.4) 25.9(24.0,27.2) 0.10高血压 87(61.3) 64(62.1) 23(59.0) 0.63收缩压/(mmHg) 126(114,144) 126(111,143) 126(120,153) 0.41舒张压/(mmHg) 78(70,90) 80(70,90) 75(70,89) 0.74 AMI家族史 38(26.8) 26(25.4) 12(30.8) 0.57吸烟 77(54.2) 54(52.4) 23(59.0) 0.56高脂血症 83(58.5) 55(53.4) 28(71.8) 0.06糖尿病 15(10.6) 9(8.7) 6(15.4) 0.27持续病理性QW 105(73.9) 92(89.3) 13(33.3) <0.001 Q波幅度/mV 0.30(0.00,0.70) 0.45(0.21,0.80) 0.00(0.00,0.20) <0.001罪犯血管 0.004 RCA 62(43.7) 40(38.8) 22(56.4)LAD 61(43.0) 53(51.5) 8(20.5)LCX 19(13.3) 10(9.7) 9(23.1)病变血管0.93 1 83(58.5) 59(57.3) 24(61.5)2 43(30.3) 32(31.1) 11(28.2)3 16(11.3) 12(11.7) 4(10.3)TIMI血流(PCI前)<0.001 0 87(61.3) 72(69.9) 15(38.5)1 22(15.5) 16(15.5) 6(15.4)2 30(21.1) 12(11.7) 18(46.2)3 3(2.1) 3(2.9) 0(0)TIMI血流(PCI后)0.24 0 3(2.1) 3(2.9) 0(0)1 3(2.1) 1(1.0) 2(5.1)2 12(8.5) 10(9.7) 2(5.1)3 124(87.3) 89(86.4) 35(89.7)从症状发作到 PPCI的时间/min 209(145,419) 213(157,453) 202(142,351) 0.26 hs-CTnT峰值/(ng/L) 4411(1659,7671) 5464(2771,8929) 1718(506,3795) <0.001 hs-CRP峰值/(mg/L) 19.9(9.5,48.0) 27.6(13.7,62.7) 10.0(3.7,16.5) <0.001 Nt-proBNP峰值/(ng/L) 744(227,1931) 922(483,2162) 271(115,939) 0.001基础药物治疗抗血小板 142(100.0) 103(100.0) 39(100.0) -ACEI 125(88.0) 89(86.4) 36(92.3) 0.33 β-B 124(87.3) 91(88.3) 33(84.6) 0.55他汀 140(98.6) 103(100.0) 38(97.4) 0.10随访其间治疗抗血小板 142(100.0) 103(100.0) 39(100.0) -ACEI 123(86.6) 88(85.4) 35(89.7) 0.50 β-B 119(83.8) 88(85.4) 31(79.5) 0.39他汀 138(97.2) 100(97.1) 38(97.4) 0.91心脏磁共振参数LVEDV/mL 145(122,166) 147(126,167) 139(115,161) 0.11 LVESV/mL 66(48,82) 71(55,86) 53(40,64) <0.001 LVEF/mL 55(48,61) 53(45,59) 60(55,67) <0.001梗死面积 LVMM/% 16(8,25) 21(11,29) 6(1,13) <0.001梗死透壁度 <0.001≤25% 10(7.0) 3(2.9) 7(17.9)50% 6(4.2) 1(0.9) 5(12.8)75% 17(12.0) 9(8.7) 8(20.5)100% 109(76.8) 90(87.4) 19(48.7)MV0 74(52.1) 61(59.2) 13(33.3)0.02

(续表1)

图2 下壁STEMI的3个不同患者在梗死4个月后的CMR图像(箭头:增强区域)及其对应的心电图(PTI的“最差导联”为Ⅲ导联)。A:无PTI的患者和相应的梗死面积为1%;B:PTI为0.1mV,相应梗死面积为6%;C:PTI为0.4 mV的患者和相应的梗死面积为17%

图1 PTI振幅与慢性梗塞面积间关系
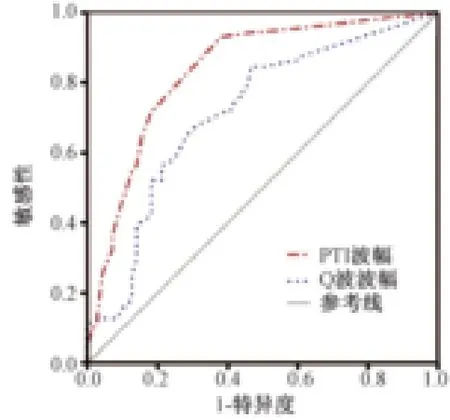
图3 预测大范围慢性梗塞面积ROC曲线
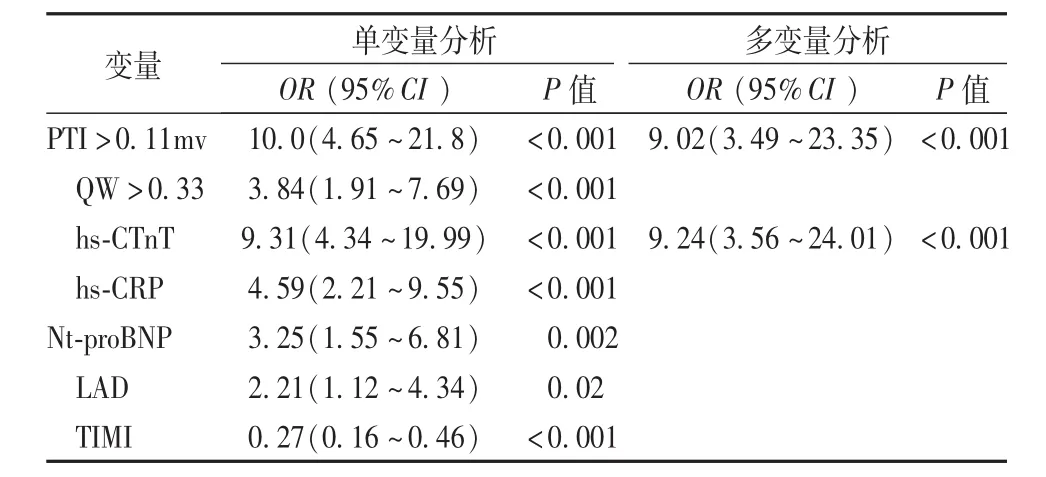
表2 慢性缺血>11%影响因素的Logistic回归分析结果
讨 论
我们采用心脏3.0T磁共振成像技术探讨行急诊PCI治疗的STEMI患者心电图出PTI与心肌损伤程度的关系。我们的主要观点可概括如下:①梗死后4个月有PTI与无PTI的患者相比,有着较大的急性和慢性梗死面积,微血管阻塞更多。②校正慢性Q波幅度,hs-cTnT峰值和梗塞面积以及其他指标(hs-CRP,NT-proBNP,LAD为罪犯血管,PPCI前TIMI血流)后,也显示PTI的振幅与梗死面积的独立相关。③预测慢性大范围的梗死面积的PTI幅度值较强并且与慢性Q波幅度相比显著性更高;④除了hs-cTnT峰值外,PTI与梗死面积估计值的准确性明显相关。总之,这些数据揭示了STEMI后PTI与心肌损伤的强烈关联,提示PTI作为梗死后面积估算的可考虑指标以及更明显的心脏损伤预测因子。
STEMI的患者的特定心电图改变对于日常临床病情观察和诊治至关重要。然而,不同心电图的发病机制和临床意义仍在争论之中,特别是STEMI后T波倒置的作用了解甚少[6]。 有理论认为[7]:梗死后T波倒置是由缺血心外膜延迟复极引起的,这种复极的延迟反转了从心外膜到心内膜的复极向量的方向,解释了负T波构型。急性心肌梗死后的慢性心脏缺血期出现的持续性T波倒置,在梗死后6个月时的比例约75%。我们通过随访,在4个月时达到73%。以前,梗死后PTI被认为是不良临床结果,Koushik等[8]研究147例急性心肌梗死患者,发现梗死后4个月出现的PTI与不良心血管事件独立相关。Piotr等[9]发现:急性心肌梗死患者PTI和左心室功能障碍之间密切相关。除了左心室功能障碍外,目前的调查揭示了PTI与左心室重构不良之间的重要关系[7],而且PTI也是心力衰竭和不良临床结局的主要决定因素。然而,PTI与较差的心脏功能和梗死后结局之间的潜在病理生理学机制仍在研究中。目前研究的资料揭示了PTI与微血管损伤以及急性和慢性梗死面积的显著关系[10],提出PTI作为急诊PCI治疗STEMI患者更广泛的心肌损伤的指标。梗死后PTI超过临床风险评分和左心室射血分数是STEMI后临床结果的主要决定因素,也为预后提供重要信息[11]。通过CMR结果,STEMI人群中检测到的PTI的临床决定因素如:梗塞位置,急诊PCI前TIMI流量,hs-cTnT,hs-CRP和NT-proBNP,也能够反映心肌损伤的程度[12]。因此,我们认为PTI能够说明预后的根本原因是能更明显的提示心肌损伤,此外,还发现PTI的幅度能估计STEMI后心肌损伤的严重程度。
目前,心脏磁共振成像代表了确定梗死面积的黄金标准模式[13]。然而,梗死面积的估算更具成本效益和更容易的临床估计已被深入研究。既往研究认为反应梗死面积的心电图参数是Q波,病理性Q波的存在和幅度与梗塞面积有关[14]。在我们STEMI队列中,持续性病理性Q波的幅度能够预示慢性梗死面积。然而,与病理性Q波相反,PTI与梗死面积之间根据有明显的相关性。在我们的研究中,不仅可以将PTI作为非常精确的测量梗死面积的心电图指标,而且PTI幅度预测慢性梗死面积的价值显著超过Q波幅度。这两种预测能力之间的差异可以通过检测到这两种心电信号之间的差异来解释:1/3的没有PTI的患者显示出持续性病理性Q波,而约10%PTI没有显示病理性Q波。此外,PTI幅度和Q波振幅之间的相关性较弱,这些偏差在临床上是相关的,使PTI比病理Q波更准确地测量梗塞面积。
除了ECG模式,以前的研究大多局限于依据血清标志物的浓度而进行梗死面积的评估[15]。其中hs-cTnT已经成为临床参考标准,不仅用于急性梗死面积估计,而且也用于预测慢性梗死面积[16]。然而,由于梗死愈合是动态过程,单独的hs-cTnT水平可能不足以准确预测慢性梗死面积[17]。重要的是,hs-cTnT与PTI的组合导致我们STEMI患者的慢性梗塞面积预测显著改善[18]。这种预测值表明,PTI提供了有关梗塞愈合和恢复的额外信息,超出了心肌损伤的初始程度。由于这种心肌梗死后的梗死期无法通过基线hs-cTnT测量进行评估,因此hs-cTnT与PTI的组合将可以更全面地评估STEMI梗死心肌的程度和动力学[19]。
本研究我们开发了一种简单的ECG评分系统,将已建立的病理性Q波模式与PTI的新参数结合起来,为日常临床实践提供了一种经济有效的梗死面积估计工具。然而,我们从重新分类分析的数据表明,尽管PTI占主导地位,但另外还包含Q波模式评分系统获得PTI以上的增量预测价值将精确的QwTw评分作为临床梗死面积估计的首选ECG工具。由于我们分析的“最差导联”方法,足以确定QwTw评分和PTI的幅度,使得这种快速和简单的方法在临床常规中容易实现。这种心电图梗死面积测量的高精度突出了心电图对STEMI患者风险分层的临床相关性。
与无PTI的患者相比,梗死后4个月出现PTI的STEMI患者显示更大范围的心肌损伤。此外,PTI的幅度与慢性梗死面积独立相关,对梗塞面积的预测价值比Q波幅度以及hs-cTnT高。PTI与病理Q波(QwTw评分)的联合模式可进一步提高梗死面积估计的准确性,提示QwTw评分可作为一种新型的具有低成本和非侵入性的临床指标改善STEMI患者的危险分层以及预后。

