氟对中华圆田螺肝胰脏抗氧化酶活性和MDA含量的影响
陈剑杰,曹谨玲 ,李潇,阴晴朗
山西农业大学动物科技学院生态畜牧与环境兽医学省级重点实验室,太谷 030801
氟元素广泛分布于自然界,是人和动物生长发育必需的微量元素,然而过量的氟会对动植物产生广泛的毒性作用[1-3]。水中氟含量过高对人类的毒性效应研究已经受到高度重视。迄今为止已有大量的研究报道[4-5],而水氟对水生动物的研究目前比较集中在鱼类[6-9],对贝类的研究还未见报道。
中华圆田螺(Cipangopaludina cahayensis)俗名田螺、香螺,是我国湖泊、河流、水库、池塘及稻田等淡水水域中的一种杂食性大型底栖软体动物,直接从底泥中摄食微生物和有机物等,是多种污染物的生物积累者,在生态位上占有重要的地位。由于中华田螺在水中营匍匐活动,生活环境相对固定,对水环境的变化反应十分敏感,是监测水域污染、评价水域质量最常用的指示生物。因此,利用它作为该试验的受试动物可以比较真实地反映待测定环境周围底泥或水体的实际污染状况,同时客观地评价当地水域质量[10]。
本试验以中华圆田螺为受试对象,研究不同浓度氟暴露对其肝胰脏抗氧化酶活性及丙二醛(malondialdehyde, MDA)含量的影响,从而探讨氟对田螺毒性效应,以期为水质污染控制及生态风险评价提供理论依据。
1 材料与方法(Materials and methods)
1.1 材料
1.1.1试验动物
试验所用中华圆田螺采自太原市鱼种场鲫鱼养殖池塘。经过10 d驯养期后,选择体重为(10 ± 1.8) g的健康田螺作为试验材料。
1.1.2主要仪器
电热恒温水浴锅(HW.SY11-K8,北京长风仪器仪表公司);光学显微镜(CX31,日本奥林巴斯);数显鼓风干燥箱(GZX9023,上海博讯实业有限公司医疗设备厂);电子分析天平(AUY120,日本岛津公司);高精度井式马弗炉(SG-JSL1000,中国科学院上海光学精密机械研究所);氟离子计检测仪(PXS-215,上海越磁电子科技有限公司);台式高速冷冻离心机(TGL-16R,珠海黑马医学仪器有限公司);分光光度计(UV2100,尤尼柯仪器有限公司)。
1.1.3主要试剂
乙醇分析纯;高锰酸钾分析纯;氟化钠(天津市科密欧化学试剂有限公司)分析纯;考马斯亮蓝蛋白测定、总超氧化物歧化酶(total superoxide dismutase, T-SOD)、丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione, GSH)、过氧化物酶(Peroxidase, POD)试剂盒(均购自南京建成生物工程研究所)。
1.2 方法
1.2.1试验分组与染毒
田螺染毒采用静态水质接触染毒法。试验所用水为实验室曝气24 h的自来水,经测定水质满足渔业水质标准的要求。根据文献[11]设计试验,在受试田螺不死亡的前提下,试验浓度的选择应该在96 h LC50值的1/2以下,故而浓度分组分别为0、40、80、160 mg·L-1,每个浓度设2个平行,每个平行50枚田螺于体积为(50 cm×35 cm×15 cm)的水族箱中,底部铺上3 cm厚的细沙,使细沙和试液体积比为1:3。期间用充气泵连续充气,每2 d定时投喂饵料,水温控制在(26±2) ℃,pH 7.0~8.0,溶解氧3.0~4.0 mg·L-1,总氨0.4 mg·L-1,碱度2.4 mg·L-1。培养期间,上覆水中溶解氧一直保持3.0 mg·L-1以上。自然光照下暴露试验连续进行30 d,期间每5 d换一次水,并彻底清洗水族箱。隔天定时用离子选择电极法监测水氟含量,保证浓度恒定不变。分别在水氟暴露10 d、20 d和30 d时各取一次样。
1.2.2抗氧化酶活性的测定
分别在水氟暴露10 d、20 d和30 d时,每个平行组各取7枚田螺。将待测田螺用清水冲洗干净后,解剖腹足、内脏团和生殖器官,用天平分别称重并记录数据、标记编号后,放入烘箱内烘干,以备进行氟含量测定之用。此外,解剖并于每枚田螺称取肝胰脏1 g,加入9倍体积的冰浴生理盐水匀浆,2 500 r·min-1离心10 min,取上清液进行SOD、GSH、POD 、MDA的测定,所有测定步骤均严格按照试剂盒使用说明书进行。
1.2.3数据处理
试验数据用SPSS 17.0版软件进行单因素方差分析处理,用GraphPad Prism 5版软件进行作图。以P < 0.05,P < 0.01表示差异显著。
2 结果(Results)
2.1 SOD活性变化
如图1所示,在整个水氟暴露染毒过程中,与对照组相比,在10 d处理时,160 mg·L-1组的SOD活性显著高于对照组(P<0.01);暴露20 d时,相比于对照组,80 mg·L-1组活性显著升高(P<0.05),其余2组无明显变化;暴露30 d时,与对照组相比,40 mg·L-1
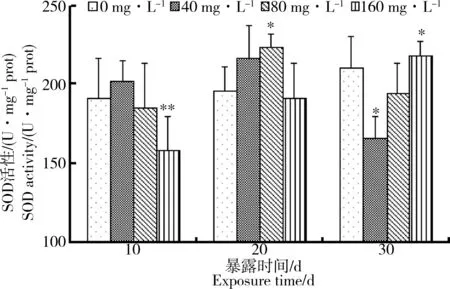
图1 中华圆田螺肝胰脏组织SOD活性随处理时间的变化注:与对照组比较,“* ”为P <0.05,表示差异显著;“* * ”为P <0.01,表示差异显著。下同。Fig. 1 The changes of SOD activity in hepatopancreas of Cipangopaludina cahayensis with timeNote: Compared with the control group, "* " for the P <0.05, showing significant difference; "* * " for the P <0.01, showing significant difference; the same below.
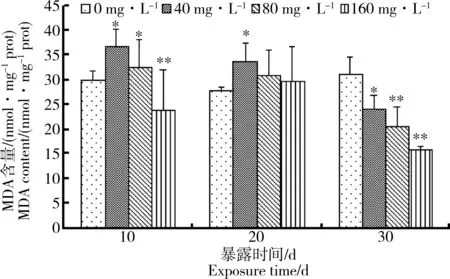
图2 中华圆田螺肝胰脏组织MDA含量随处理时间的变化Fig. 2 The changes of MDA content in hepatopancreas of Cipangopaludina cahayensis with time
组活性被抑制,显著低于对照组(P<0.05),而160 mg·L-1组活性被显著诱导(P<0.05)。
2.2 MDA含量变化
在水氟暴露10 d后,与对照组相比,40 mg·L-1组和80 mg·L-1组MDA含量(图2)显著升高,而160 mg·L-1组含量被抑制,显著低于对照组(P<0.01);暴露20 d后,与对照组相比,40 mg·L-1组含量被诱导,显著高于对照组(P<0.05);暴露30 d后,各组MDA含量均低于对照组。
2.3 GSH活性变化
水氟暴露10 d后,与对照组相比,40 mg·L-1组GSH活性(图3)显著升高,其余变化不明显。20 d时,与对照组相比,GSH活性均显著升高(P<0.01),GSH活性达到最大值30.89 U·mg-1。处理30 d时,肝胰脏组织GSH活性变化与水氟处理浓度有关。中高浓度组GSH活性受到抑制比低浓度组更加明显。40 mg·L-1组在暴露10 d和20 d后,活性均高于其余2组;160 mg·L-1组在暴露10 d时,活性达到最低6.097 U·mg-1,且低于对照组水平,以后呈逐渐上升趋势,在暴露30 d 时,与对照组相比,40 mg·L-1组和160 mg·L-1组GSH活性显著升高。
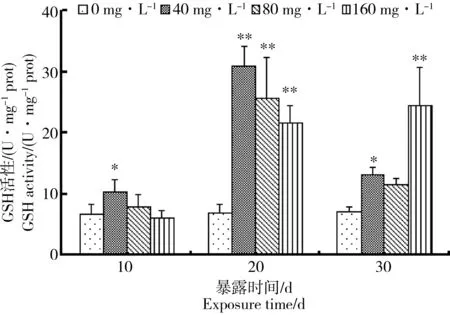
图3 中华圆田螺肝胰脏组织GSH活性随处理时间的变化Fig. 3 The changes of GSH activity in hepatopancreas of Cipangopaludina cahayensis with time
与对照组相比,40 mg·L-1组和160 mg·L-1组GSH活性显著升高。
2.4 POD活性变化
暴露10 d后,中华圆田螺肝胰脏组织POD活性(图4)均低于对照组水平,POD活性均受到显著诱导。在暴露20 d时,与对照组相比,POD活性均受到诱导而显著升高(P<0.05),且160 mg·L-1组达到最大值39.8 U·mg-1。在暴露30 d时,与对照组相比,40 mg·L-1组POD活性显著升高(P<0.05),80 mg·L-1组和160 mg·L-1组活性受到抑制而显著降低(P<0.01),且 80 mg·L-1组达到最小值18.5 U·mg-1。
3 讨论(Discussion)
氟是化学性质极活泼的元素,机体摄入过量氟后,氟可直接攻击氧,干扰氧代谢,导致氧自由基增多。同时氟也可能攻击构成抗氧化酶的微量元素,使抗氧化酶活性下降,同样导致氧自由基增多[12],如脂质过氧化就是氧自由基攻击生物膜中多聚不饱和脂肪酸(PUFA)而引起的一系列氧化过程,进而对生物体造成一种氧化胁迫状态,当氧化胁迫超出了生物体抗氧化防御系统的保护能力时,就会对生物体造成毒害[13]。
超氧化物歧化酶(SOD)是一种诱导酶,可以催化超氧阴离子自由基发生歧化反应生成H2O2,清除体内过高的超氧阴离子自由基[14-15],SOD活性可以反映生物体受到环境氧化胁迫的程度,当生物体受到轻度氧化损伤时,SOD活性往往升高;而当受到重度环境氧化胁迫时,SOD活性通常降低,使生物体内积累过量的活性氧,损害生物体,而在正常情况下,机体内SOD活性和超氧阴离子自由基的含量处于一定的动态平衡中[16-17]。在氟胁迫前20 d时,中华圆田螺肝胰脏组织中SOD活性在中低浓度暴露下呈现升高,在高浓度暴露下活性降低,这被称为是“毒性兴奋效应”,即机体在低浓度毒性下受到诱导,在高浓度毒性下受到抑制而发生一定机体应激反应,对于机体的保护有非常重要的作用。当暴露30 d后,低浓度组SOD活力低于对照组,表明组织中抗氧化系统清除多余自由基的能力慢慢下降,组织受到损伤。而高浓度组活性随着胁迫时间的升高,这可能由于高毒导致了中华圆田螺的闭壳肌和厣的应激闭锁,致使高毒作用不明显,而使得抗氧化系统对于自由基的清除作用相对明显地表现出来,即SOD活性高于对照组[18]。
丙二醛(MDA)是自由基引发脂质产生一系列过氧化作用的分解产物,可以直接反映细胞脂质过氧化的程度[19]。在氟胁迫初期,与对照组相比,中华圆田螺肝胰脏组织中MDA含量在低、中浓度组暴露下升高,高浓度组MDA含量降低。在氟胁迫中期,低浓度组显著升高,中、高浓度组无显著差异,说明低浓度组MDA对于氟胁迫的响应更加显著,产生的大量氧自由基引起膜脂质过氧化,从而导致MDA含量显著升高。当氟胁迫达30 d时,3个浓度组均有显著抑制效应,可能是由于随着氟对机体胁迫时间的延长,机体产生了相应的适应机制,从而促使抗氧化防御系统迅速清除体内产生的过量自由基,导致MDA含量降低。这与黄志斐等[16]对于翡翠贻贝的研究结果相似。
GSH是动物体内重要的水溶性抗氧化剂,它既可以作为谷胱甘肽过氧化物酶(GSH-Px)和谷胱甘肽硫转移酶(GST)的底物,通过这2种酶起解毒作用,又可直接参与动物体内亲电化合物的清除起解毒作用,在动物体内解毒代谢中具有重要作用[20]。正常情况下,GSH在谷胱甘肽过氧化物酶的作用下,把H2O2还原为H2O,其自身被氧化为氧化型谷胱甘肽(GSSG),GSSG受到谷胱甘肽还原酶的催化作用,接受H还原成GSH,使体内自由基的清除反应能够持续进行[21-22]。在水氟胁迫初期,中华圆田螺肝胰脏组织中GSH活性均被诱导,其诱导程度与暴露氟浓度成负相关,在暴露中后期,GSH活性依然表现出诱导效应而使活性呈升高趋势,这可能是机体通过应激反应而使得其GSH含量在短时间内升高,从而消除体内富含的活性氧自由基,因此数据分析表现出GSH活性不同程度均显著升高的现象[17],预测该现象持续一段时间后将会出现显著降低的趋势。这与鲁双庆等[18]的研究结果相似。另外也可能是中华圆田螺在高毒侵害作用下导致的闭壳肌和厣的应激闭锁,致使高毒作用反而不明显,而使得抗氧化系统还在发挥清除自由基的作用。
过氧化物酶(POD)是生物体内抗氧化防御系统的重要保护酶,它们能在一定程度上清除活性氧自由基,维持膜系统的稳定,降低氧化胁迫对细胞的伤害程度[23-24]。在整个水氟环境暴露过程中,中华圆田螺肝胰脏组织中的POD活性呈现出“抑制-诱导-抑制”的变化趋势,这可能是因为:随着暴露时间的增加,POD不断被消耗,致使水氟暴露达到30 d时,POD活性呈下降趋势[25]。在暴露初期,中华圆田螺肝胰脏组织POD活性均受到抑制,且低于对照组水平,表明中华圆田螺在水氟暴露下,体内的抗氧化防御平衡系统遭到破坏,POD活性被抑制,导致细胞衰老加快。在处理中期,POD活性由于受到诱导而高于对照组水平,且160 mg·L-1组被诱导作用最为显著,表明随着肝胰脏内超氧阴离子自由基的升高,POD活性受到应激而含量显著提高,加强清除体内多余H2O2的能力,避免机体受到更多的氧化损伤和毒害,使得细胞衰老减缓。而且研究表明:该时期肝胰脏受到的水氟胁迫程度越深,POD活性越高。当暴露时间达到30 d时,除40 mg·L-1组无明显变化外,其余组均表现为显著降低,且远低于对照组水平,说明中高浓度组氟胁迫已经对组织抗氧化系统产生严重干扰,打破了已产生的POD和消除H2O2的平衡体系,使POD的消除能力低于组织内活性氧自由基产生能力,POD活性急剧下降,不足以消除氟对组织的干扰,从而导致肝胰脏受到氧化损伤。而低浓度组受到的胁迫很轻微,POD氧化平衡体系依旧处于正常状态,随着时间发展,预测一段时间后POD活性会向同期中高浓度组所表现出来的趋势发展。
参考文献(References):
[1]王桂芹. 硒和VitC对高氟所致氧化应激、DNA损伤及Bcl-2蛋白表达影响研究[D]. 广州: 广东药学院, 2011: 19-31
从这些递进的政策可以看出,我国少数民族高等教育的范围在不断扩大,不仅提出了发展少数民族高等师范教育,也十分重视少数民族职业教育的发展,同时,为了提高少数民族干部的文化知识水平,还制定专门政策大力提倡和发展少数民族成人高等教育,为我国少数民族高等教育发展做出了前瞻性的指导,有其深刻的意义和内涵。
Wang G Q. Studies on the influence of selenium and vitamin C on oxidative stress, DNA damage and Bcl-2 protein expression induced by high fluoride [D]. Guangzhou: Guangdong College of Pharmacy, 2011: 19-31 (in Chinese)
[2]Wan S X, Zhang J H, Wang J D. Effects of high fluoride on sperm quality and testicular histology in male rats [J]. Fluoride, 2006, 39(1): 17-21
[3]孙国安. 氟中毒对免疫系统的影响[J]. 河北医药, 2009, 31(4): 468-469
Sun G A. Effect on the immune system. Fluorosis [J]. Hebei Medical Journal, 2009, 31(4): 468-469 (in Chinese)
[4]刘开泰. 饮水型地方性氟中毒[J]. 中国地方病防治杂志, 1994,1(4): 32-34
Liu K T. Endemic fluorosis of drinking water type [J]. Chinese Journal of Control of Endemic Diseases, 1994, 1(4): 32-34 (in Chinese)
[5]张莉, 余波, 朱新波, 等. 氟斑牙患病率和流行指数与水氟尿氟的多元线性分析[J]. 中国地方病防治杂志,2004, 23(2): 170-171
Zhang L, Yu B, Zhu X B, et al. Multiple linear regression of the rate and index of dental fluroses and fluoride content in drinking-water and urine [J]. Chinese Journal of Control of Endemic Diseases, 2004, 23(2): 170-171 (in Chinese)
[6]Chen J, Cao J, Wang J, et al. Effects of fluoride on growth, body composition and serum biochemical profile in a freshwater teleost Cyprinus carpio [J]. Environmental Toxicology and Chemistry, 2013, 32(10): 2315-2321
[8]Cao J L, Chen J J, Wang J D, et al. Effects of fluoride on liver apoptosis and Bcl-2, Bax protein expression in freshwater teleost, Cyprinus carpio [J]. Chemosphere, 2013, 91: 1203-1212
[9]Cao J L, Chen J J, Wang J D, et al. Effects of sodium fluoride on MAPKs signaling pathway in the gills of a freshwater teleost, Cyprinus carpio [J]. Aquatic Toxicology, 2014, 158: 164-172
[10]胡蓉, 唐正义. 镉和汞对中华圆田螺超氧化物歧化酶活性的影响[J]. 四川师范大学学报: 自然科学版, 2012, 35(5): 690-693
Hu R, Tang Z Y. Effect of cadmium and mercury on superoxide dismutase activity of the mud snail [J]. Journal of Sichuan Normal University: Natural Science, 2012, 35 (5): 690-693 (in Chinese)
[11]王瑞龙, 陈玉明, 徐军, 等. 氯氰菊酯对唐鱼肝和鳃组织超氧化物歧化酶(SOD)活性的影响[J]. 生态环境, 2007, 16(3): 790-793
Wang R L, Chen Y M, Xu J, et al. Effect of cypermethrin on superoxide dismutase (SOD) activity in liver and gill tissues of Tanichthys albonubes [J] . Ecology and Environment, 2007, 16(3): 790-793 (in Chinese)
[12]许晓路, 章子贵, 申秀英. 硒拮抗氟中毒的研究进展[J]. 中国地方病学杂志, 2001, 20(3): 222-223
Xu X L, Zhang Z G, Shen X Y. Progress of selenium antagonist on fluorosis [J]. Chinese Journal of Endemiology, 2001, 20(3): 222-223 (in Chinese)
[13]Ritola O, Lyytikäinen T, Pylkkö P, et al. Glutathione-dependent defence system and monooxygenase enzyme activities in Arctic charr Salvelinus alpinus (L.) exposed to ozone [J]. Aquaculture, 2000, 185: 219-233
[14]杨涛, 陈海刚, 蔡文贵, 等. 翡翠贻贝内脏团抗氧化酶活性及脂质过氧化物含量对苯并(b)荧蒽胁迫的生物响应研究[J]. 生态毒理学报, 2011, 6(5): 539-545
Yang T, Chen H G, Cai W G, et al. Response of antioxidant enzymes activities and lipid peroxidation levels in visceral mass of green-lipped mussel (Perna viridis) to benzo[b]fluoranthene stress [J]. Asian Journal of Ecotoxicology, 2011, 6(5): 539-545 (in Chinese)
[15]王贺威, 马胜伟, 张喆, 等. 全氟辛烷磺酸盐(PFOS)胁迫对翡翠贻贝抗氧化酶的影响[J]. 生态毒理学报, 2012, 7(5): 508-516
Wang H W, Ma S W, Zhang J, et al. Effects of perfluorooctane sulfonate (PFOS) exposure on the antioxidant enzymes of Perna viridis [J]. Asian Journal of Ecotoxicology, 2012, 7(5): 508-516 (in Chinese)
[16]黄志斐, 张喆, 马胜伟, 等. BDE209胁迫对翡翠贻贝(Perna viridis) SOD、MDA和GSH的影响[J]. 农业环境科学, 2012, 31(6): 1053-1059
Huang Z F, Zhang Z, Ma S W, et al. Effect of BDE209 on the SOD, MDA, GSH of Perna virdis [J]. Journal of Agro-Environment Science, 2012, 31(6): 1053-1059 (in Chinese)
[17]李敏, 赵月, 曹志会, 等. 链霉素废水对斑马鱼POD活性和GSH含量的影响[J]. 安全与环境工程, 2015, 22(3): 1-6
Li M, Zhao Y, Cao Z H, et al. Impact of streptomycin wastewater on the activity of peroxidase (POD) and the content of glutathione (GSH) in the muscle tissue of Danio rerio [J]. Safety and Environmental Engineering, 2015, 22(3): 1-6 (in Chinese)
[18]鲁双庆, 刘少军, 刘红玉, 等. Cu2+对黄鳝肝脏保护酶SOD、CAT、GSH-PX活性的影响[J].中国水产学报, 2002, 9(2): 138-141
Lu S Q, Liu S J, Liu H Y, et al. Effects of Cu2+on activities of protecting enzymes SOD, CAT and GSH-Px in liver tissue of Monopterus albus [J]. Journal of Fishery Sciences of China, 2002, 9(2): 138-141 (in Chinese)
[19]陈剑杰, 曹谨玲, 罗永巨, 等. 纳米硒对氟胁迫下鲤鱼肝抗氧化功能及组织结构的影响[J]. 应用生态学报, 2013, 24(10): 2970-2976
Chen J J, Cao J L, Lou Y J, et al. Effects of nano-selenium on antioxidant capacity and histopathology of Cyprinus carpio liver under fluoride stress [J]. Chinese Journal of Applied Ecology, 2013, 24(10): 2970-2976 (in Chinese)
[20]边高鹏, 焦海华, 史宝忠, 等. 水胺硫磷亚急性暴露对小鼠肝脏氧化应激的影响[J]. 生态毒理学报, 2015, 10(6): 305-312
Bian G P, Jiao H H, Shi B Z, et al. Oxidative stress of isocarbophos on the liver of mice in a subacute exposure[J]. Asian Journal of Ecotoxicology, 2015, 10(6): 305-312 (in Chinese)
[21]马晓燕, 范立民, 甘居利, 等. 三丁基锡(TBT)对罗非鱼两组织SOD和GSH的影响[J]. 安全与环境学报, 2007, 7(4): 9-11
Ma X Y, Fan L M, Gan J L, et al. Effect of TBT on the activities of superoxide dismutase and the content of glutathione in two tissues of Orechromis aureus [J]. Journal of Safety and Environment, 2007, 7(4): 9-11 (in Chinese)
[22]王辅明, 朱祥伟, 马永鹏, 等. 低浓度五氯酚暴露对稀有鮈鲫体内SOD活性、GSH和HSP70含量的影响[J]. 生态毒理学报, 2009, 4(3): 415-421
Wang F M, Zhu X W, Ma Y P, et al. Effects of low concentration of pentachlorophenol exposure on SOD activity, GSH and HSP70 content in rare minnow (Gobiocypris rarus) [J]. Asian Journal of Ecotoxicology, 2009, 4(3): 415-421 (in Chinese)
[23]迂君, 王桂燕, 周启星, 等. Cd2+污染对草鱼不同组织中过氧化物酶活性的影响[J]. 生态与农村环境学报, 2011, 27(4): 100-103
Yu J, Wang G Y, Zhou Q X, et al. Effects of Cd2+on POD in various organs of grass carp (Ctenopharyngodon idellus) [J]. Journal of Ecology and Rural Environment, 2011, 27(4): 100-103 (in Chinese)
[24]焦传珍. 铈对镉染毒泥鳅肝胰脏中超氧化物歧化酶和过氧化物酶活性的影响[J]. 水产科学, 2009, 28(2): 786-788
Jiao C Z. The effect of cerium on SOD and POD activities in hepatopancreas of oriental weatherfish (Misgurnus anguillicaudatus) stressed by cadmium [J]. Fisheries Science, 2009, 28(2): 786-788 (in Chinese)
[25]宋志慧, 王庆伟. Cu2+、Cd2+、Cr6+胁迫对斑马鱼抗氧化酶活性的影响[J]. 安徽农业科学, 2011, 39(8): 4739-4741
Song Z H, Wang Q W. Effect of Cu2+, Cd2+and Cr6+stress on the anti-oxidative enzyme activities in Danio rerio [J]. Journal of Anhui Agricultural Sciences, 2011, 39(8): 4739-4741 (in Chinese)

