黄精多糖的提取及其对CCl4致大鼠肝损伤的保护作用
韩春杨,杨明川,杨孜生,冯伉梨,刘翠艳
(安徽农业大学 动物科技学院,安徽 合肥 230036)
黄精(Polygonatumsibiricum)首载于《名医别录》,是一味能补气养阴、健脾、润肺、益肾的传统中药材,更具药食两用的特点[1]。黄精的主要化学成分为多糖、甾体皂苷、蒽醌类,其中,黄精多糖(Polygonatumsibiricumpolysaccharides,PSP)是黄精的主要功能成分,具有增强免疫、抗肿瘤、抗动脉硬化、抗氧化、调节造血、降血糖等广泛的药理学作用[2-3]。近年来,随着人们对黄精和PSP认识的不断深入,市场对PSP提取分离技术的要求也逐步提高。目前,国内外多采用热水提取工艺提取PSP,但关于各项提取参数对提取效果影响的研究还不够细致和深入[4-7]。本研究采用响应面分析法(response surface methodology,RSM)对PSP提取参数(液料比、时间和温度)进行优化,以期获得最佳提取工艺;再以所提取的PSP为试验药物进行CCl4诱导的大鼠肝损伤保护试验,通过观察大鼠肝脏解剖病理变化、组织学变化,检测肝功能指标等,综合评价PSP的保肝作用,为其用于动物和人临床肝损伤疾病的治疗提供试验依据。
1 材料与方法
1.1 试验材料
1.1.1药材与试剂
黄精,合肥乐家老铺中药饮片有限公司;葡萄糖(分析纯),天津市大茂化学仪器供应站;蒽酮(分析纯),美仑生物公司;浓硫酸(98%),上海市振企化学试剂有限公司;乙醇(分析纯),上海振兴98化工一厂;CCl4(分析纯),汕头市西陇化工厂有限公司;血清生化试剂,库贝尔生物科技股份有限公司。
1.1.2试验仪器
BSA124S-CW电子分析天平,北京赛多利斯有限公司;HC-2062高速离心机,安徽中科中佳科学仪器有限公司;BA210数码显微镜,麦克奥迪实业集团有限公司;HH-2数显恒温水浴锅,常州国华电器有限公司;RE-52CS旋转负压蒸发仪,上海亚荣生化仪器厂;Alpha-1500紫外可见分光光度计,上海谱元仪器有限公司;YXQ-LS-18SI高压灭菌锅,上海博迅实业有限公司医疗设备厂;LS-2055半自动石蜡切片机,沈阳市龙首电子仪器有限公司;iMagic-V7全自动生化分析仪,库贝尔生物科技股份有限公司。
1.1.3试验动物
雄性SD大鼠,体重180 ~ 220 g,5周龄。
1.2 实验方法
1.2.1黄精多糖的提取
(1)标准曲线绘制[8]。取经105 ℃干燥至恒重的无水葡萄糖对照品33 mg,精密称定,置100 mL容量瓶中,加水溶解并稀释至刻度,摇匀即得对照品溶液。精密量取对照品溶液0.1、0.2、0.3、0.4、0.5、0.6 mL,分别置于10 mL具塞刻度试管中,各加水至2.0 mL,摇匀,在冰水浴中缓缓滴加0.2%蒽酮-硫酸溶液至6 mL,混匀,放冷后置水浴中保温10 min,取出,立即置冰水浴中冷却10 min,取出,以相应试剂为空白。用紫外可见分光光度计,在582 nm波长处测定吸光度。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
(2)PSP提取工艺参数的单因素试验。称取干燥的黄精粉末3 g,按药材∶80%乙醇=1∶3(质量体积比)的比例在80 ℃下进行回流提取6 h,提取后的黄精粉末减压挥干。取处理过的黄精粉末,按不同的液料比(10∶1、15∶1、20∶1、25∶1、30∶1)、时间(1、2、3、4、5 h)、温度(50、60、70、80、90 ℃)进行单因素试验,提取后的PSP溶液醇沉12 h,过滤,取沉淀减压挥干,并用纯水移至250 mL容量瓶中,加纯水至刻度。
(3)PSP含量的测定。精密量取PSP溶液0.1 mL,置10 mL具塞干燥试管中,照标准曲线制备项下的方法,依法测定吸光度,从标准曲线上读出供试品溶液中含无水葡萄糖的质量(mg),计算即得。
(4)响应面法优化PSP提取工艺。综合单因素试验测定的水平范围,应用Design-Expert 8.0软件,设计3因素3水平的响应面试验,基于试验结果,确定PSP的最佳提取条件。
1.2.2动物试验
(1)动物分组与处理。将30只雄性SD大鼠随机分为对照组(Ⅰ)、模型组(Ⅱ)、PSP低剂量组(Ⅲ,75 mg·kg-1)、PSP中剂量组(Ⅳ,150 mg·kg-1)、PSP高剂量组(Ⅴ,300 mg·kg-1)。PSP用药组每天灌胃不同剂量的PSP溶液,对照组、模型组每天灌胃等量蒸馏水,连续7 d。在末次给药1 h后,模型组与用药组按照1 mL·kg-1腹腔注射50% CCl4大豆油溶液,对照组腹腔注射等量大豆油。
(2)样品采集与处理。CCl4注射24 h后,大鼠腹腔注射10%水合氯醛(3.5 mL·kg-1)麻醉。心脏采血,置于非抗凝管中,离心(598g,10 min)吸取上清液,-20 ℃保存。取不同大鼠肝右侧叶(具最大横截面,有门脉区和中央静脉区)的肝组织,固定于4%多聚甲醛中。
1.2.3肝脏组织病理学观察
取4%多聚甲醛中固定的肝脏组织,经过洗涤、脱水、透明、浸蜡、包埋、切片与粘片、脱蜡、HE染色、脱水、透明、封片等步骤制成石蜡切片,于光学显微镜下进行组织学病变观察。
1.2.4肝功能指标检测
取大鼠血清,于全自动生化分析仪上检测丙氨酸转氨酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)的活性和直接胆红素(DBIL)、总胆红素(TBIL)的含量变化。
1.3 数据分析
所有数据以平均值±标准差表示。响应面结果采用Design-Expert 8.0软件进行分析。所有试验数据应用SPASS 20.0进行单因素方差分析(one-way-ANOVA),对有显著差异(P<0.05)的处理采用Duncan多重比较。
2 结果与分析
2.1 标准曲线
如图1所示,由紫外分光光度仪测得吸光度值,以浓度为横坐标、吸光度值为纵坐标绘制标准曲线,得线性回归方程:y=0.011 5x+0.029 7(R2=0.999 3)。PSP在5.5 ~ 33.0 μg·mL-1范围内,其进样浓度(x,μg·mL-1)与吸光度值(y)之间呈现良好的线性关系。
2.2 单因素试验结果
2.2.1液料比对PSP提取率的影响
控制反应条件为时间3 h,温度80 ℃,考查液料比分别为10∶1、15∶1、20∶1、25∶1、30∶1时PSP的提取率。由图2可知,随着液料比增大,PSP提取率也逐渐增大。当液料比达到25∶1之后,PSP提取率基本不再增加。因此选择液料比20∶1、25∶1和30∶1作为响应面试验液料比的水平。
2.2.2时间对PSP提取率的影响
控制反应条件液料比20∶1,温度80 ℃,考查提取时间分别为1、2、3、4、5 h时PSP的提取率。由图3可知,随着时间延长,PSP提取率也逐渐增大。当时间达到3 h后,PSP提取率基本不再增加。因此选择提取时间2、3、4 h作为响应面试验时间的水平。

图1 标准曲线Fig.1 Standard curve of PSP

图2 不同液料比对PSP提取率的影响Fig.2 Effects of liquid material ratio on extraction rate of PSP

图3 不同时间对PSP提取率的影响Fig.3 Effects of time on extraction rate of PSP
2.2.3温度对PSP提取率的影响
控制反应条件液料比20∶1,时间3 h,考查温度分别为50、60、70、80、90 ℃时PSP的提取率。由图4可知,随着温度的提高,PSP提取率也逐渐增大。当温度达到70 ℃后,PSP提取率基本不再增加。因此选择温度60、70、80 ℃作为响应面试验温度的水平。

图4 不同温度对PSP提取的影响Fig.4 Effects of temperature on extraction rate of PSP
2.3 响应面试验结果
2.3.1因素水平表
综合单因素试验结果,组合出响应面试验的3因素3水平条件(表1)。
2.3.2响应面试验设计及结果
响应面法试验方案及结果见表2。
2.3.3因素间的交互影响
比较图5~7中响应面的陡峭度和等高线的形状,可以直观地看出各因素交互作用对响应值的影响。AB交互作用对PSP提取率的影响最为显著,表现为响应面较陡峭,等高线呈椭圆形,AC交互作用与BC交互作用次之,相应表现为响应面较为平滑,且随其数值的增加或减少,响应值没有显著变化。
2.3.4响应面法方差分析
如表3所示,对该模型进行方差分析,并对模型系数进行显著性检验。以P<0.05表示差异显著。可以看出,模型达显著水平(P=0.000 4),失拟项不显著(P=0.192 7),表明未知因素对试验结果干扰很小,该模型能真实且较好地反映自变量与响应值之间的关系。模型系数R2=0.961 1,表明试验充分拟合试验数据,可用该回归方程代替试验真实点进行分析,预测PSP的提取率。观察各自变量看出,一次项中自变量C的偏回归系数达到显著水平(P<0.05),说明温度对PSP的提取影响显著。交互项中AB的偏回归系数达到显著水平(P<0.05),说明液料比与时间的交互作用对PSP的提取有显著影响。3个因素对PSP提取的影响依次为温度>时间>液料比。以PSP提取率为响应值,以3因素所对应的正交试验中的水平(即-1、0、1)为自变量,经回归拟合后,得到回归方程:
表1响应面试验因素水平
Table1Factors and levels of RSM for PSP extraction

因素Factors水平Levels-101A-液料比A-Liquidmaterialratio202530B-时间/hB-Time/h234C-温度/℃C-Temperature/℃607080
表2响应面试验设计及结果
Table2Program and test results of RSM for PSP extraction
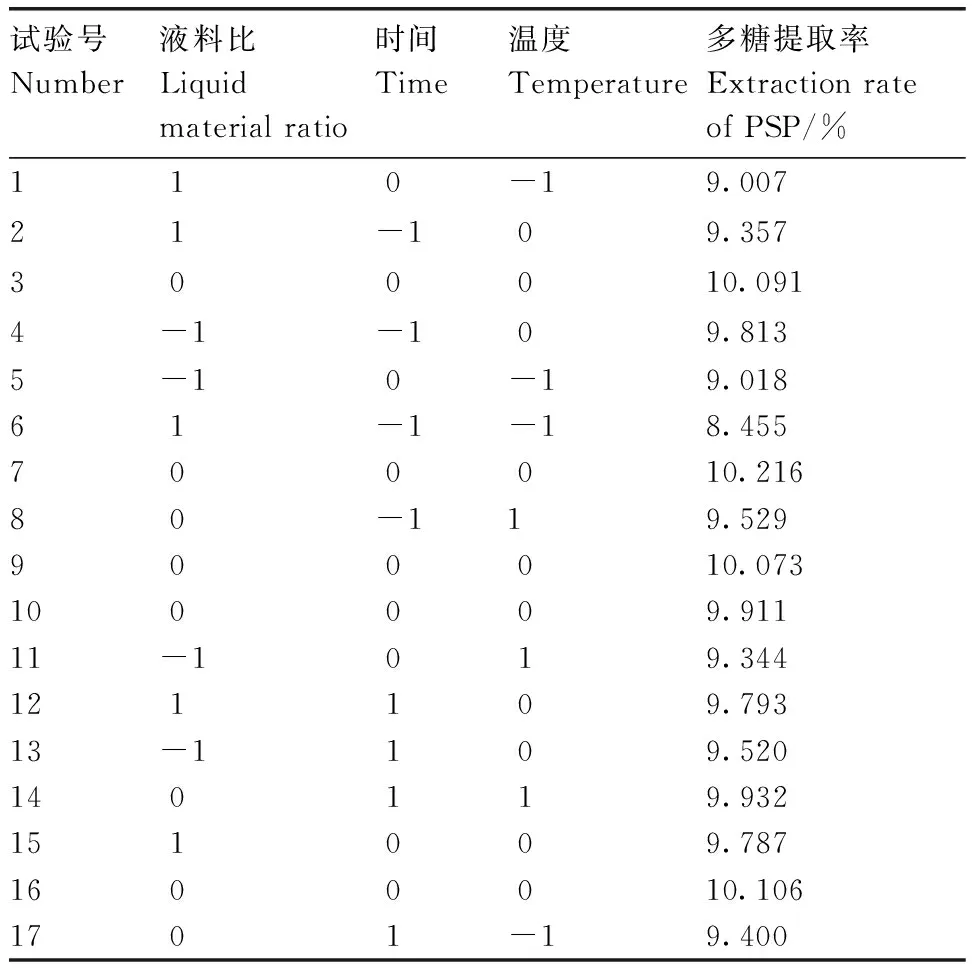
试验号Number液料比Liquidmaterialratio时间Time温度Temperature多糖提取率ExtractionrateofPSP/%110-19.00721-109.357300010.0914-1-109.8135-10-19.01861-1-18.455700010.21680-119.529900010.073100009.91111-1019.344121109.79313-1109.520140119.932151009.7871600010.1061701-19.400

A,液料比;B,时间;C,温度;R,多糖提取率。图6~7同。A, Ratio of liquid to material; B, Time; C, Temperature; R, Extraction rate of PSP. The same as in Fig. 7, 8.图5 液料比与时间的交互作用对PSP提取率的影响Fig.5 Interaction of liquid material ratio and time on extraction rate of PSP

图6 液料比与温度的交互作用对PSP提取率的影响Fig.6 Interaction of temperature and liquid material ratio on extraction rate of PSP

图7 时间与温度的交互作用对PSP提取率的影响Fig.7 Interaction of temperature and time on extraction rate of PSP
Y=10.09+0.024A+0.11B+0.26C+0.20AB+0.13AC+0.026BC-0.34A2-0.13B2-0.46C2。
对回归方程进行偏导求解,得出最佳提取PSP条件:液料比19.13∶1,时间3.49 h,温度73.33 ℃。在此条件下,PSP理论提取率为10.107%。为检验结果的可靠性,采用最佳提取条件重复3次,结果得出PSP的实际提取率分别为9.967%、10.042%和9.985%,平均值为9.998%。综上,实际试验结果和回归模型的预测值基本吻合,表明该回归模型可准确地模拟和预测PSP提取率。
2.4 PSP对肝损伤大鼠肝脏组织病理学的影响
如图8所示:对照组大鼠肝脏呈暗红色,表面光滑,边缘锐利;模型组大鼠肝脏呈土黄色,表面有坏死点;各用药组大鼠肝脏均有不同程度的改善,其中高剂量组恢复程度最好,颜色较接近于对照组,形态较好。
2.5 PSP对肝损伤大鼠肝功能指标的影响
如图9显示:模型组ALP活性显著高于对照组(P<0.05)、PSP低、中、高剂量组,且对照、PSP低、中、高剂量组之间无显著差异(P>0.05);模型组ALT活性显著(P<0.05)高于对照组、PSP低、中、高剂量组,低、中剂量组ALT活性显著高于对照组、高剂量组(P<0.05),高剂量组ALT活性显著高于对照组(P<0.05);模型组AST活性显著高于对照组、中、高剂量组(P<0.05),低、中剂量组AST活性显著高于对照组、高剂量组(P<0.05);模型组DBIL含量显著高于对照组(P<0.05)、PSP低、中、高剂量组,低、中剂量组DBIL含量显著高于对照组(P<0.05);模型组TBIL含量显著高于对照组、PSP低、中、高剂量组(P<0.05),低剂量组TBIL含量显著高于对照组(P<0.05)。
综上,模型组的5个肝功能指标与对照组相比均有显著差异(P<0.05),PSP低、中、高剂量组相对于模型组均有改善作用,且中、高剂量组改善效果较为明显。
如图10所示,对照组大鼠肝小叶结构完整,肝索呈放射状排列,整齐而有规则,肝细胞结构及形态正常,细胞排列整齐,大小均匀,分界清楚,细胞核大而圆,核质分布均匀,核仁清晰。与空白组相比,模型组肝脏出现以中央静脉为中心的局灶性肝细胞空泡样坏死,胞质溶解,细胞核浓缩或消失,细胞内存在脂滴,炎性细胞浸润,肝索排列紊乱。PSP用药组对CCl4导致的肝损伤均有改善作用,其中高剂量组改善效果较为明显,空泡样坏死明显减少,炎性细胞数目明显少于模型组,且存在损伤修复细胞,肝脏结构较为完整。
表3方差分析
Table3Analysis of variance

方差来源Source平方和SumofSquaresdf均方差MeanSquareFP模型Model3.4690.3819.230.0004A0.004710.00470.230.6441B0.08010.0804.030.0848C0.4810.4824.050.0017AB0.1710.178.290.0236AC0.07010.0703.520.1029BC0.002210.00220.110.7497A20.4110.4120.430.0027B20.06410.0643.220.1158C20.8310.8341.600.0004残差Residual0.1470.020失拟项LackofFit0.09230.0312.560.1927重复性纯误差Pureerror0.04840.012总离差Cortotal3.6016

A,对照组;B,模型组;C,低剂量组;D,中剂量组;E,高剂量组。图9同。A, Control group; B, Model group; C, Low dose group; D, Middle dose group; E, High dose group. The same as in Fig. 9.图8 不同组别大鼠肝脏病理学变化Fig.8 Pathological changes of liver in rats of different groups

柱上无相同小写字母的表示差异显著(P<0.05)。Bars marked without the same letters indicated significant difference at P<0.05.图9 不同组别的大鼠肝功能指标变化Fig.9 Changes of liver function indexes in different groups of rats

图10 不同组别大鼠肝脏组织学的变化Fig.10 Histological changes of liver in rats of different groups
3 讨论
近年来,随着我国集约化养殖业的发展,药物中毒、饲料霉变、病原微生物感染,以及环境因素引起的畜禽肝损伤越来越普遍。肝损伤会造成动物物质代谢障碍、胆汁的形成和排泄障碍、解毒能力降低等一系列病理变化和相应的综合征,给畜禽养殖业带来严重危害;因此,研发有效保护和治疗动物肝损伤的低毒低残留药物具有重要的实际意义。中药是我国传统医学的瑰宝,许多具有清热解毒、利湿退黄、活血化瘀、疏肝理气等功效的中药被用于肝病的传统治疗。本研究室前期研究结果表明,中药黄精对镉引起的生殖损伤及肝损伤有较好的治疗作用,但有效成分未知。故本研究首先采用响应面法优化PSP提取工艺,再对PSP的保肝作用进行初步探讨。
目前PSP的提取分离方法主要包括热水提取、醇析分离、微波辅助提取[9-10]、超声波提取[11-12]等,均存在耗能高、提取率低等缺点[13]。本研究采用水提醇沉法提取PSP,以黄精水提液中PSP提取率为评价指标,先根据相关资料选取合适的因素水平(液料比10∶1、15∶1、20∶1、25∶1、30∶1;时间1、2、3、4、5 h;温度50、60、70、80、90 ℃)进行单因素试验,再通过响应面法分析获得了PSP的最佳提取工艺条件:液料比19.13∶1,时间3.49 h,温度73.33 ℃,此时,PSP理论提取率为10.107%。与时晓娟等[14]、徐兵兵等[15]的研究相比,该提取率处于较高水平。当然,所测多糖含量还会受药材来源的影响。在统计方法方面,与李丽等[16]、陈法才[17]]采用的正交方法比较,本研究采用响应面法,涉及的内容更具体,考查了液料比、时间和温度这3个因素对多糖提取率的影响,确定了黄精多糖提取的最大影响因素为温度,同时分析了各因素之间的交互作用,发现液料比与时间的交互作用对黄精多糖的提取有显著影响,这与陈钢等[18]的研究结果一致。另外,本研究比陈艳等[19]、粟敏等[20]报道的提取工艺耗能低、操作简单,更适合于工业化批量生产。

本研究采用响应面法优化PSP提取工艺,对黄精以及其他中药材资源的开发利用及建立植物多糖的共性关键技术具有一定的参考价值。通过对PSP对CCl4诱导的大鼠肝损伤的保护作用研究,发现PSP在对抗肝损伤方面效果显著,有望在动物和人肝损伤疾病方面发展成为新的治疗药物。
参考文献(References):
[1]祝凌丽,徐维平. 黄精总皂苷和多糖的药理作用及其提取方法的研究进展[J]. 安徽医药,2009,13(7):719-722.
ZHU L L, XU W P. The pharmacological action in total saponins and polysaccharides and advances in the extraction method ofPolygonatumcyrtonema[J].AnhuiMedicalandPharmaceuticalJournal, 2009, 13(7):719-722. (in Chinese)
[2]王慧, 袁德培, 曾楚华, 等. 黄精的药理作用及临床应用研究进展[J]. 湖北民族学院学报(医学版), 2017, 34(2):58-60, 64.
WANG H, YUAN P D, ZENG C H, et al. Advances in pharmacological effects and clinical application ofPolygonatumcyrtonema[J].JournalofHubeiUniversityforNationalities(MedicalEdition), 2017, 34(2):58-60, 64. (in Chinese)
[3]YANG J, WU S, HUANG X, et al. Hypolipidemic activity and antiatherosclerotic effect of polysaccharide ofPolygonatumsibiricumin rabbit model and related cellular mechanisms[J].Evidence-BasedComplementrayandAlternativeMedicine, 2015, 2015: 391065
[4]梁引库. 黄精多糖提取工艺的研究[J]. 中国农学通报,2012,28(12):269-272.
LIANG Y K. Study on the extraction process ofPolygonatumpolysaccharide[J].ChineseAgriculturalScienceBulletin, 2012, 28(12):269-272. (in Chinese with English abstract)
[5]杨军宣,张毅,吕姗珊,等. 减压内部沸腾法提取黄精多糖的工艺[J]. 中成药,2016,38(2):460-463.
YAN J X, ZHANG Y, LYU S S, et al. Process for extractingPolygonatumsibiricumpolysaccharide by decompressing internal boiling method[J].ChineseTraditionalPatentMedicine, 2016, 38(02): 460-463. (in Chinese)
[6]张娇娇,张睿,宁伟. 热河黄精多糖含量及总黄酮超声提取方法研究[J]. 时珍国医国药,2015,26(12):2870-2871.
ZHANG J J, ZHANG R, NING W. The jehol rhizomapolygonatumpolysaccharide content and research on ultrasonic extraction method of flavonoid[J].LishizhenMedicineandMateriaMedicaResearch, 2015, 26(12):2870-2871. (in Chinese)
[7]郭未艳,孙秋燕,徐晓红,等. 滇黄精多糖提取的工艺组合及其优化[J]. 时珍国医国药,2013,24(6):1391-1393.
GUO W Y, SUN Q Y, XU X H, et al. The extraction technology of polysaccharide fromPolygonatumKingiamum Coll. et Hemsl and its optimization[J].LishizhenMedicineandMateriaMedicaResearch, 2013, 24(6):1391-1393. (in Chinese with English abstract)
[8]国家药典委员会. 中华人民共和国药典:一部[M]. 北京:化学工业出版社,2015∶306-307.
[9]张瑞堂,石晓峰,马趣环,等. 微波辅助提取黄精多糖的工艺研究[J]. 中国药师,2009,12(12):1733-1735.
ZHENG R T, SHI X F, MA Q H, et al. Study on the microwave-assistant extraction polysaccharide inPolygonatumsibiricumRed[J].ChinaPharmacist, 2009, 12(12):1733-1735. (in Chinese with English abstract)
[10]胡芳,周娟娟,陈爱娟. 黄精多糖微波辅助提取工艺研究[J]. 现代中药研究与实践,2015,29(4):52-54.
HU F, ZHOU J J, CHEN A J. The optimum methods ofpolygonatumpolysaccharide by microwave-assisted extraction[J].ResearchandPracticeofChineseMedicines, 2015, 29(4):52-54. (in Chinese with English abstract)
[11]刘慧,张春岭,陈大磊,等. 响应面法优化超声波提取山楂皮渣三萜酸工艺[J]. 保鲜与加工,2017,17(1):53-59.
LIU H, ZHANG C L, CHEN D L, et al. Optimization of ultrasonic-assisted extraction technique of triterpene acids fromHawthornpomaceby response surface methodology[J].StorageandProcess, 2017, 17(1):53-59. (in Chinese with English abstract)
[12]骆文灿. 超声波辅助提取长梗黄精多糖工艺的研究[J]. 福建农业学报, 2016, 31(4):431-436.
LUO W C. Ultrasonic-assisted extraction of polysaccharides fromPolygonatumfilipes[J].FujianJournalofAgriculturalSciences, 2016, 31(4):431-436. (in Chinese with English abstract)
[13]卜红南. 黄精多糖的提取及其免疫活性研究[J]. 实用医药杂志,2017,34(1):48-51.
BU H N. Study on the extraction process and immune activity ofPolygonatumpolysaccharide[J].TheJournalofPracticalMedicine, 2017, 34(1):48-51. (in Chinese)
[14]时晓娟,李朋收,魏颖,等. 黄精多糖提取工艺及药理作用研究进展[J]. 中医药导报,2015,21(23):103-105.
SHI X J, LI P S, WEI Y, et al. Research progress on extraction and purification technologies and pharmacological effects ofPolygonatumpolysaccharide: a review[J].GuidingJournalofTraditionalChineseMedicineandPharmacy, 2015, 21(23):103-105. (in Chinese with English abstract)
[15]徐兵兵,于勇杰,吴帆,等. 黄精多糖研究综述[J]. 中国野生植物资源,2015,34(4):38-41,46.
XU B B, YU Y J, WU F, et al. Research progress ofPolygonatumsibiricumpolysaccharide[J].ChineseWildPlantResources, 2015, 34(4):38-41, 46. (in Chinese with English abstract)
[16]李丽,杨思文,施伽. 黄精多糖的提取工艺优化[J]. 安徽农学通报,2017,23(5):45-47.
LI L, YANG S W, SHI J. Optimization of extraction technology ofPolygonatumpolysaccharid[J].AnhuiAgriculturalScienceBulletin, 2017, 23(5):45-47. (in Chinese with English abstract)
[17]陈法才. 清远地区黄精中多糖的提取工艺优化研究[J]. 湖北科技学院学报,2015,35(2):11-12.
CHEN F C. Study on optimization of extraction process of polysaccharides fromPolygonatumfrom Qingyuan area[J].JournalofHubeiUniversityofScience, 2015, 35(2):11-12. (in Chinese)
[18]陈钢,陈红兰,苏伟,等. 响应面分析法优化黄精多糖提取工艺参数[J]. 食品科学,2007,28(7):198-201.
CHEN G, CHEN H L, SU W, et al. Optimization of extraction technique ofPolygonatumsibiricumpolysaccharides by response surface analysis[J].FoodScience, 2007, 28(7):198-201. (in Chinese with English abstract)
[19]陈艳,王杰,李慧,等. 黄精多糖的闪式提取及对乳酸菌发酵特性的影响[J]. 食品工业,2017,38(6):161-166.
CHEN Y, WANG J, LI H, et al. Extraction of polysaccharide fromPolygonatumand its effects on fermentation characteristics of lactic acid bacteria[J].TheFoodIndustry, 2017, 38(6):161-166. (in Chinese with English abstract)
[20]粟敏,陈琳,龙昱,等. 离子液体-微波辅助提取多花黄精多糖工艺研究[J]. 中药材,2016,39(9):2075-2077.
SU M, CHEN L, LONG Y, et al. Study on microwave-assisted extraction of polysaccharides fromPolygonatumsibiricumby ionic liquid[J].JournalofChineseMedicinalMaterials, 2016, 39(9):2075-2077. (in Chinese)
[21]FU Y, ZHENG S, LIN J, et al. Curcumin protects the rat liver from CCl4-caused injury and fibrogenesis by attenuating oxidative stress and suppressing inflammation[J].MolecularPharmacology, 2008, 73(2):399-409.
[22]邵坚,罗光明,朱继孝,等. 栀子不同炮制饮片对四氯化碳致急性肝损伤大鼠的保护作用[J]. 中药材,2016,39(7):1521-1524.
SHAO J, LUO G M MI J X, et al. Comparative study on protection effects of CCl4-Induced acute liver injury of different prepared products fromGardeniajasminoidesfruits in rats[J].JournalofChineseMedicinalMaterials, 2016, 39(7):1521-1524. (in Chinese with English abstract)
[23]BEDOGNI G, MIGLIOLI L, MASUTTI F, et al. Prevalence of and risk factors for nonalcoholic fatty liver disease: the dionysos nutrition and liver study[J].Hepatology, 2005, 42(1):44-52.
[24]LEE C H, PARK S W, KIM Y S, et al. Protective mechanism of glycyrrhizin on acute liver injury induced by carbon tetrachloride in mice[J].BiologicalandPharmaceuticalBulletin, 2007, 30(10):1898-1904.
[25]刘建国,高辉,于俊玲,等. 双环醇对抗精神病药物所致肝损伤患者血清碱性磷酸酶(ALP)及白蛋白(ALB)水平的影响[J].中国实验诊断学,2015,19(1):59-61.
LIU J G, GAO H, YU J L, et al. Effects of bicyclic alcohol on serum alkaline phosphatase (ALP) and albumin (ALB) levels in patients with liver injury induced by antipsychotic drugs[J].ChineseJournalofLaboratoryDiagnosis, 2015, 19(1):59-61. (in Chinese)
[26]QUAN J, YIN X, XU H.Boschniakiarossicaprevents the carbon tetrachloride-induced hepatotoxicity in rat[J].ExperimentalandToxicologicPathology, 2011, 63(1):53-59.
[27]柳成刚,王晓丽,姜德友,等. 肝达康对DMN致大鼠肝损伤血清ALT, AST, TBIL, TP及ALB的影响[J]. 中医药信息,2012,29(4):74-76.
LIU C G, WANG X L, JIANG D Y, et al. Effects of Gandakang (GDK) on ALT, AST, TP, ALB and TBIL in serum of hepatic injury rats induced by DMN[J].InformationonTraditionalChineseMedicine, 2012, 29(4):74-76. (in Chinese with English abstract)
[28]TREMLETT H, OGER J. Hepatic injury, liver monitoring and the beta-interferons for multiple sclerosis[J].JournalofNeurology, 2004, 251(11):1297-1303.

