草甘膦与镉复合胁迫对玉米幼苗抗氧化酶活性及光合作用的影响
陈佳月,解静芳,姜洪进,贾真真,刘瑞卿
山西大学环境与资源学院,太原 030006
草甘膦(glyphosate, PMG)是一种高效、低毒、内吸传导性叶面喷施芽后除草剂,是当今世界生产量和使用量最大的农药品种[1],被广泛应用于农业、林业生产中。镉(cadmium, Cd)是剧毒金属元素之一,具有较强的致癌、致畸和致突变作用,一旦进入土壤便会长时间滞留在耕作层中,并可通过食物链富集危害人体健康,被美国毒物管理委员会(ATSDR)列为第6位危及人体健康的有毒物质[2]。近年来,随着工农业的迅速发展,环境污染加剧,导致农田土壤农药和重金属复合污染问题日益严重。
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)是植物体内活性氧防御系统的主要酶系统[3],植株抗氧化酶活性的提高可清除植物体内产生的活性氧自由基(reactive oxygen species, ROS),减小胁迫条件下外界对植物的氧化损伤。丙二醛(MDA)是膜脂过氧化的主要产物之一,其含量大小可以反映植物细胞膜脂受活性氧伤害的程度[4]。胁迫条件下,叶绿素含量与OJIP曲线(快速叶绿素荧光诱导动力学曲线)可以直观地反映植物光合参数是否受到外界影响。有研究表明,除草剂、重金属均会诱导植物产生过量的ROS,使植物细胞出现膜脂过氧化损伤[5-6],导致细胞膜受到破坏,光合作用能力下降,代谢活动紊乱,甚至植株死亡。原向阳等[7-8]等研究表明,PMG会降低抗草甘膦大豆叶片的叶绿素含量指数,而干旱等非生物胁迫则会加剧PMG对抗草甘膦大豆幼苗的伤害。王米道等[9]研究表明,Cu2+与PMG复合污染在一定程度上减弱了PMG对小麦发芽率和芽长的抑制作用,且Cu2+的存在在低PMG浓度时增强对小麦根长的抑制,高PMG浓度时降低对根长的抑制。许昊等[10]研究表明,砷和PMG复合污染对水稻种子萌发具有协同抑制作用。
目前,国内外关于PMG与Cd复合胁迫的相关研究尚不多见,而PMG与Cd复合胁迫对玉米幼苗抗氧化酶活性和光合参数的影响研究还未见报道。为了探讨PMG与Cd复合胁迫对玉米幼苗生长影响的作用机制,本试验以广泛种植的斯达糯10号玉米幼苗为研究对象,探讨在PMG与Cd复合胁迫下,玉米幼苗的抗氧化酶活性、丙二醛含量、叶绿素含量、OJIP曲线及光合参数的变化特征和响应机制,旨在为农田合理喷施PMG提供理论依据。
1 材料与方法(Materials and methods)
1.1 试验材料及设备
试验玉米种子购自北京中农斯达农业科技开发有限公司,品种为斯达糯10号;试验土壤采自山西省太原市小店区0~10 cm深的土壤,土壤风干后过2 mm筛,备用。
草甘膦为美国孟山都公司生产的草甘膦铵盐可溶粒剂,草甘膦铵盐含量为74.7%,农药登记证号PD20060050;Cd2+使用天津市光复科技发展有限公司生产的CdCl2配制,为分析纯,执行标准号为GB/T 1285—1994。
光照培养箱(LI15,美国SHELLAB有限公司),高速冷冻离心机(Z36HK,德国哈默公司),紫外分光光度计(UV2100,尤尼柯上海有限公司),连续激发式荧光仪(FluorPen 100,PSI,捷克),电脑及Flor pen软件(PSI,捷克),万分之一天平(HZK,福州华志科学仪器有限公司)。
1.2 试验设计
根据前期调查分析以及查阅文献可知,Cd会在土壤中积累,且在国内污灌区浓度最高可达5.0 mg·kg-1,因此选取Cd含量为5.0 mg·kg-1[11-12]。草甘膦铵盐防除一年生杂草推荐剂量为100 g~200 g(换算为1.25~2.5 mg·kg-1)。试验分设单一PMG胁迫和PMG与Cd复合胁迫2个系列,每个系列分别设置对照和5个不同质量浓度的PMG处理,每处理4个重复,共48个样品。单一和复合胁迫PMG浓度均分别设置为0、1.25、2.5、5、10、20 mg·kg-1,复合胁迫中,Cd2+浓度设置均为5 mg·kg-1。
称取试验风干土180 g,装入圆形塑料盆钵(上部直径为9 cm,下部直径为6.5 cm,高度为6.5 cm,底部有排水孔)。单一处理系列和复合处理系列分别加入50 mL蒸馏水和含Cd2+的水溶液(使得复合处理系列土壤Cd2+含量为5 mg·kg-1)。每盆钵中放置8粒种子,再用约40 g土壤覆盖,覆膜[13]。培养过程均在光照培养箱中进行。待幼苗3叶完全展开时分别用手持式压缩喷雾器均匀喷施一定体积的、不同浓度的PMG和蒸馏水(对照),喷至叶片完全湿润,重复3次。喷药5 d后取不同处理组植株用于测定玉米幼苗植株的抗氧化酶活性、叶绿素含量及荧光动力学曲线。
1.3 测定方法
1.3.1抗氧化酶活性测定
酶液提取:取0.2 g新鲜玉米幼苗(叶与根混合)洗净后置于预冷的研钵中,加入1.6 mL 50 mmol·L-1预冷的磷酸缓冲溶液在冰浴上研磨成匀浆,转入离心管中在4 ℃、12 000 r·min-1下离心20 min,取上清液。SOD活性采用氮蓝四唑(NBT)光化还原法测定[14];POD活性采用愈创木酚法测定[15];CAT活性采用紫外吸收法测定[16];MDA含量采用硫代巴比妥酸法测定[17]。
1.3.2叶绿素含量测定
选取玉米幼苗的第二片叶子,称取0.1 g,加入8 mL 80%丙酮溶液(pH 7.8)研磨,4 000 r·min-1离心10 min。上清液在663 nm和645 nm处测定吸光值[18]。
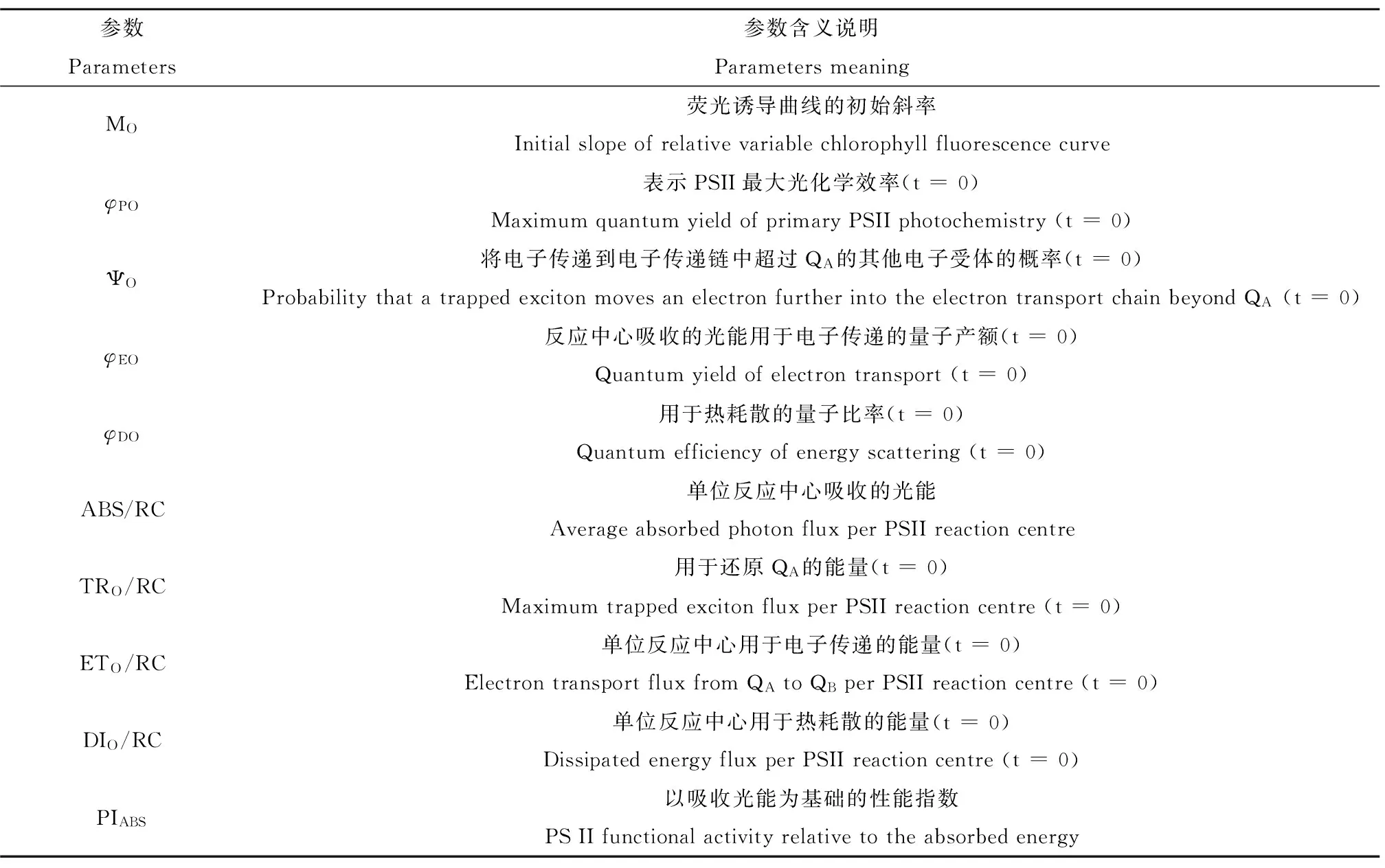
表1 叶绿素荧光诱导曲线的参数及生物学意义Table 1 Parameters and biological significance of chlorophyll fluorescence induction curve
1.3.3OJIP曲线测定
玉米幼苗暗适应24 h后,用连续激发式荧光仪测定OJIP曲线。此曲线可以反映PSII(光系统II)光化学变化的诸多相关参数[3],如表1所示。
1.4 数据分析
使用Excel 2010进行数据处理,使用SPSS 17.0统计软件对不同处理数据进行t检验,显著性水平分别为*P<0.05,* * P<0.01,* * * P<0.001;#P<0.05,##P<0.01,###P<0.001。使用Origin 8.0进行图表制作。
2 结果(Results)
2.1 对玉米幼苗抗氧化酶活性的影响
PMG单一和复合处理(不同浓度PMG和5 mg·kg-1的Cd2+),SOD、POD、CAT酶活性和MDA含量的变化情况详见图1。由图1(A、B、C)可知,2种胁迫系列SOD、POD、CAT活性,均随PMG浓度的增大呈先升后降的趋势。单一胁迫系列3种酶活性升高的最高点均为5 mg·kg-1;复合胁迫系列3种酶活性升高的最高点则均为2.5 mg·kg-1;说明Cd2+的存在,加大了PMG单独存在时的损害作用,使得玉米幼苗对PMG胁迫的敏感浓度点从5 mg·kg-1提前到2.5 mg·kg-1。与其各自空白对照相比,单一胁迫在PMG质量浓度为2.5~5 mg·kg-1时,SOD活性显著增大(P<0.01),POD、CAT则无显著性差异(P>0.05);PMG浓度为5~20 mg·kg-1时,SOD、POD、CAT活性均显著降低(P<0.05)。与Cd2+单一胁迫相比,复合胁迫在PMG浓度为1.25~2.5 mg·kg-1时,SOD活
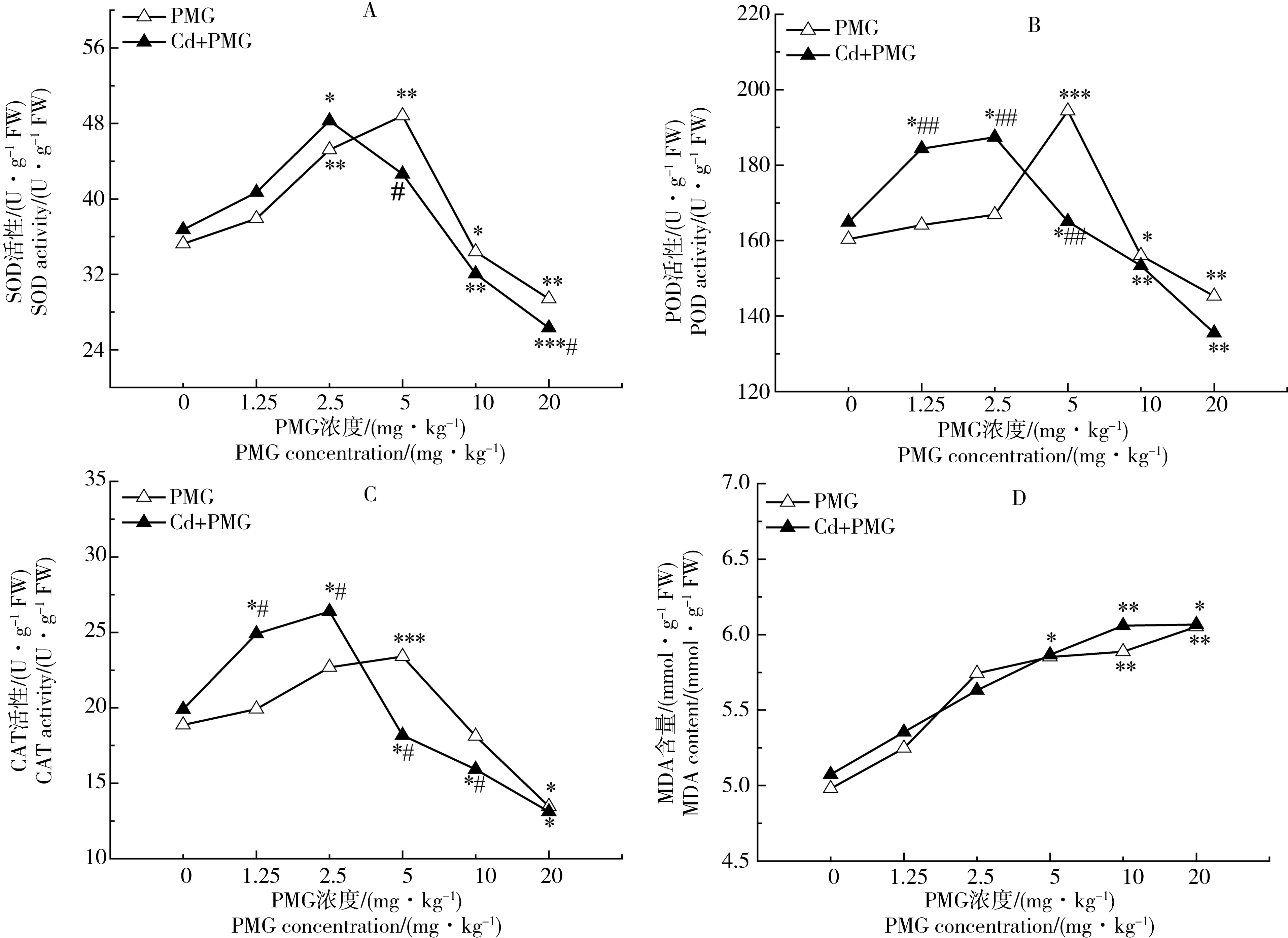
图1 PMG单一和与Cd复合胁迫对玉米幼苗SOD、POD、CAT、MDA的影响注:与各自空白对照相比,* P<0.05,** P<0.01,*** P<0.001;复合胁迫与同浓度PMG单一胁迫相比,# P<0.05,## P<0.01,### P<0.001。下同。Fig. 1 Effects of single PMG, and PMG and Cd combined stress on the activities of SOD, POD, CAT and the content of MDA in maize seedlingsNote: compared with controls, *P<0.05, ** P<0.01, *** P<0.001; compared with single PMG stress with the same concentration, # P<0.05, ## P<0.01, ### P<0.001. The following is the same.
性虽增大但不显著(P>0.05),POD、CAT活性显著增大(P<0.05);PMG浓度为5~20 mg·kg-1时,SOD、POD、CAT活性均显著降低(P<0.05)。与同浓度PMG单一胁迫相比,复合胁迫在PMG浓度为1.25~2.5 mg·kg-1时,复合胁迫SOD活性虽高于单一胁迫但差异并不显著(P>0.05),POD、CAT活性显著高于单一胁迫(P<0.05);PMG浓度为2.5~20 mg·kg-1时,复合胁迫3种酶活性都低于单一胁迫并有不同程度的差异。由图1D可知,2种胁迫MDA含量均随PMG浓度的升高逐渐增多。与其各自的空白对照相比,单一胁迫和复合胁迫分别在PMG浓度为10~20 mg·kg-1、5~20 mg·kg-1时,MDA含量显著上升(P<0.05)。同浓度PMG单一胁迫相比,复合胁迫MDA含量变化均无显著性差异(P>0.05)。
2.2 对玉米幼苗叶绿素含量的影响
单一和复合处理叶绿素a、b及总含量的变化情况详见图2(A、B、C)。由图2可知,与抗氧化酶活性的变化情况基本相同,2种胁迫系列叶绿素a、b及总含量的变化均随PMG浓度的增大呈先升后降的趋势,与各自的空白对照相比,升高均没有显著性差异(P>0.05),下降则呈现程度不同的显著性差异(P<0.05,P<0.01,P<0.001)。单一胁迫系列叶绿素a、b及总含量显著变化的敏感点均为5 mg·kg-1;复合胁迫系列则均为2.5 mg·kg-1;与同浓度PMG单一胁迫相比,复合胁迫在0~2.5 mg·kg-1时,二者叶绿素含量无显著性差异(P>0.05);在PMG浓度为2.5~20 mg·kg-1时,复合胁迫叶绿素含量则显著低于单一胁迫(P<0.05)。
2.3 对玉米叶片OJIP曲线的影响
图3(A、B、C)分别为单一PMG处理、单一Cd处理和PMG与Cd复合处理随着响应时间的延长,其时间对数随荧光强度变化的情况。由图3A可以看出,J~P点,PMG浓度为1.25~5 mg·kg-1处理组荧光值大于空白对照,而PMG浓度为10~20 mg·kg-1的处理组荧光值却明显小于空白对照;图3B结果显示,与空白对照相比,Cd2+处理玉米叶片荧光值无明显变化。图3C的复合处理结果表明,J~P点,与空白对照相比,随PMG浓度增大,低浓度处理(1.25~2.5 mg·kg-1)荧光值升高;而高浓度处理(5~20 mg·kg-1)荧光值降低。
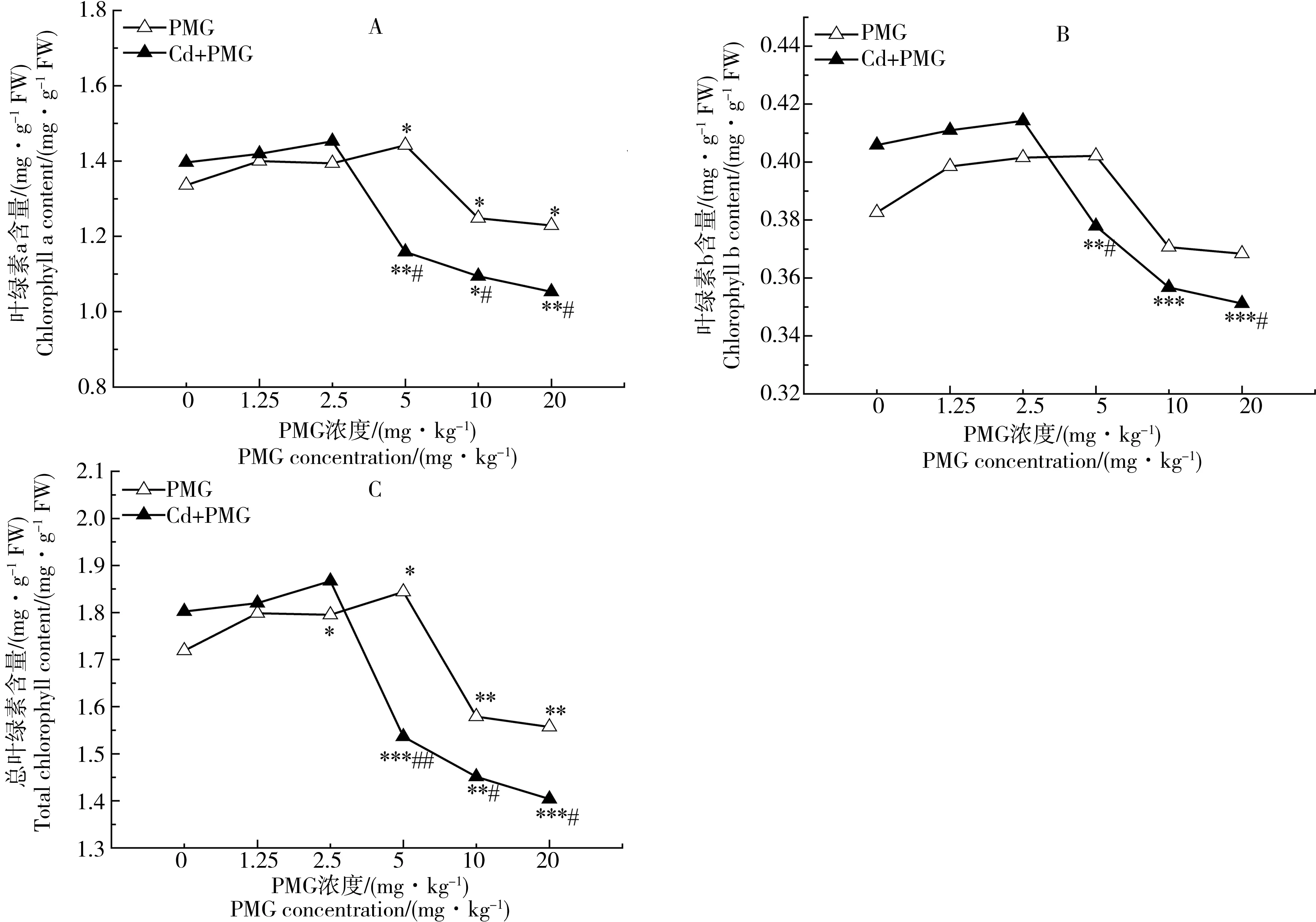
图2 单一PMG和与Cd复合胁迫对玉米幼苗叶绿素含量的影响Fig. 2 Effects of single PMG, and PMG and Cd combined stress on chlorophyll content of maize seedlings
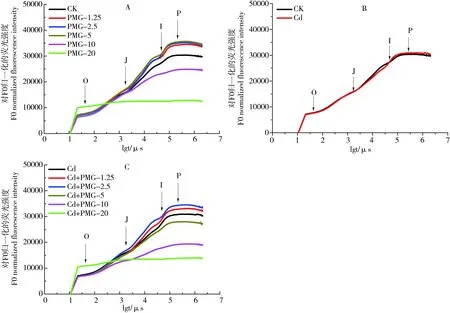
图3 单一PMG和与Cd复合胁迫对玉米叶片快速叶绿素荧光诱导动力学曲线(OJIP)曲线的影响Fig. 3 Effects of single PMG, and PMG and Cd combined stress on rapid chlorophyll fluorescence induction kinetics curve (OJIP) of maize leaves
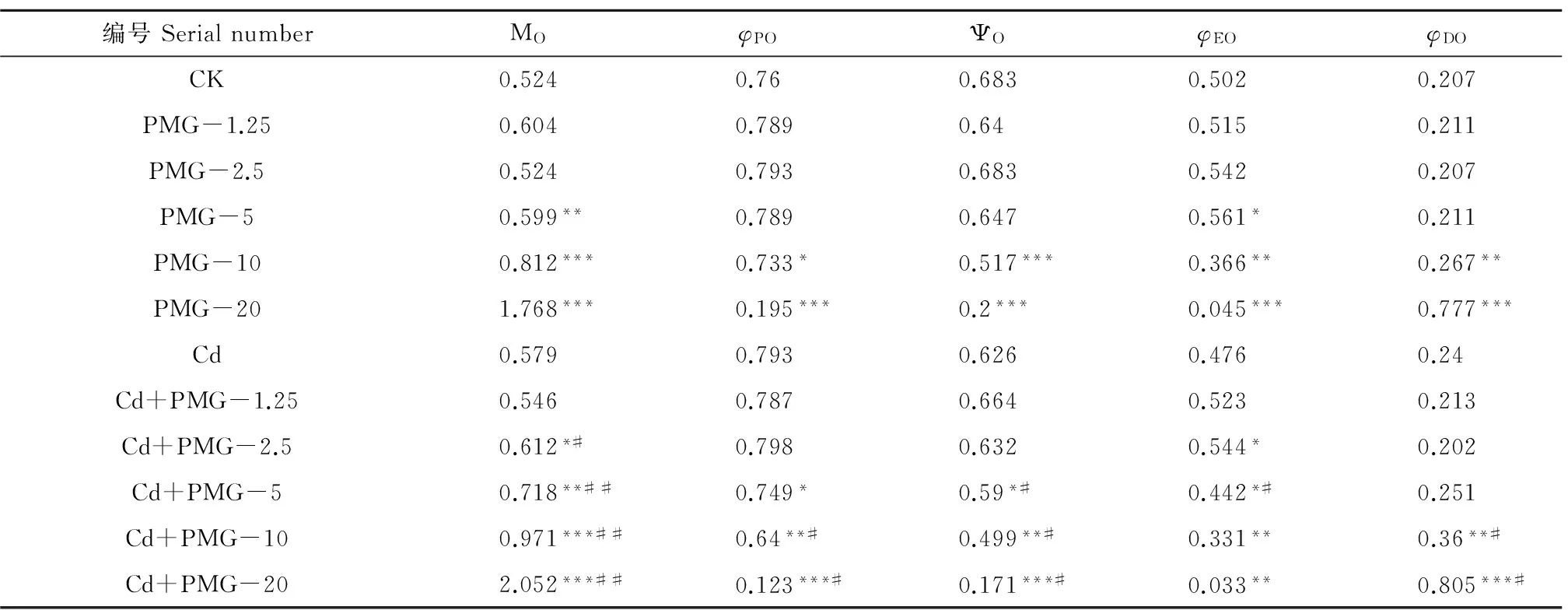
编号SerialnumberMOφPOΨOφEOφDOCK0.5240.760.6830.5020.207PMG-1.250.6040.7890.640.5150.211PMG-2.50.5240.7930.6830.5420.207PMG-50.599**0.7890.6470.561*0.211PMG-100.812***0.733*0.517***0.366**0.267**PMG-201.768***0.195***0.2***0.045***0.777***Cd0.5790.7930.6260.4760.24Cd+PMG-1.250.5460.7870.6640.5230.213Cd+PMG-2.50.612*#0.7980.6320.544*0.202Cd+PMG-50.718**##0.749*0.59*#0.442*#0.251Cd+PMG-100.971***##0.64**#0.499**#0.331**0.36**#Cd+PMG-202.052***##0.123***#0.171***#0.033**0.805***#
注:PMG后的数值为PMG的浓度,如PMG-1.25为1.25 mg·kg-1PMG,其余同;表中Cd浓度均为5 mg·kg-1;与空白比较,* P<0.05,* * P<0.01,*** P<0.001;与同浓度单一PMG处理比较,#P<0.05,## P<0.01,### P <0.001。下同。
Note: The value after PMG represents the concentration of PMG, for example, PMG-1.25 represents that the PMG concentration is 1.25 mg·kg-1. In the table, the Cd concentration was 5 mg·kg-1. Compared with controls, * P<0.05, * * P<0.01, *** P<0.001; compared with single PMG stress with the same concentration, # P<0.05, ## P<0.01, ### P<0.001. The following is the same.
2.4 对玉米叶片能量分配比率的影响
单一和复合处理玉米叶片能量分配比率的变化详见表2。
由表2可知,随着PMG浓度的增大,2种胁迫组中玉米叶片的MO、φDO均不断增大,φPO、ΨO均逐渐降低,φEO均呈先升后降的趋势。与各自空白对照相比,单一和复合胁迫的MO、φPO、ΨO、φEO均分别在PMG浓度为5~20 mg·kg-1、2.5~20 mg·kg-1时差异显著(P<0.01,P<0.05);2种胁迫的φDO均在PMG浓度为10~20 mg·kg-1时差异显著(P<0.01)。与同浓度PMG单一胁迫相比,复合胁迫的MO、φDO分别在PMG浓度为2.5~20 mg·kg-1、10~20 mg·kg-1时显著高于单一胁迫(P<0.05),ΨO、φPO分别在PMG浓度为5~20 mg·kg-1时显著低于单一胁迫(P<0.05),φEO仅在PMG浓度为5 mg·kg-1时显著低于单一胁迫(P<0.05)。
2.5 对玉米叶片PSII反应中心活性参数的影响
单一和复合处理叶片PSII反应中心活性参数的变化详见表3。由表3可知,随着PMG浓度的增大,2种胁迫处理的玉米叶片ABS/RC、TRO/RC、DIO/RC均逐渐增大,ETO/RC和PIABS均逐渐降低。与各自空白对照相比,单一和复合胁迫处理的ABS/RC、TRO/RC、DIO/RC均分别在PMG浓度为10~20 mg·kg-1、5~20 mg·kg-1时差异显著(P<0.05);单一和复合胁迫处理的ETO/RC分别在PMG浓度为10~20 mg·kg-1、5~20 mg·kg-1时差异显著(P<0.01),在最低点与各自空白对照相比分别降低了60.9%、62.7%;单一和复合胁迫处理的PIABS分别在PMG浓度为5~20 mg·kg-1、2.5~20 mg·kg-1时差异显著(P<0.05),在最低点与各自空白对照相比分别降低了99.8%、99.9%。与同浓度PMG单一胁迫相比,复合胁迫处理的ABS/RC、TRO/RC、DIO/RC均在PMG浓度为10~20 mg·kg-1时显著低于单一胁迫(P<0.01,P<0.05,P<0.001),ETO/RC无显著性差异,PIABS在PMG浓度为2.5~10 mg·kg-1时显著低于单一胁迫(P<0.05)。
3 讨论(Discussion)
植物在正常代谢中产生的ROS和其自身的清除能力始终处于平衡状态,而逆境胁迫下,ROS产生和清除之间的平衡被打破,则会引起细胞膜损伤。有研究表明,杉木幼苗喷施PMG后,随PMG浓度的增大,杉木幼苗SOD活性下降,CAT活性上升,POD活性则先升后降,MDA含量上升[19]。本研究结果显示,随PMG浓度的增大,玉米幼苗SOD、CAT、POD活性均先升后降,表明PMG喷施到玉米幼苗表面后,会促进细胞内ROS的增加,同时为抵抗外界胁迫幼苗自身的抗氧化系统防御机制也会发挥作用。PMG浓度较低时,幼苗通过增大SOD活性催化歧化反应,使活性氧生成H2O2和O2,CAT将H2O2分解为H2O和O2,POD催化过多的H2O2降解[20],保护细胞避免或减轻活性氧的伤害;PMG浓度较高时,幼苗机体内ROS积累过多,导致质膜透性增加,抗氧化系统受到不可恢复的损害,使自由基清除系统中SOD、CAT、POD活性下降。此外,复合胁迫由于Cd2+的存在,加大了PMG单独存在时的损害作用,使得玉米幼苗抗氧化酶活性对PMG胁迫的敏感浓度点从单一胁迫的5 mg·kg-1降低到2.5 mg·kg-1。随着PMG浓度的升高,2种胁迫的MDA含量都增加,表明玉米幼苗受到胁迫后,虽会增大抗氧化酶活性抵制外界胁迫,但积累过多的自由基并未完全清除,过多的自由基引起了细胞膜蛋白与膜内脂的变化,改变了细胞膜通透性,导致细胞内膜脂过氧化物不断增多,对植物造成不可恢复的伤害[21]。这与杨涛等[22]研究的乐果对菠菜叶片抗氧化酶活性和MDA含量的影响结果一致,同时也与本试验中喷施低浓度PMG后玉米幼苗生长旺盛,喷施高浓度PMG幼苗叶片发黄,甚至枯萎的生长状况一致。
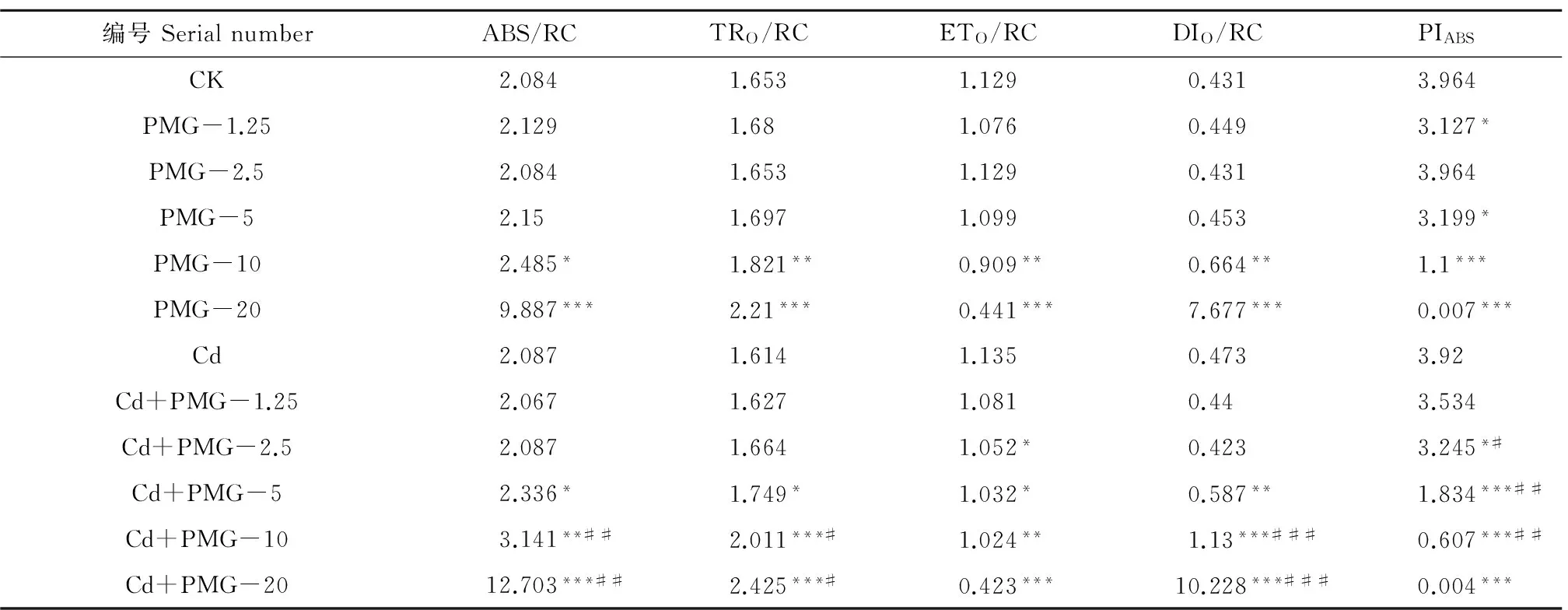
表3 单一PMG和与Cd复合胁迫对玉米叶片叶绿素荧光参数的影响Table 3 Effects of single PMG, and PMG and Cd combined stress on chlorophyll fluorescence parameter of maize leaves
叶绿素是光合作用的物质基础,其含量大小直接影响光合作用的强弱[23]。有研究表明,PMG会改变叶绿体的超微结构[24],影响植物叶片的光合作用[25]。本研究中,PMG浓度较低时,单一胁迫玉米叶片的叶绿素a、b及总含量升高,这是因为低浓度PMG提高了抗氧化酶活性所致。高浓度PMG胁迫时,玉米叶片的叶绿素含量降低,一方面由于高浓度PMG会使植物中叶绿体基粒、类囊体减少,破坏叶绿体结构,导致植物叶片发黄[26];另一方面,高浓度PMG胁迫使得玉米幼苗抗氧化系统紊乱,ROS积累过多,MDA含量升高,而MDA则能交联脂类核酸、糖类及蛋白质,影响构成细胞质膜包括叶绿体片层膜的组分,导致膜结构改变,影响位于片层上的叶绿素含量[27]。单一胁迫与复合胁迫相比,PMG浓度较低时,Cd2+的存在促进了叶绿素的合成,这与何翠坪和王慧忠[28]发现低浓度Cd对草坪植物叶绿素a、b和总含量的合成有刺激作用结果相同,说明土壤5 mg·kg-1的Cd2+会抑制单一PMG胁迫对玉米幼苗叶绿体功能的损害作用,同时可能会促进其光合作用。而PMG浓度较高时,Cd2+与PMG复合使得毒性加强,对叶绿体造成损害,加快叶绿素降解速度。
OJIP曲线能提供PSⅡ的光化学信息,准确地反映光反应中PSⅡ供体侧、受体侧及反应中心的电子氧化还原状态[29]。OJIP曲线可以定量反映光合作用系统在逆境胁迫下玉米叶片荧光产量等所受的影响。本研究结果显示,PMG的存在会影响玉米叶片的荧光产量和PSII中QA、QB和质体醌之间的电子传递[30],低浓度PMG胁迫通过增强抗氧化酶活性保护机体免受外界的侵扰,提高叶绿素含量,同时也对幼苗的荧光产量造成影响,这与玉米幼苗生长过程中低浓度PMG促生长的状况一致;高浓度PMG胁迫使玉米幼苗抗氧化系统紊乱,影响其叶绿素的合成,阻碍QA、QB和质体醌之间的电子传递,抑制玉米幼苗生长。同时也表明PMG对玉米叶片荧光强度的影响与PMG含量呈低浓度促进高浓度抑制有关。同样,复合胁迫中,因Cd2+的诱导作用,加大了PMG单独存在时的损害作用,使得对PMG胁迫的敏感浓度点从单一胁迫的5 mg·kg-1降低到2.5 mg·kg-1。
综上所述,单一和复合胁迫分别在PMG浓度为1.25~5 mg·kg-1、1.25~2.5 mg·kg-1时,由于玉米幼苗本身的调节机制,可增强抗氧化酶活性清除机体积累过多的ROS,提高叶绿素含量合成,加大光合速率,促进玉米幼苗生长;单一和复合胁迫分别在PMG浓度为5~20 mg·kg-1、2.5~20 mg·kg-1时,由于机体积累了过多的MDA,抗氧化系统紊乱,叶绿素含量合成受到阻碍,PSII的功能亦被损害,导致玉米幼苗光合作用受到抑制,阻碍幼苗的生长。此外,Cd2+的存在,加大了PMG单独存在时的损害作用,使得玉米幼苗对PMG胁迫的敏感点从5 mg·kg-1降低到2.5 mg·kg-1。使用PMG除草时,建议在推荐剂量(1.25~2.5 mg·kg-1)范围内合理使用,且要慎重考虑其与重金属离子Cd2+的复合胁迫影响。
参考文献(References):
[1]屠予钦, 袁会珠, 黄宏英, 等. 农药的科学使用问题与农药应用工艺学[J]. 植物保护学报, 1996, 23(3): 275-280
Tu Y Q, Yuan H Z, Huang H Y, et al. Scientific use of pesticides on the basis of pesticide application technology [J]. Journal of Plant Protection, 1996, 23(3): 275-280 (in Chinese)
[2]钟格梅, 唐振柱. 环境镉污染及其对人群健康影响研究进展[J]. 应用预防医学, 2012(5): 317-320
Zhong G M, Tang Z Z. Environmental cadmium pollution and the effect on population health [J]. China Public Health, 2012(5): 317-320 (in Chinese)
[3]Bashri G, Prasad S M. Indole acetic acid modulates changes in growth, chlorophyll a fluorescence and antioxidant potential of Trigonella foenum-graecum L. grown under cadmium stress [J]. Acta Physiologiae Plantarum, 2015, 37(3): 1-14
[4]田平平, 王杰, 秦晓艺, 等. 采后处理对杏鲍菇贮藏品质及抗氧化酶系统的影响[J]. 中国农业科学, 2015, 48(5): 941-951
Tian P P, Wang J, Qin X Y, et al. Effect of postharvest treatment on the storage quality and antioxidant enzyme system of Pleurotus eryngii [J]. Scientia Agricultura Sinica, 2015, 48(5): 941-951 (in Chinese)
[5]Dmirevska-Kepova K, Simova-Stoilova L, Stoyanova R, et a1. Biochemical changes in barley plants after excessive supply of copper and manganese [J]. Environmental & Experimental Botany, 2004, 52(3): 253-266
[6]吴仁海, 孙慧慧, 苏旺苍, 等. 精恶唑禾草灵对粳稻和籼稻生长及保护酶系的影响研究[J]. 华北农学报, 2013, 28(5): 163-168
Wu R H, Sun H H, Su W C, et al. Effect of fenoxaprop-P-ethyl on growth and protective enzyme system of Japonica and Indica rice [J]. Acta Agriculturae Boreali-Sinica, 2013, 28(5): 163-168 (in Chinese)
[7]原向阳, 郭平毅, 张丽光, 等. 第三复叶期喷施草甘膦对转基因大豆和普通大豆生理指标的影响[J]. 中国农业科学, 2008, 41(11): 3886-3892
Yuan X Y, Guo P Y, Zhang L G, et al. Impact of glyphosate on physiological index of transgenic and conventional soybean on three-trifoliolate leaf stage [J]. Scientia Agricultura Sinica, 2008, 41(11): 3886-3892 (in Chinese)
[8]原向阳, 郭平毅, 张丽光, 等. 干旱胁迫下草甘膦对抗草甘膦大豆幼苗保护酶活性及脂质过氧化作用的影响[J]. 中国农业科学, 2010, 43(4): 698-705
Yuan X Y, Guo P Y, Zhang L G, et al. Glyphosate and post-drought rewatering on protective enzyme activities and membrane lipid peroxidation in leaves of glyphosate-resistant soybean seedlings [J]. Scientia Agricultura Sinica, 2010, 43(4): 698-705 (in Chinese)
[9]王米道, 程凤侠, 司友斌. 铜与草甘膦复合污染对小麦种子发芽与根伸长的抑制作用[J]. 生态毒理学报, 2009, 4(4): 591-596
Wang M D, Cheng F X, Si Y B. The inhibition of the combined pollution of copper and glyphosate to the seed germination and root elongation of wheat [J]. Asian Journal of Ecotoxicology, 2009, 4(4): 591-596 (in Chinese)
[10]许昊, 苏锋, 高孝美. 砷和草甘膦复合污染对水稻种子萌发的影响[J]. 湖北农业科学, 2015, 54(22): 5540-5543
Xu H, Su F, Gao X M. Effect of combined pollution of arsenic and glyphosate on rice seed germination [J]. Hubei Agricultural Sciences, 2015, 54(22): 5540-5543 (in Chinese)
[11]陈志凡, 赵烨, 郭廷忠, 等. 污灌条件下重金属在耕作土壤中的积累与形态分布特征——以北京市通州区凤港减河污灌区农用地为例[J]. 地理科学, 2013, 33(8): 1014-1021
Chen Z F, Zhao Y, Guo T Z, et al. The accumulation and morphological distribution of heavy metals in cultivated soil under sewage irrigation—A case study of agricultural land in Fenggang, Tongzhou district, Beijing [J]. Scientia Geographica Sinica, 2013, 33(8): 1014-1021 (in Chinese)
[12]赵丽娟, 解静芳, 张洪, 等. 气相色谱/质谱(GC-MS)结合自动解卷积与鉴定系统(AMDIS)软件分析镉胁迫对玉米幼苗代谢产物的影响[J]. 环境化学, 2015, 34(6): 1227-1230
[13]赵丽娟, 张洪, 解静芳, 等. 土壤残留氯磺隆和镉联合胁迫对菠菜代谢产物的影响[J]. 生态毒理学报, 2016, 11(1): 274-282
Zhao L J, Zhang H, Xie J F, et al. Joint effects of soil residual chlorsulfuron and cadmium on metabolites of Spinacia oleracea L. [J]. Asian Journal of Ecotoxicology, 2016, 11(1): 274-282 (in Chinese)
[14]Jiang L, Ma L, Sui Y, et al. Effect of manure compost on the herbicide prometryne bioavailability to wheat plants [J]. Journal of Hazardous Materials, 2010, 184: 337-344
[15]Zhou Z S, Huang S J, Yang Z M. Biological detection and analysis of mercury toxicity to alfalfa (Medicago sativa) plants [J]. Chemosphere, 2008, 70: 1500-1509
[16]李合生. 植物生理生化试验指导[M]. 北京: 高等教育出版杜, 2000: 164-167
[17]Lu Y L, Liang L, Yang H. Joint ecotoxicology of cadmium and metsulfuron-methyl in wheat (Triticum aestivum) [J]. Environmental Monitoring & Assessment, 2013, 185(4): 2939-2950
[18]Porra R J, Thompson R A, Kriedemann P E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvent verifications of the concentration of chlorophyll standards by atomic absorption spectroscopy [J]. Biochimica et Biophysica Acta, 1989, 975: 384-394
[19]林静雯, 李莹, 罗洁文, 等. 草甘膦对杉木种子萌发及幼苗生长的毒性效应[J]. 江西农业大学学报, 2015, 37(5): 843-848
Lin J W, Li Y, Luo J W, et al. Toxic effect of glyphosate on seed germination and seedling growth of Chinese fir [J]. Acta Agriculturae Universitatis Jiangxiensis: Natural Sciences Edition, 2015, 37(5): 843-848 (in Chinese)
[20]王兴明, 涂俊芳, 李晶, 等. 镉处理对油菜生长和抗氧化酶系统的影响[J]. 应用生态学报, 2006, 17(1): 102-106
Wang X M, Tu J F, Li J, et al. Effects of Cd on rape growth and antioxidant enzyme system [J]. Chinese Journal of Applied Ecology, 2006, 17(1): 102-106 (in Chinese)
[21]葛体达, 隋方功, 白莉萍, 等. 水分胁迫下夏玉米跟叶保护酶活性变化及其对膜脂过氧化作用的影响[J]. 中国农业科学, 2005, 38(5): 922-928
Ge T D, Sui F G, Bai L P, et al. Effects of water stress on the protective enzyme activities and lipid peroxidation in roots and leaves of summer maize [J]. Scientia Agricultura Sinica, 2005, 38(5): 922-928 (in Chinese)
[22]杨涛, 李传勇, 杨惠华, 等. 乐果对菠菜叶片POD、SOD、CAT活性及MDA含量的影响[J]. 亚热带植物科学, 2004, 33(4): 19-21
Yang T, Li C Y, Yang H H, et al. Effects of dimethoate on activities of POD, SOD, CAT and MDA content in spinach leaves [J]. Subtropical Plant Science, 2004, 33(4): 19-21 (in Chinese)
[23]徐国聪, 唐运来, 陈梅, 等. 铀对菠菜叶片光合作用影响的研究[J]. 西北植物学报, 2016, 36(2): 370-376
Xu G C, Tang Y L, Chen M, et al. Effects of uranium on photosynthesis of spinach leaves [J]. Acta Botanica Boreali-Occidentalia Sinica, 2016, 36(2): 370-376 (in Chinese)
[24]卜贵军, 郑小江, 王学东, 等. 草甘膦对大豆叶片超微结构及生化指标的影响[J]. 中国油料作物学报, 2010, 32(2): 285-289
Bu G J, Zheng X J, Wang X D, et al. Glyphosate effects on ultrastructure and biochemical change of soybean leaves [J]. Chinese Journal of Oil Crop Sciences, 2010, 32(2): 285-289 (in Chinese)
[25]Zobiole L H S, Oliveira Jr R S, Visentainer J V, et al. Glyphosate affects seed composition in glyphosate-resistant soybean [J]. Journal of Agricultural & Food Chemistry, 2010, 58(7): 4517-4522
[26]Rivera-Becerril F, Calantzis C, Turnau K, et al. Cadmium accumulation and buffering of cadmium-induced stress by arbuscular mycorrhiza in three Pisum sativum L. genotypes [J]. Journal of Experimental Botany, 2002, 53: 1177-1185
[27]井春喜, 张怀刚, 师生波, 等. 土壤水分胁迫对不同耐旱性春小麦品种叶片色素含量的影响[J]. 西北植物学报, 2003, 23(5): 811-814
Jing X C, Zhang H G, Shi S B, et al. Effects of soil water stress on pigment contents in leaves of different drought-tolerant spring wheat cultivars [J]. Acta Botanica Boreali-Occidentalia Sinica, 2003, 23(5): 811-814 (in Chinese)
[28]何翠坪, 王慧忠. 重金属镉、铅对草坪植物根系代谢和叶绿素水平的影响[J]. 湖北农业科学, 2003(5): 60-63
He C P, Wang H Z. Effect of cadmium and lead on the roots metabolizm and chlorophyll of lawn plant [J]. Hubei Agricultural Sciences, 2003(5): 60-63 (in Chinese)
[29]Deweza D, Geoffroy L, Vernet G, et a1. Determination of photosynthetic and enzymatic biomarkers sensitivity used to evaluate toxic effects of copper and fludioxonil in alga Scenedesmus obliquus [J]. Aquatic Toxicology, 2005, 74: 150-159
[30]Appenroth K J, Stockel J, Srivastava A, et a1. Multipie effects of chromate on the photosynthetic apparatus of Spirodela polyrhiza as probed by OJIP chlorophyll a fluorescence measurements [J]. Environmental Pollution, 2001, 115(1): 49-64
[31]吴敏兰, 王果, 李荭荭, 等. 外源Hg胁迫对3种烟草品种叶绿素含量和光合效应的影响[J]. 生态毒理学报, 2016, 11(6): 282-290
Wu M L, Wang G, Li H H, et al. Influence of exogenous mercury stress on chlorophyll content and photosynthetic effect of three tobacco cultivars [J]. Asian Journal of Ecotoxicology, 2016, 11(6): 282-290 (in Chinese)

