血细胞微粒制备方法的建立及评价
赵睿婷,周菊,詹达强,田野,张建宁,2,袁恒杰,2
(1天津医科大学总医院,天津300052;2天津市神经病学研究所)
微粒是细胞受到刺激活化或凋亡过程中产生的直径为0.1~1.0 μm的囊泡状结构[1]。微粒具有细胞膜结构及一定量的细胞质,会携带来源细胞的特异性表面标志物[2]。1967年Wolf等[3]首次发现血小板来源的微粒,同时证明血小板来源的微粒富含磷脂,具有促进凝血的作用。随后越来越多的研究表明,血液中的血小板、白细胞和红细胞等受到活化或凋亡刺激时均可释放微粒,不同来源微粒参与细胞的黏附、凋亡、免疫应答、血管重塑、血管生成、止血及血栓生成等过程,与机体生理状态的维持及多种疾病的发生发展关系密切[4]。不同血液细胞来源的微粒具有各自特定的功能与作用,微粒的准确测定及不同来源微粒的分离和获取一直是微粒研究中的难点。本研究拟建立血细胞微粒的制备方法并对方法进行评价,为不同来源的血细胞微粒后续的基础功能相关研究提供基础。
1 材料与方法
1.1 设备与试剂 流式细胞仪购自美国BD公司。透射电镜购自日本Hitachi公司。常温离心机购自美国Beckman Coulter公司。超速离心机购自美国Beckman公司。Megamix标准微粒购自法国Biocyte公司。荧光标准品SPHEROTM Accurate Count Ultra Rainbow Fluorescent Particles(直径3.8 μm)购自美国spherotech公司。抗体藻红蛋白(PE)-钙离子依赖性磷酯结合蛋白V(Annexin V)和细胞表面标记物抗体异硫氰酸荧光素(FITC)-血型糖蛋白A(CD235a)、FITC-白细胞共同抗原(CD45)和FITC-血小板糖蛋白(CD42b)购自美国BD公司。红细胞裂解液购自中国碧云天试剂公司。
1.2 血细胞微粒的制备方法
1.2.1 血细胞的提取 ①红细胞的提取:取5 mL枸橼酸钠抗凝处理的新鲜健康人全血4 ℃ 150 g离心20 min,取最下层;以无菌PBS溶液重悬,4 ℃ 150 g离心20 min,取最下层,重复此过程3次,洗涤红细胞,置于-80 ℃冰箱保存,备用。②白细胞的提取:取5 mL枸橼酸钠抗凝处理的新鲜健康人全血,按1 mL全血中加入10 mL红细胞裂解液的比例加入37 ℃预热的红细胞裂解液,涡旋混匀;室温孵育10~15 min,400 g离心5 min;去除上清液,加入10 mL无菌PBS溶液洗涤一次白细胞,如仍有大量红细胞残留,重复以上步骤;将所得白细胞置于-80 ℃冰箱保存备用。③血小板的提取:取5 mL枸橼酸钠抗凝处理的新鲜健康人全血,4 ℃ 150 g离心20 min,取上层富含血小板血浆(PRP);将PRP于4 ℃ 1 500 g离心20 min,沉淀即为血小板,置于-80 ℃冰箱保存备用。
1.2.2 不同血细胞来源微粒的制备 取红细胞、白细胞、血小板于室温融化后,加入1 mL无菌PBS溶液,置于组织匀浆器中充分研磨。于4 ℃ 1 500 g离心20 min,取上清。上清液于4 ℃ 13 000 g离心2 min,取上清。上清液置于超高速离心机中,于4 ℃ 10 0000 g离心1 h,沉淀即为红细胞微粒、白细胞微粒和血小板微粒,用500 μL的无菌PBS溶液重悬。血细胞微粒制备完成后,需用流式细胞仪对微粒的表面标志物及浓度进行测定,以确认微粒是否成功制备。根据流式细胞仪检测结果,依需调整微粒的浓度。
1.3 血细胞微粒形态观察 采用透射电镜观察。将红细胞微粒、白细胞微粒、血小板微粒的重悬液加入到碳膜/Fomvar膜包被的微栅中,室温孵育10 min。用滤纸吸掉多余的液体,加入磷钨酸(pH 6.8)染色5 min以增强膜的可视性。经无水乙醇脱水后,置于烘箱烤干,将制好的标本置于透射电镜下观察。
1.4 血细胞微粒制备方法的评价
1.4.1 流式细胞技术检测方法构建及精密度考察 ①确定不同来源血细胞微粒区域:在流式细胞仪前向散射光(FSC)/侧向散射光(SSC)散点图中,应用Megamix标准微粒(直径分别为0.5、0.9、3 μm)确定不同大小微粒的位置;根据不同大小微粒的位置,圈定直径小于0.9 μm的区域为微粒区域。②血细胞表面标志物检测:向制备的红细胞微粒、白细胞微粒、血小板微粒标本中加入抗体PE-Annexin V(终浓度为50 ng/μL),低速震荡,充分混匀,避光孵育15 min;然后分别向制备的红细胞微粒、白细胞微粒、血小板微粒标本中依次加入抗体FITC-CD235a、FITC-CD45、FITC-CD42b(终浓度均为10 ng/μL),混匀后室温避光孵育30 min,应用流式细胞仪检测;以圈定的微粒区域进入下一个散点图,分析微粒表面磷脂酰丝氨酸和其来源细胞表面标志物表达情况,其中磷脂酰丝氨酸表达以磷脂结合蛋白Annexin V表达来体现;Annexin V的表达以Annexin V+EDTA作为对照管,红细胞标志物CD235a、白细胞标志物CD45、血小板标志物CD42b在红细胞微粒、白细胞微粒、血小板微粒表面的表达分别以CD235a、CD45、CD42b的IgG同型对照管作为对照,以此来确定Annexin V、CD235a、CD45、CD42b阳性表达区域;对双染抗体样本检测前,用对应抗体的单染样本调整流式细胞仪通道间的荧光补偿。③血细胞微粒浓度测定:在一定体积的微粒样本中加入50 μL的荧光标准品(直径3.8 μm),在流式细胞仪上检测。圈定荧光标准品的区域,用上述Megamix标准微粒确定样本微粒区域。本文50 μL荧光标准品(直径3.8 μm)中微粒的数量为50 600个,故样本的血细胞微粒浓度为:(50 600×样本微粒区域的微粒个数)/(荧光标准品区域微粒个数×流式检测所加样本的体积)。④流式细胞仪检测方法精密度考察:日内相对标准偏差(简称日内差):取3份荧光标准品,用流式细胞仪检测荧光标准品的浓度,连续测定5次,每隔4 h用流式细胞仪检测1次,计算日内差。日间相对标准偏差(简称日间差):取3份荧光标准品,用流式细胞仪检测荧光标准品浓度,连续测定5 d,每隔1 d用流式细胞仪检测1次,计算其日间差。
1.4.2 血细胞微粒制备方法的重复性及重现性考察 同一天内,分5次制备5批不同来源的血细胞微粒,每批制备6个样本,用流式细胞仪在一天中连续检测其表面标志物。随机抽选30位实验室工作人员于不同时间按本方法制备血细胞微粒,流式细胞仪观察血细胞表面标志物的表达情况。以血细胞微粒表面标志物表达的变异度来评估该制备方法的重复性与重现性。

2 结果
2.1 血细胞微粒形态 在透射电镜下可以看到,所得红细胞微粒、白细胞微粒、血小板微粒均为直径0.1~1.0 μm的不规则圆形结构,有清晰可见的细胞膜,可看到少许胞质的存在。详见图1。
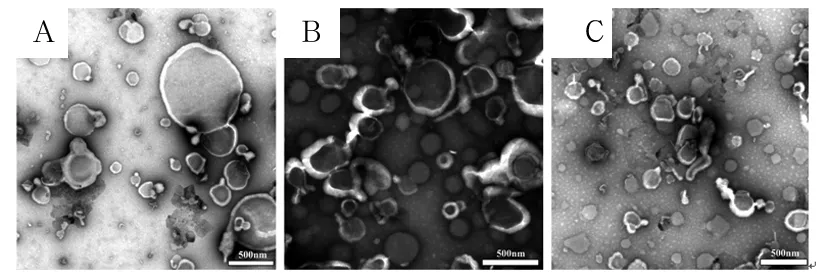
注:A为红细胞微粒;B为白细胞微粒;C为血小板微粒。
图1血液细胞微粒形态
2.2 血细胞微粒表面标志物表达及微粒浓度 流式细胞术检测结果显示,红细胞微粒、白细胞微粒和血小板微粒均具有较强的来源细胞表面标志物表达,表达阳性率均在90%左右。红细胞微粒、白细胞微粒和血小板微粒均部分表达磷脂酰丝氨酸(见图2)。流式细胞仪检测结果显示,红细胞微粒、白细胞微粒、血小板微粒浓度分别为(2.2±0.29)×106个/μL、(1.4±0.21)×106个/μL、(1.8±0.31)×106个/μL,相对标准偏差分别为13.2%、15.0%、17.2%。换算至全血来计算,1 mL全血所制得的红细胞微粒、白细胞微粒和血小板微粒均大于1×108个。

注:A为红细胞微粒;B为白细胞微粒;C为血小板微粒。
图2血细胞微粒表面标志物检测结果
2.3 流式细胞仪检测方法精密度 3个样本数据的平均日内差为4.7%,符合《中国药典》规定的对生物样品检测相对标准偏差应小于15.0%的要求,见表1。3个样本数据的平均日间差为4.9%,符合《中国药典》规定的对生物样品检测相对标准偏差应小于15.0%的要求,见表2。
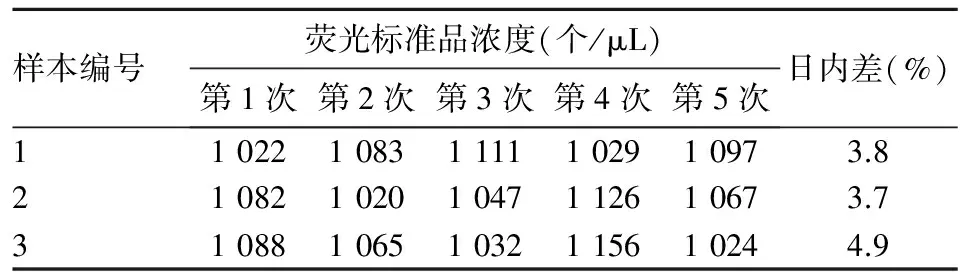
表1 同日内5次流式细胞术测得的血细胞微粒荧光标准品浓度及日内差

表2 5 d内流式细胞术测得的血细胞微粒荧光标准品浓度及日间差
2.4 血细胞微粒制备方法的重复性及重现性 重复性:同一天内,分5次制备5批不同的血细胞微粒,每批制备6个样本,共30个样本,流式细胞术检测结果显示,同日内制备的不同批次血细胞微粒表面标志物阳性表达率差异较小(见表3)。重现性:流式细胞术检测结果显示,不同实验室工作人员于不同时间制备的血细胞微粒表面标志物表达阳性率差异较小(见表4)。
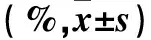
表3 同日内不同批次制备的血细胞微粒表面标志物阳性表达率
3 讨论
虽然细胞微粒起初被认为是细胞代谢废物,但自20世纪90年代末,其生物学功能逐渐受到学者们的重视。细胞微粒带有特异性脂类物质,富含来源细胞蛋白质并可能携带RNA等生物活性物质,在细胞间的信号通讯过程中发挥十分重要的作用[5]。细胞微粒可以参与细胞代谢的调节、免疫反应、炎症反应、血管生成和血栓形成过程,与生理状态的维持及多种疾病的发生发展密切相关[4,6,7]。
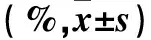
表4 不同实验人员制备于不同时间制备的血细胞微粒表面标志物阳性表达率
血细胞来源微粒包括红细胞微粒、白细胞微粒和血小板微粒。外周血中血小板微粒是血小板活化的标志[8],在生理性和病理性止血过程中起着重要的作用。血小板微粒的生成极大地扩大了血小板的磷脂表面,提供凝血活化因子Ⅴ的主要结合位点,为凝血酶原转变为凝血酶提供了接触反应表面[9]。血小板微粒不仅标志着血小板的活化,其自身也有明显的活化血小板作用。血小板微粒可促进血小板聚集和血栓形成,其数量及表型变化与心绞痛、心肌梗死等多种疾病密切相关[10];同时与血管内皮细胞、白细胞及黏附分子间有着桥联关系,影响人白细胞及血管内皮细胞的功能,参与炎症中的血管损伤过程[11]。研究[12,13]表明,红细胞来源微粒能促使聚集的趋化因子配体Ⅰ与血小板相互作用,进而刺激血小板释放α-糖蛋白碎片,增强炎症反应。白细胞微粒有促炎、促凝和促进血栓生成等多种功能,可与内皮细胞表面的黏附分子相互作用,导致内皮细胞促炎和促凝活性增强[14]。白细胞微粒也可被活化的血小板所捕捉,通过P-选择素/P-选择素糖蛋白配体-1依赖机制,导致组织因子蓄积,促进血栓蔓延。因此,白细胞微粒黏附于血小板成为白细胞微粒参与血栓形成的一个重要机制[15]。虽然大量研究已经证明,血细胞微粒水平及生物学特征变化与多种疾病密切相关,影响疾病的发生、发展和转归,但其作用机制尚不清楚。
本研究采用冻融、研磨的方式产生血细胞微粒,将细胞在-80 ℃条件下冰冻,室温融解,由于细胞内冰粒形成和细胞内液浓度增高、引起溶胀,使细胞结构破碎。而研磨不仅加剧了细胞结构的破碎程度,也可以使破碎的细胞膜随机成囊,形成微粒。随后,在不同的离心条件下梯度除去细胞及较大的碎片;4 ℃ 100 000 g超高速离心,得到血细胞微粒。本方法稳定可靠、简便易行,为后期研究病生理状态下机体微粒生成和变化及微粒功能学与作用机制研究提供了方法学依据。我们利用由0.5、0.9、3 μm组成的混合标准微粒区分微粒大小,将微粒直径小于0.9 μm作为细胞微粒判定标准,并用绝对计数微球计算微粒数量,提高了微粒定量检测结果的准确性。所制备的细胞微粒形态学和表型检测结果显示,该方法制备出微粒具有细胞微粒典型的形态学结构,其来源细胞表面的特异性标志物表达水平较强,部分微粒表达磷脂酰丝氨酸。
迄今为止,细胞微粒的检测方法主要包括流式细胞术检测法[16,17]、电子显微镜检测法[16]、酶联免疫吸附测定法[18]及蛋白印记法[7]等。其中,流式细胞术由于具有分析速度快、可同时对检测对象进行定性及定量分析等特点,已经成为细胞微粒最常用的检测方法。微粒在形成过程中,膜内侧带有负电荷的磷脂酰丝氨酸翻转暴露于膜外[19],且带有来源细胞的表面特异性蛋白[20],故我们选择磷脂酰丝氨酸和其来源细胞表面标志物检测来鉴定血细胞微粒。然而并非所有细胞微粒表面都带有磷脂酰丝氨酸,即不是所有细胞微粒都呈Annexin V阳性,Annexin V阳性仅仅表现为一种血细胞来源微粒的表型特征。本研究中,流式细胞术对荧光标准品的测量结果所得的日内差、日间差均符合《中国药典》对生物样品检测相对标准偏差的要求,表明流式细胞术检测方法有着较高的精密度,适合用于血细胞微粒的检测。
此外,制备方法的重复性和重现性评价结果显示,同日内制备的不同批次血细胞微粒表面标志物阳性表达率差异较小,不同实验室工作人员于不同时间制备的血细胞微粒表面标志物表达阳性率差异也较小,说明本血细胞微粒制备方法的重复性和重现性均较好。本文所采用的血细胞微粒检测方法不仅仅适用于本文所制备的血细胞微粒检测,也可以作为一种通用的细胞微粒检测方法,用于不同组织细胞来源微粒的检测,为相关基础研究提供了便利。
参考文献:
[1] Breen KA, Sanchez K, Kirkman N, et al. Endothelial and platelet microparticles in patients with antiphospholipid antibodies[J]. Thromb Res, 2015,135(2):368-374.
[2] Nomura S, Shimizu M. Clinical significance of procoagulant microparticles[J]. J Intensive Care, 2015,3(1):2.
[3] Wolf P. The nature and significance of platelet products in human plasma[J]. Br J Haematol, 1967,13(3):269-288.
[4] Wu ZH, Ji CL, Li H, et al. Membrane microparticles and diseases[J]. Eur Rev Med Pharmacol Sci, 2013,17(18):2420-2427.
[5] Lynch SF, Ludlam CA. Plasma microparticles and vascular disorders[J]. Br J Haematol, 2007,137(1):36-48.
[6] Mooberry MJ, Key NS. Microparticle analysis in disorders of hemostasis and thrombosis[J]. Cytometry A, 2016,89(2):111-122.
[7] Kriebardis A, Antonelou M, Stamoulis K, et al. Cell-derived microparticles in stored blood products: innocent-bystanders or effective mediators of post-transfusion reactions?[J]. Blood Transfus, 2012,10 (Suppl 2) 25-38.
[8] Ponomareva AA, Nevzorova TA, Mordakhanova ER, et al. Structural Characterization of Platelets and Platelet-Derived Microvesicles [J]. Tsitologiia, 2016,58(2):105-114.
[9] Owens AP 3rd, Mackman N. Microparticles in hemostasis and thrombosis[J]. Circ Res, 2011,108(10):1284-1297.
[10] Jung C, Sorensson P, Saleh N, et al. Circulating endothelial and platelet derived microparticles reflect the size of myocardium at risk in patients with ST-elevation myocardial infarction[J]. Atherosclerosis, 2012,221(1):226-231.
[11] Ogura H, Kawasaki T, Tanaka H, et al. Activated platelets enhance microparticle formation and platelet-leukocyte interaction in severe trauma and sepsis[J]. J Trauma, 2001,50(5):801-809.
[12] Xiong Z, Cavaretta J, Qu L, et al. Red blood cell microparticles show altered inflammatory chemokine binding and release ligand upon interaction with platelets[J]. Transfusion, 2011,51(3):610-621.
[13] Piccin A, Van Schilfgaarde M, Smith O. The importance of studying red blood cells microparticles[J]. Blood Transfus, 2015,13(2):172-173.
[14] Diehl P, Aleker M, Helbing T, et al. Enhanced microparticles in ventricular assist device patients predict platelet, leukocyte and endothelial cell activation[J]. Interact Cardiovasc Thorac Surg, 2010,11(2):133-137.
[15] Falati S, Liu Q, Gross P, et al. Accumulation of tissue factor into developing thrombi in vivo is dependent upon microparticle P-selectin glycoprotein ligand 1 and platelet P-selectin[J]. Interact Cardiovasc Thorac Surg, 2003,197(11):1585-1598.
[16] Tian Y, Salsbery B, Wang M, et al. Brain-derived microparticles induce systemic coagulation in a murine model of traumatic brain injury[J]. Blood, 2015,125(13):2151-2159.
[17] Nantakomol D, Imwong M, Soontarawirat I, et al. The absolute counting of red cell-derived microparticles with red cell bead by flow rate based assay[J]. Cytometry B Clin Cytom, 2009,76(3):191-198.
[18] Baron M, Boulanger CM, Staels B, et al. Cell-derived microparticles in atherosclerosis: biomarkers and targets for pharmacological modulation?[J]. J Cell Mol Med, 2012,16(7):1365-1376.
[19] Burnier L, Fontana P, Kwak BR, et al. Cell-derived microparticles in haemostasis and vascular medicine[J]. Thromb Haemost, 2009,101(3):439-451.
[20] Morel O, Jesel L, Freyssinet JM, et al. Cellular mechanisms underlying the formation of circulating microparticles[J]. Arterioscler Thromb Vasc Biol, 2011,31(1):15-26.

