骨髓增生异常综合征患者骨髓间充质干细胞成骨成脂分化潜能及SDF-1、PD-L1表达观察
庞艳彬,范丽霞,化罗明,薛华,柳嘉,郭慧敏,罗建民,杜欣
(1河北大学附属医院,河北保定071000;2河北医科大学第二医院;3广东省人民医院/广东省医学科学院)
骨髓增生异常综合征(MDS)是一组肿瘤性疾病,其特点是造血功能衰竭并有向急性髓系白血病转化的风险[1,2]。目前研究[3,4]表明,MDS患者造血干细胞、骨髓微环境和免疫功能均存在异常。出生后,造血干细胞主要存在于骨髓,其所在的局部微环境称为造血干细胞龛[5]。间充质干细胞(MSC)是构成造血干细胞龛的关键成分,具有支持骨髓正常造血和维持骨髓免疫稳定的重要作用[6]。敲除小鼠MSC中的sbds基因导致促炎因子S100A8/9分泌增加,最终导致造血细胞中DNA损伤,这可能是MDS疾病进展的潜在机制[4]。基质细胞衍生因子1(SDF-1)不仅可诱导造血干细胞归巢、降低细胞对化疗药物的敏感性,还具有维持免疫突触稳定的作用[7]。程序性细胞死亡因子配体1(PD-L1)是抑制性免疫分子,广泛表达在抗原提呈细胞上,与T细胞上的配体结合后传递抑制信号,通过多种途径抑制T细胞的增殖、活化和效应功能[8]。本研究观察了MDS患者骨髓MSC的多向分化潜能及SDF-1、PD-L1的表达变化,现报告如下。
1 材料与方法
1.1 临床资料 新诊断且未经治疗的MDS患者30例(病例组),男19例、女11例,年龄34~80岁、中位年龄57岁。根据2008年WHO中MDS的分类标准,难治性血细胞减少伴有多系病态造血(RCMD)10例,环形铁粒幼细胞性难治性贫血(RARS)2例,难治性血细胞减少伴有原始细胞增多(RAEB)9例,慢性粒单核细胞白血病(CMML)3例,不能分类的MDS(MDS-U)4例,MDS继发白血病2例。根据IPSS积分将病例组进一步分为低危亚组(IPSS积分判定为低危和中危-Ⅰ)18例和高危亚组(IPSS积分判定为中危-Ⅱ和高危)12例。选择与病例组性别、年龄相匹配的非恶性血液病患者纳入对照组,男9例、女11例,年龄32~73岁、中位年龄55岁。取两组新鲜骨髓标本用于后续实验。
1.2 骨髓MSC的分离、培养及多向分化能力鉴定 将两组新鲜骨髓标本离心获得骨髓单个核细胞,将其种植在25 cm2的培养瓶,放置在37 ℃、5% CO2饱和湿度的培养箱内培养。72 h后更换培养基并去除非贴壁细胞。每周换液2次,当细胞达到70%~80%融合度后,应用0.25%胰酶消化、1∶3传代,收获第2~4代的MSC。参考文献[8]方法检测第3代MSC中的CD34、CD45、CD73、CD90、CD109、CD166进行免疫表型鉴定。对第2代的MSC分化能力进行鉴定。成骨细胞分化鉴定:将MSC以2×104/cm2的密度接种在6孔板中,在人MSC成骨分化培养基中培养,14 d后细胞固定,茜素红染色、照相,在适当的诱导条件下,MSC产生的钙结节通过茜素红染色呈现为红色结节。成脂细胞分化鉴定:将MSC细胞以2×104/cm2密度接种于6孔板中,在MSC成脂诱导分化培养基中培养,培养14 d后细胞固定,油红染色,照相,MSC在适当的诱导条件下能够分化产生脂肪滴,油红染色显示为红色结节。
1.3 MSC中SDF-1、PD-L1基因检测 收集第3代MSC,加入1 mL的TRIzol提取总RNA,取3 μg RNA逆转录成cDNA,以此为模板进行PCR扩增。反应条件:预变性95 ℃ 30 s;PCR反应95 ℃ 5 s,60 ℃ 34 s,共40循环;熔解曲线95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,并在81 ℃各设一次读板检测荧光。扩增完成后,再进行熔解曲线分析,以0.17 ℃/s变化速度从55 ℃到95 ℃每隔2 s记录一次荧光值,可获得熔解曲线。为了减少各实验组间的差异,每一标本均设3组平行孔。SDF-1上游引物序列为5′-GCGCCATGAACGCCAAGGTCGTG-3′,下游引物序列为5′-CAATGCACACTTGTCTGTTGTTG-3′;PD-L1上游引物序列为5′-GGTGCCGACTACAAGCGAAT-3′,下游引物序列为5′-TGACTGGATCCACAACCAAAATT-3′;内参β-actin上游引物序列为5′-ATGAGACACACCTAAGGACC-3′,下游引物序列为5′-TATGGAGAAGATTTGGCACC-3′。目的基因的相对数值以2-ΔΔCt表示。

2 结果
2.1 两组MSC的形态、表型及多向分化潜能 所有对照组来源的MSC均能在体外实现生长,而30例MDS中只有20例患者的MSC实现体外生长。虽然两组MSC均表现出纤维梭性外观,但病例组MSC体积较大,多呈现扁平状外观(图1)。两组MSC具有相似的免疫表型,均表达MSC标记CD73、CD166、CD105和CD90(>95%),不表达可检测到水平的CD34、CD45(<2%)。茜素红和油红染色结果证实两组MSC在体外适当诱导分化条件下可以分别向成骨细胞和成脂细胞分化(图2),但病例组MSC的成骨细胞分化潜能弱于对照组MSC。
2.2 两组MSC中SDF-1、PD-L1表达比较 病例组、对照组MSC中SDF-1的 Ct值分别为6.14±1.37、7.25±1.23,PD-L1的 Ct值分别为11.66±0.95、13.27±0.92,表示病例组MSC中SDF-1、PD-L1的表达水平均高于对照组(P均<0.05)。病例组中,低危亚组、高危亚组MSC中SDF-1的 Ct值分别为5.77±1.30、6.88±1.20,两亚组相比,P>0.05;高危亚组、低危亚组MSC中PD-L1的 Ct值分别为11.15±0.99、12.23±0.64,说明高危亚组的MSC中PD-L1的表达水平高于低危亚组(P<0.05)。
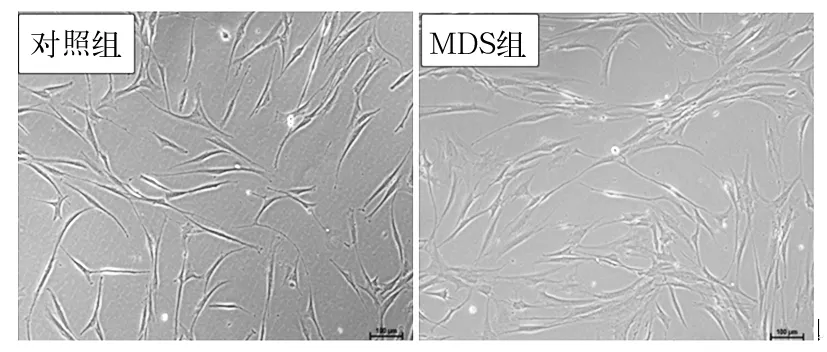
图1 两组MSC的形态

注:上图为成脂分化实验结果;下图为成骨分化实验结果,病例组MSC分化产生的红色结节明显少于对照组。
图2两组MSC的分化能力鉴定结果
3 讨论
MSC具有支持正常造血和维持骨髓免疫稳定的作用,是构成骨髓微环境的关键成分[7]。有学者[9]敲除小鼠MSC中编码核酸内切酶Ⅲ的Dicer1基因导致骨髓出现MDS样造血,此后MSC的变化在MDS疾病进展中的作用日益受到重视。但目前对MDS患者MSC的免疫调节功能知之甚少。因此,本研究对参与免疫调控的SDF-1、PD-L1表达情况进行了初步分析。
首先,本研究发现病例组来源的MSC与正常MSC具有相似的免疫表型和多向分化潜能,但与正常MSC相比,病例组MSC除细胞形态发生改变以外,成骨细胞分化潜能明显下降,这与Geyh等[10]的结果类似。但也有研究认为MDS患者MSC的成骨细胞分化潜能并未下降[11]。造成这种差异的原因可能是后者只使用了茜素红化学染色定性分析MSC成骨细胞分化特点,不能充分反映细胞分化潜能间的数量差异。MDS患者MSC成骨细胞分化潜能下降可能具有重要的意义。动物实验证实,即使具有相似的形态和免疫表型,但是成骨分化潜能下降的MSC不能在小鼠肾被膜下经历软骨内成骨过渡阶段后形成适合造血干细胞生存的骨髓微环境[12]。
本研究还发现MDS患者MSC中SDF-1和PD-L1表达明显升高,与Roversi等[13]的研究结果相似。骨髓活检结果显示MDS患者的MSC中CXCL-12的密度明显高于良性血细胞减少患者。MSC密度增高的MDS患者总生存期明显下降,死亡风险是低、中等MSC密度患者的3.4倍,进展为急性髓系白血病的风险为低、中等MSC密度患者的2倍[14],但相关机制并不明确。SDF-1具有趋化作用,参与造血细胞的迁移、活化、归巢。此外,SDF-1与受体结合后通过激活细胞内GTP酶的方式激活整合素,参与免疫突触的形成,并维持抗原提呈细胞和T细胞黏附性接触,维持免疫突触的稳定,为TCR信号持续发挥作用提供了前提条件[7]。PD-L1广泛表达在抗原提呈细胞上[15]。PD-L1与T细胞上的同源受体PD-1结合后使PD-1胞质内ITIM和ITSM模序被酪氨酸激酶家族和SHP磷酸化,磷酸化后的ITIM和ITSM进一步招募磷酸化的酪氨酸残基。SHP可进一步使PI3K/Akt或RAS/MEK/ERK信号通路失活,导致细胞周期停滞;使ZAP70和PKC-θ去磷酸化从而抑制T细胞活化;PD-L1与T细胞上的PD-1结合后,可使初始T细胞转化为免疫抑制性的调节性T细胞[8]。本研究发现,病例组MSC中SDF-1和PD-L1表达水平高于对照组,且与低危亚组相比,高危亚组MSC中PD-L1表达增高,提示SDF-1、PD-L1可能促进了MDS疾病进展。SDF-1通过趋化作用使进入骨髓的免疫细胞黏附在MSC周围,与MSC上的其他免疫分子形成稳定的免疫突触,MSC通过细胞表面的PD-L1抑制T细胞的增殖、活化,或诱导活化的T细胞分化形成调节性T细胞,从而使MDS肿瘤细胞周围不能产生足够数量或具有抗肿瘤效应的细胞毒性T细胞[16]。与Wang等[17]的研究结果相似,高危MDC患者的MSC更易形成免疫抑制性的微环境。因此,通过干预MDS患者MSC免疫抑制微环境对肿瘤细胞的保护作用可能是进一步提高MDS治疗效果的一种新方式。
总之,本研究证明MDS来源的MSC成骨细胞分化潜能减弱,SDF-1和PD-L1表达增高,且高危患者变化更为明显;SDF-1和PD-L1可能在MDS疾病进展过程中发挥了重要作用。
参考文献:
[1] Medyouf H. The microenvironment in human myeloid malignancies: emerging concepts and therapeutic implications[J]. Blood, 2017,129(12):1617-1626.
[2] 杨力,姜胜华,胡彩华,等.骨髓增生异常综合征的免疫表型和SURVIVIN、P15INK4B、TRF1基因表达[J].山东医药,2011,51(33):1-3.
[3] Pleyer L, Valent P, Greil R. Mesenchymal stem and progenitor cells in normal and dysplastic hematopoiesis-masters of survival and clonality[J]. Int J Mol Sci, 2016,17(7).pii: E1009.
[4] Zambetti NA, Ping Z, Chen S, et al. Mesenchymal inflammation drives genotoxic stress in hematopoietic stem cells and predicts disease evolution in human pre-leukemia[J]. Cell Stem Cell, 2016,19(5):613-627.
[5] Crane GM, Jeffery E, Morrison SJ. Adult haematopoietic stem cell niches[J]. Nat Rev Immunol, 2017,17(9):573-590.
[6] Caplan AI. The new MSC: MSCs as pericytes are sentinels and gatekeepers[J]. J Orthop Res, 2017,35(6):1151-1159.
[7] Cascio G, Martín-Cofreces NB, Rodríguez-Frade JM, et al. CXCL12 Regulates through JAK1 and JAK2 Formation of Productive Immunological Synapses[J]. J Immunol, 2015,194(11): 5509-5519.
[8] Ok CY, Young KH. Checkpoint inhibitors in hematological malignancies[J]. J Hematol Oncol, 2017,10(1):103.
[9] 庞艳彬,范丽霞,罗建民,等.骨髓间充质干细胞在骨髓增生异常综合征中的研究进展[J].基础医学与临床,2018,38(2):255-259.
[10] Geyh S, Oz S, Cadeddu RP, et al. Insufficient stromal support in MDS results from molecular and functional deficits of mesenchymal stromal cells[J]. Leukemia, 2013,27(9):1841-1851.
[11] Klaus M, Stavroulaki E, Kastrinaki MC, et al. Reserves, functional, immunoregulatory, and cytogenetic properties of bone marrow mesenchymal stem cells in patients with myelodysplastic syndromes[J]. Stem Cells Dev, 2010,19(7):1043-1054.
[12] Reinisch A, Etchart N, Thomas D, et al. Epigenetic and in vivo comparison of diverse MSC sources reveals an endochondral signature for human hematopoietic niche formation[J]. Blood, 2015,125(2):249-260.
[13] Roversi FM, Lopes MR, Machado-Neto JA, et al. Serine protease inhibitor kunitz-type 2 is downregulated in myelodysplastic syndromes and modulates cell-cell adhesion[J]. Stem Cells Dev, 2014,23(10):1109-1120.
[14] Johnson RC, Kurzer JH, Greenberg PL, et al. Mesenchymal stromal cell density is increased in higher grade myelodysplastic syndromes and independently predicts survival[J]. Am J Clin Pathol, 2014,142(6):795-802.
[15] Rosenblatt J, Avigan D. ITargeting the PD-1/PD-L1 axis in multiple myeloma: a dream or a reality[J]. Blood, 2017,129(3):275-279.
[16] 庞艳彬,薛华,杜欣.间充质干细胞在骨髓增生异常综合征发生发展中的作用[J].中国肿瘤生物治疗,2017,24(9):1032-1036.
[17] Wang Z, Tang X, Xu W, et al. The different immunoregulatory functions on dendritic cells between mesenchymal stem cells derived from bone marrow of patients with low-risk or high-risk myelodysplastic syndromes[J]. PLoS One, 2013,8(3):e57470.

