BMP-2对间充质干细胞促进造血干细胞增殖的影响及其机制
李书坛,黄远琼,汪姝玥,林凡莉,黄纯兰,3
(1西南医科大学附属医院,四川沪州646000;2泸州市中医医院;3成都市第三人民医院)
骨髓中的造血干细胞(HSC)具有自我更新和分化为各种成熟血细胞的能力,但其数量少。随着干细胞移植(HSCT)技术的飞速发展,对HSC的需求增加,使得体外扩增HSC成为当前研究的热点。HSC增殖、分化和归巢受骨髓微环境即微龛“Niche”的调控。Niche由基质细胞、其前体间充质干细胞(MSC)以及它们表达和分泌的黏附分子、细胞因子和细胞外基质组成,包括以成骨细胞为主体的骨内膜龛和以内皮细胞为主体的血管微龛。研究显示,MSC可促进HSC增殖[1~3],但作用机制复杂、尚未阐明。骨形态发生蛋白(BMP)/TGF-β家族在造血调控过程中发挥重要作用,该家族成员形成复杂的信号网络,调控HSC增殖[4,5]。BMP-2是该家族中的一员,作为一种多功能蛋白,其能促进新骨及血管的形成。近年来研究显示,BMP-2协同MSC可以促进血管生成[6]。2014年7月~2016年3月我们进行本研究,旨在从成血管角度探讨BMP-2协同MSC对HSC增殖的影响及可能的机制。
1 材料与方法
1.1材料LG-DMEM培养基、FBS、青霉素、链霉素、0.25%胰蛋白酶(Hyclone公司,美国),鼠抗人ECD-CD34、鼠抗人PEcy7-CD45、鼠抗人FITC-CD105、鼠抗人IgG抗体(Pharmingen公司,美国),重组人干细胞因子(rhSCF)、重组人白介素3(rhIL-3)、rhBMP-2(RD公司,美国);Mini MACS免疫磁性吸附柱分离装置和CD34+细胞选择试剂盒(Mitenyi Biotec公司,德国),反转录试剂盒(TOYOBO公司,日本),荧光PCR试剂盒(QIAGEN公司,德国),TRIzol试剂盒(Invitrogen 公司,美国),Transwell小室(微网孔径0.4 μm,Costar公司,美国)。β-actin、Ki67、血管生成素受体2(Tie2)、血管内皮生长因子(VEGF)、血管生成素1(Ang1)引物,均由上海生工生物工程股份有限公司合成。骨髓来自西南医科大学附属医院健康志愿者,其中男9例、女4例,年龄21~47(32.72±2.01)岁。本研究经西南医科大学附属医院伦理委员会批准,健康志愿者知情同意并签字。
1.2MSC扩增和鉴定取健康志愿者髂骨骨髓,肝素抗凝管收集,按1∶4体积与完全培养基重置(完全培养基成分为89% LD-DMEM +10% FBS+1%青/链霉素),混合后接种于25 cm2塑料培养瓶中,于37 ℃、5% CO2孵箱中培养。每3天换液一次,待细胞融合达80%后用0.25%胰蛋白酶消化传代,传至第3代备用。倒置相差显微镜观察MSC形态及贴壁、融合等生长情况。显微镜下显示,全骨髓法原代培养MSC 72 h可见散在的梭形贴壁细胞;第14天时梭形细胞融合度可达80%,排列成放射状、旋涡状;第3代MSC在培养6天时融合度可达80%。原代培养细胞生长周期偏长,传代细胞增殖较快且背景干净。采用流式细胞仪检测第3代MSC表面抗原CD34、CD45、CD105表达。结果显示, CD34、CD45、CD105阳性表达率分别为2.2%、0.3%、52.4%。提示MSC分离培养成功。流式细胞仪检测MSC的纯度为52.4%。
1.3HSC分选及纯度鉴定取健康志愿者髂骨骨髓,经预冷的PBS稀释后轻缓地加入Ficoll分离液上层,4 ℃下2 000 r/min离心20 min,收集白色细胞层,分选出单个核细胞,采用Mini MACS免疫磁性吸附柱分离装置,用CD34+细胞(即HSC)选择试剂盒进行CD34+细胞分离,并用抗CD34-ECD抗体检测分选细胞的纯度。台盼蓝染色显示HSC呈大小均匀的圆形,活性大于95%;流式细胞仪检测显示,HSC纯度为81.9%。
1.4MSC对HSC增殖的影响将细胞分组,HSC组为HSC单独培养,HSC+MSC组为HSC、MSC共培养;每组3个复孔。将融合达80%的第3代MSC接种于Transwell下室,CD34+HSC细胞接种于上室,前者接种细胞量为3.20×105个/孔,后者接种细胞量为1.25×104个/孔,培养基为含10% FBS、100 U/mL青霉素及0.1 mg/mL链霉素的IMDM完全培养基,每2天每孔添加rhSCF 50 ng/mL、rhIL-3 20 ng/mL,并换液。分别于培养第3、7、10天收集HSC并用计数板计数,确定HSC增殖最快的时间点。结果显示,HSC增殖最快的时间点为共培养第7天。
1.5BMP-2对MSC促HSC增殖的影响将细胞分为六组,分别为HSC组、MSC组、HSC+BMP-2组、MSC+BMP-2组、HSC+MSC组、HSC+MSC+BMP-2组。HSC组、 MSC组单细胞培养,MSC+BMP-2组、HSC+MSC组分别加入100 ng/mL BMP-2培养,HSC+MSC组两种细胞共培养,HSC+MSC+BMP-2组两种细胞与100 ng/mL BMP-2共培养;细胞接种密度、培养条件同1.4。于培养第3、5天时更换培养基并添加细胞因子rhBMP-2,培养第7天时行以下指标检测。
1.5.1HSC计数采用加样枪分别吸取10 μL各组细胞悬液放入细胞计数板。显微镜下计数四角大方格内的细胞总数,压线细胞只计左侧和下方。计算公式:细胞数/mL=四角大方格内的细胞总数/4×104。
1.5.2增殖因子Ki67及促血管形成相关因子Tie2、VEGF、Ang1 mRNA表达采用实时荧光定量PCR法检测。收集各组细胞,采用TRIzol法提取RNA,用分光光度计检测RNA浓度、A260/A280。将RNA稀释,采用模板量取1 ng,经逆转录酶转录成cDNA。以cDNA为扩增模板,采用荧光定量qRT-PCR法检测各组CD34+细胞的Ki67、Tie2、VEGF、Ang1 mRNA。每组接种3个复孔,计算Ct值。采用2-ΔΔCt法计算上述因子mRNA相对表达量。Ki67、Tie2、VEGF、Ang1基因及内参基因β-actin的引物序列见表1。

表1 Ki67、Tie2、VEGF、Ang1及β-actin的引物序列
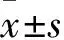
2 结果
2.1各组HSC数量比较HSC组、HSC+BMP-2组、HSC+MSC组、HSC+MSC+BMP-2组HSC数量分别为(15.37±0.42)、(37.81±1.07)、(117.00±2.53)、(129.06±5.13)×104个,组间比较P<0.05或<0.01。
2.2各组Ki67及Tie2、VEGF、Ang1 mRNA表达比较HSC组、HSC+BMP-2组、HSC+MSC组、HSC+MSC+BMP-2组Ki67及Tie2 mRNA相对表达量逐渐升高,MSC组、MSC+BMP-2组、HSC+MSC组、HSC+MSC+BMP-2组VEGF、Ang1 mRNA相对表达量逐渐升高,组间比较P<0.05或<0.01。见表2。
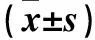
表2 各组Ki67及Tie2、VEGF、Ang1 mRNA相对表达量比较
注:“-”表示本组细胞未进行对应基因mRNA检测。
3 讨论
CD34是HSC表面重要的抗原,在临床及科研工作中常用该抗原分选HSC。目前MSC的培养方法主要包括全骨髓黏附培养法、密度梯度离心法、免疫表型分选法等,全骨髓法因其经济适用、所培养的细胞活性高,通过传代可达到扩增纯化的目的,是目前培养MSC的重要方法。本研究应用免疫磁珠法及全骨髓法获得的HSC和MSC的纯度分别为81.9%、52.4%,纯度较高,能保证后续实验研究的进行。HSC作为机体重要的干细胞,研究其增殖、凋亡等生理活动有利于探索造血以及肿瘤等疾病的发生机制。随着干细胞移植技术的发展,HSC已成为治疗血液系统恶性疾病、一些遗传性和免疫性疾病以及部分恶性实体肿瘤的有效途径之一。然而HSC数量少,体外扩增HSC势在必行。研究发现,如前所述MSC可促进HSC增殖,这种扩增效应依赖于细胞间的相互作用和分泌的细胞因子[7,8],de Silva等[8]将HSC与MSC分别进行非接触共培养、接触共培养、单独培养,结果显示在接触与非接触两种情况下MSC均可以促进HSC增殖,且MSC与HSC接触培养对HSC的增殖促进作用最强。本研究应用Transwell将MSC与HSC进行非接触共培养,结果发现MSC可以非接触促进HSC增殖。
研究发现,MSC能分泌干细胞因子(SCF)、IL、集落刺激因子(GSF)、基质细胞衍生因子1(SDF-1)、基质金属蛋白酶组织抑制剂3(TIMP-3)等多种细胞因子、黏附分子,它们形成复杂的信号网络可促进HSC增殖[7,9]。目前研究显示,这些信号通路主要包括CXCLl2/CXCR4、Notch、Wnt、Tie2/Angl、BMP/TGF-β、Hedgehog[2,9,10]。其中,BMP/TGF-β家族调节多种细胞的增殖、凋亡、分化等生理活动。该家族包括TGF-β和BMP两个亚家族,前者由TGF-β、Activin和Nodal等组成,后者由BMP、GDF和AMH 组成。现发现的20多种BMP蛋白分布于多种组织,目前研究较多的主要为BMP-2、BMP-4、BMP-7、BMP-10等,其受体BMPR包括BMPR-IA,BMPR-IB和BMPR-Ⅱ,它们属于丝氨酸/苏氨酸激酶家族。BMP-2可以与HSC的BMPRI结合并促进其下游转录子Smad-1、Smad-4、Smad-5表达进而调控HSC[11]。BMP蛋白是多功能蛋白,大多能促进骨重建及生长,是胚胎和器官发育的重要因子,在胚胎期能调控造血[3,12,13],其在成体中的造血调控作用目前研究较少。BMP对造血的调控机制复杂,不同的BMP具有不同的作用,如BMP-4抑制HSC向红系分化,BMP-6抑制人B淋巴细胞形成,即使是同种BMP对HSC的同种生理功能也可能不同[14]。目前研究认为这可能与靶细胞的分化程度[12]、细胞因子亚型及浓度、甚至生长因子来源于旁分泌还是自分泌等有关[15]。BMP-2对HSC增殖的影响与培养模式、BMP-2浓度以及所联合的细胞因子种类等具体环境相关。Bhatia等[16]发现,BMP-2可引起NOD/SCID小鼠HSC数目、集落形成、细胞表型和多系分化能力的改变,且影响程度与剂量有关;高浓度(50 ng/mL)BMP-2会抑制细胞增殖,低浓度(5 ng/mL)BMP-2则对HSC增殖影响较小。将BMP-2与不同的细胞因子联合培养HSC,发现SCF联合GM-CSF能促进HSC增殖[17],而BMP-2与EPO和IL-3[17]、SCF和SF3[18]、SCF和SF3以及TPO[19]联合则无协同促进作用。 本研究结果显示,浓度为100 ng/mL的BMP-2联合IL-3、SCF可促进成人HSC增殖,且BMP-2协同MSC亦能促进HSC增殖。然而,BMP-2对造血的哪个阶段进行调节,HSC增殖的具体机制以及增殖后的HSC是否分化目前尚不清楚,有待进一步研究。
增殖指数Ki67基因与细胞增殖相关,能反映细胞增殖的活跃程度,其核蛋白在细胞G1、S、G2和M期均有表达,G0期则不表达。Ki67阳性率越高,说明细胞增殖越活跃。血管生成受多种信号通路的调节,其中最重要的是VEGF/血管内皮生长因子受体(VEGFR)通路。VEGF包括VEGF-A、-B、-C、-D、-E和胎盘生长因子,其中VEGF-A和VEGF-B与血管生成相关[20,21]。VEGF具有高度特异性,通过刺激内皮细胞增殖促进血管生成[21]。VEGFR属于酪氨酸激酶受体超家族(RTK),由跨膜区、七个免疫球蛋白样结构域组成的胞外区和酪氨酸激酶胞内区三部分组成[22],与血管形成相关的主要有VEGFR-1、VEGFR-2、VEGFR-3,在内皮细胞均有表达。Ang/Tie2通路在血管形成中发挥重要作用。Ang主要包括Ang1和Ang2,它们共同的受体为Tie2。Ang1在正常组织中表达广泛,参与血管新生及血管成熟[23]。Ang1启动Tie2受体后使内皮周围平滑肌细胞和血管周细胞募集至血管内皮细胞周围,通过增加内皮细胞与周围支持细胞之间的相互作用,维持血管的完整性与稳定性,并降低其通透性。Ang2是Ang1的天然拮抗剂,主要分布于子宫、卵巢和胎盘等部位。Tie2是RTK家族成员,在内皮细胞及某些造血祖细胞中特异性表达[24]。相比于成骨Niche,血管Niche能促进HSC增殖、分化[25]。研究发现,BMP可促进成骨细胞及BMP介导的MSC向成骨细胞分化时VEGF及Ang1表达[26]。本研究发现,HSC组、HSC+BMP-2组、HSC+MSC组、HSC+MSC+BMP-2组Ki67及Tie2 mRNA相对表达量逐渐升高,MSC组、MSC+BMP-2组、HSC+MSC组、HSC+MSC+BMP-2组VEGF、Ang1 mRNA相对表达量逐渐升高,说明BMP-2及BMP-2协同MSC均可通过促进血管形成而促进HSC增殖。
综上所述,BMP-2协同MSC可促进HSC增殖,其机制可能与促血管形成相关因子VEGF、Ang1和Tie2表达增加相关。
参考文献:
[1] Raynaud CM, Butler JM, Halabi NM, et al. Endothelial cells provide a niche for placental hematopoietic stem/progenitor cell expansion through broad transcriptomic modification[J]. Stem Cell Res, 2013,11(3):1074-1090.
[2] 朱小凤,黄纯兰,李晓明.骨髓间充质干细胞联合外源性Shh蛋白对骨髓造血干细胞增殖影响[J].山东医药,2017,57(37):31-33.
[3] Bai H, Xie YL, Gao YX, et al. The balance of positive and negative effects of TGF-β signaling regulates the development of hematopoietic and endothelial progenitors in human pluripotent stem cells[J]. Stem Cells Dev, 2013,22(20):2765-2776.
[4] Robin C, Durand C. The roles of BMP and IL-3 signaling pathways in the control of hematopoietic stem cells in the mouse embryo[J]. Int J Dev Biol, 2010,54(6):1189-2000.
[5] Francois S, Eder VV, Belmokhtar K, et al. Synergistic effect of human bone morphogenic protein-2 and mesenchymal stromal cells on chronic wounds through hypoxia-inducible factor-1α induction[J]. Sci Rep, 2017,7(1):42-72.
[6] Rodríguez-Pardo VM,Vernot JP. Mesenchymal stem cells promote a primitive phenotype CD34+c-kit+in human cord blood-derived hematopoietic stem cells during ex vivo expansion[J]. Cell Mol Biol Lett, 2013,18(1):11-33.
[7] Andrade PZ, Santos F, Almeida-Porada G, et al. Systematic delineation of optimal cytokine concentrations to expand hematopoietic stem/progenitor cells in co-culture with mesenchymal stem cells[J]. Mol Biosyst, 2010,6(7):1207-1215.
[8] de Silva CL, Gonçalves R, dos Santos F, et al. Dynamic cell-cell interactions between cord blood haematopoietic progenitors and the cellular niche are essential for the expansion of CD34+, CD34+CD38-and early lymphoid CD7+cells[J]. J Tissue Eng Regen Med, 2010,4(2):149-158.
[9] Moll NM, Ransohoff RM. CXCL12 and CXCR4 in bone marrow physiology[J]. Expert Rev Hematol, 2010,3(3):315-322.
[10] Chen LZ, Yin SM, Zhang XL, et al. Protective effects of human bone marrow mesenchymal stem cells on hematopoietic organs of irradiated mice[J]. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 2012,20(6):1436-1441.
[11] Utsugisawa T, Moody JL, Aspling M, et al. A road map toward defining the role of Smad signaling in hematopoietic stem cells[J]. Stem Cells, 2006,24(4):1128-1136.
[12] Lempereur A, Canto PY, Richard C, et al. The TGFβ pathway is a key player for the endothelial-to-hematopoietic transition in the embryonic aorta[J]. Dev Biol, 2017,12(17):307-320.
[13] Crisan M, Solaimani Kartalaei P, Neagu A, et al. BMP and hedgehog regulate distinct AGM hematopoietic stem cells ex vivo[J]. Stem Cell Reports, 2016,6(3):383-395.
[14] Söderberg SS, Karlsson G, Karlsson S. Complex and context dependent regulation of hematopoiesis by TGF-β superfamily signaling[J]. Ann N Y Acad Sci, 2009(1176):55-69.
[15] Kiel MJ, Morrison SJ. Uncertainty in the niches that maintain haematopoietic stem cells[J]. Nat Rev Immunol, 2008,8(4):290-301.
[16] Bhatia M, Bonnet D, Wu D, et al. Bone morphogenetic proteins regulate the developmental program of human hematopoietic stem cells[J]. Exp Med, 1999,189(7):1139-1148.
[17] Detmer K, Walker AN. Bone morphogenetic proteins act synergistically with haematopoietic cytokines in the differentiation of haematopoietic progenitors[J]. Cytokine, 2002,17(1):36-42.
[18] Grassinger J, Simon M, Mueller G, et al. Bone morphogenetic protein (BMP)-7 but not BMP-2 and BMP-4 improves maintenance of primitive peripheral blood-derived hematopoietic progenitor cells (HPC) cultured in serum-free medium supplemented with early actin cytokines[J]. Cytokine, 2007,40(3):165-171.
[19] Su YH, Cai HB, Ye ZY, et al. BMP-7 improved and hematopoietic reconstitution potential of ex vivo expanded cord blood-derived CD34(+) cells[J]. Hum Cell, 2015,28(1):14-21.
[20] Yang XJ, Zhang Y, Yang YL, et al. Vascular endothelial growth factordependent spatiotemporal dual roles of placental growth factor in modulation of angiogenesis and tumor growth[J]. P Natl Acad Sci U S A, 2013,1(10):13932-13937.
[21] Leopol′d AV, Baklaushev VP, Korchagina AA, et al. Ligandreceptor assay for evaluation of functional activity of human recombinant VEGF and VEGFR-1 extracellular fragment[J]. B Exp Biol Med, 2012,152(6):707-711.
[22] Shibuya M. VEGF-VEGFR signals in health and disease[J]. Biomol Ther, 2014,22(1):1-9.
[23] Fagiani E, Christofori G. Angiopoietins in angiogenesis[J]. Cancer Lett, 2013,328(1):18-26.
[24] Makinde T, Agrawal DK. Intra and extravascular transmembrane signalling of angiopoietin-1-Tie2 receptor in health and disease[J]. J Cell Mol Med, 2008,12(3):810-828.
[25] Mercier FE, Ragu C, Scadden DT. The bone marrow at the crossroads of blood and immunity[J]. Nat Rev Immunol, 2012,12(1):49-60.
[26] Ellis SL, Grassinger J, Jones A, et al. The relationship between bone, hemopoieticstem cells, and vasculature[J]. Blood,2011(18):1516-1524.

