肺纤维化大鼠肺组织Smurf2表达变化及意义
代文静,何彬普,孙建,邱静,马春兰,李万成
(1成都医学院第一附属医院,成都610500;2中国五冶集团有限公司医院)
肺纤维化是一种慢性、进行性的间质性肺病,发病机制尚未完全明确,亦缺乏有效的治疗方法,患者预后差[1,2]。研究发现,转化生长因子β1(TGF-β1)是肺纤维化形成的关键因子,在肺纤维化的形成和发展中发挥重要作用。Smad蛋白是近年发现的参与TGF-β细胞内传导的一类信号蛋白,是TGF-β受体下游的信号转导因子,建立起细胞膜与细胞核之间的信号转导通路,TGF-β1通常与Smad蛋白形成信号传导通路,介导TGF-β1发挥作用[3,4]。泛素蛋白酶体途径(UPP)可对细胞内蛋白进行特异性降解,是真核细胞内重要的蛋白质质控系统。Smad泛素化调节因子2(Smurf2)是泛素连接酶E3的一种,可通过泛素化降解Smad7调控TGF-β1信号传导,可能参与肺纤维化的发生发展[5,6]。2016年8月~2017年6月我们进行本研究,探讨Smurf2在肺纤维化发生、发展中的作用。
1 材料与方法
1.1材料健康清洁级SD雄性大鼠96只,8~10周龄,体质量(220±50)g,由成都达硕实验动物有限公司提供,动物许可证号:SCXK(川)2015-030。博莱霉素(哈尔滨博莱制药有限公司),兔抗大鼠TGF-β1、Smurf2、Smad7单克隆抗体(英国abcam公司),DMSO溶液、MG132(上海碧云天生物技术有限公司),Masson染色试剂(北京solarbio科技有限公司),免疫组化试剂盒(武汉boster生物工程有限公司)。
1.2动物分组及处理将96只SD大鼠随机分为对照组、模型组、MG132组和DMSO组,每组24只。各组均采用10%水合氯醛腹腔注射麻醉后暴露气管,模型组、MG132组、DMSO组制备肺纤维化模型:气管内一次性注入博莱霉素溶液0.3 mL(5 mg/kg),然后将大鼠直立旋转使药液在肺内均匀分布;对照组一次性注入等量生理盐水。MG132组每天腹腔注射蛋白酶体抑制剂MG132 0.3 mL(0.1 mg/kg,以DMSO配制),DMSO组每天腹腔注射等量DMSO,模型组及对照组每天腹腔注射等量生理盐水。
1.3相关指标观察①一般情况:各组于造模后第7、14、28天观察大鼠精神、食欲、毛色、活动度等一般情况。②肺组织病理学变化:各组于造模后第7、14、28天分别处死8只大鼠,开胸取出完整肺组织,肉眼观察肺组织;经主支气管向肺内注入10%中性甲醛固定24 h,石蜡包埋后切片。对切片进行Masson染色,观察组织病理学变化;使用ImagePro-Plus6.0图像分析系统对染色切片进行胶原纤维染色面积测评,以评价肺纤维化程度。肺纤维化程度的判断标准:轻度:肺纤维化面积占全肺面积<20%;中度:肺纤维化面积占全肺面积的20%~50%;重度:肺纤维化面积占全肺面积>50%。③肺组织TGF-β1、Smurf2、Smad7表达:取各组各时间点肺组织切片,采用免疫组化法检测TGF-β1、Smurf2、Smad7表达,步骤均参照试剂盒说明书。采用ImagePro-Plus6.0图像分析系统对免疫组化图片结果进行半定量分析,以积分光密度(IOD)值代表表达量。④肺组织Smurf2表达与胶原纤维染色面积、TGF-β1、Smad7表达的关系:采用Pearson相关分析法分析肺组织Smurf2表达与胶原纤维染色面积、TGF-β1、Smad7表达的关系。
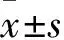
2 结果
2.1各组一般情况比较造模后第7天各组精神、活动等一般情况均良好,组间差异不明显。造模后第14、28天:对照组一般情况均良好;模型组和DMSO组精神逐渐变差,呼吸逐渐困难,食量减少,体质量明显下降;MG132组精神、食欲、活动度等一般情况均介于对照组与模型组之间。
2.2各组肺组织病理学变化肉眼观察,对照组肺组织表面光滑、湿润,弹性尚可。模型组和DMSO组第7天双肺表面出现少量暗红色淤血、出血点,体积无变化;第14、28天双肺片状白色区域逐渐增多,肺体积逐渐缩小,弹性下降,表面凸凹不平。MG132组第7天双肺表面见少许暗红色淤血、出血区域,第14、28天双肺表面存在淤血、出血区及色泽苍白区,肺体积有所减小,弹性尚可,表面局部凸凹不平。
Masson染色结果显示,第7、14、28天对照组肺组织肺泡结构正常,未见明显蓝色胶原沉积。DMSO组及模型组第7天肺泡结构大体正常,少量蓝色胶原沉积;第14、28天肺泡结构破坏逐渐严重,蓝色胶原逐渐增加,较第7天增加明显。MG132组第7天肺泡结构大体正常,少量蓝色胶原沉积;第14、28天肺泡结构少许破坏,蓝色胶原略有增加,但较模型组有所减少。第7、14、28天模型组、MG132组和DMSO组肺组织Masson染色面积均逐渐增加,且均高于对照组,MG132组均低于模型组、DMSO组,组间比较P均<0.05。各时间点模型组和DMSO组间比较P均>0.05。见表1。
2.3各组肺组织TGF-β1、Smurf2、Smad7表达第7、14、28天模型组、MG132组和DMSO组肺组织TGF-β1、Smurf2表达的IOD值逐渐增加,且均高于对照组,MG132组均低于模型组、DMSO组,组间比较P均<0.05。第7、14、28天模型组、MG132组和DMSO组肺组织Smad7表达的IOD值逐渐降低,且均低于对照组,MG132组均高于模型组、DMSO组,组间比较P均<0.05。各时间点模型组和DMSO组肺组织TGF-β1、Smurf2、Smad7表达的IOD值比较P均>0.05。见表2。
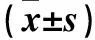
表1 各组肺组织Masson染色面积比较
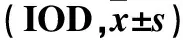
表2 各组肺组织TGF-β1、Smurf2、Smad7表达比较
2.4肺组织Smurf2表达与胶原纤维染色面积、TGF-β1、Smad7表达的关系肺组织Smurf2表达与胶原纤维染色面积及TGF-β1表达均呈正相关(r分别为0.763、0.623,P均<0.05),与Smad7表达呈负相关(r=-0.645,P<0.05)。
3 讨论
肺纤维化的病理特征主要为肺泡上皮细胞的炎症损伤、成纤维细胞过度增殖、细胞外基质过度沉积和肺组织异常修复,最终导致结构和功能受损[2,7]。肺纤维化早期病理改变为肺泡炎,此后逐渐出现纤维化,造成不可逆性纤维化改变,导致肺功能逐渐下降,甚至呼吸衰竭[7,8]。TGF-β家族主要包括TGF-β1、TGF-β2、TGF-β3三种类型,其中TGF-β1活性最强,功能最多,应用最广泛[9]。TGF-β1是多效性的细胞生长因子,通过促进细胞外基质沉积,在肺纤维化疾病的病理变化过程中发挥关键性作用[10~12]。Smad蛋白是近年发现的参与TGF-β细胞内传导的一类信号蛋白,是TGF-β受体下游的信号转导因子,建立起细胞膜与细胞核之间的信号转导通路,Smad蛋白是TGF-β信号传导通路中最关键的信号转导因子[13,14]。TGF-β1信号传导通路发挥效应时大部分需要下游Smad蛋白参与,Smad蛋白是其目的转录基因的主要信号传导蛋白,从而建立起胞膜与胞核之间的信号转导通路[3]。TGF-β1通过调控下游的Smad蛋白,诱导细胞外基质各种成分的合成,在肺纤维化的发生发展中具有关键作用,是诱导肺纤维化发生发展的关键细胞因子[12]。
泛素蛋白酶体途径(UPP)是对细胞内蛋白进行特异性降解的主要途径,是真核细胞内重要的蛋白质降解系统,参与细胞凋亡、细胞周期、细胞信号传导及抗原提呈等多种生理过程,对维持细胞稳态具有重要意义[5,15]。泛素活化过程包括泛素活化酶E1、泛素结合酶E2和泛素连接酶E3。泛素连接酶E3能促使泛素与特异性蛋白结合,决定泛素底物蛋白的特异性及高选择性,Smurf是泛素连接酶E3中的一种,包括Smurf1、Smurf2。Smurf1与Smurf2在蛋白序列及结构上极其相似,但功能上存在许多不同。Smurf1主要参与负调控骨形态发生蛋白(BMP)信号传导,Smurf2主要通过选择性降解TGF-β1/Smad信号通路中的关键组分,其与受体活化性Smad相比,更易于与抑制性Smad结合,使Smad7蛋白泛素化降解,进而调控TGF-β1信号传导,导致TGF-β1信号通路异常,促进纤维化的发生发展[5,6,16,17]。
MG132是一种醛基肽类蛋白酶体抑制剂,能与蛋白酶体结合可逆性抑制蛋白酶体活性,从而抑制、阻断UPP。杨俊侠等[11]研究发现,TGF-β1可上调人肺成纤维细胞中Smurf2表达,而对Smurf1表达无影响。叶燕青等[18]研究发现,MG132能减轻博莱霉素诱导大鼠肺纤维化模型的纤维化程度,但机制不明确。本研究结果显示,模型组、DMSO组及MG132组肺组织纤维化程度、Smurf2及TGF-β1表达均逐渐增加,Smad7表达逐渐减少;与模型组及DMSO组相比,MG132组肺纤维化程度减轻,Smurf2及TGF-β1表达下调,Smad7表达上调。肺组织Smurf2表达与胶原纤维染色面积、TGF-β1表达呈正相关,Smurf2与Smad7表达呈负相关。提示采用MG132抑制Smurf2表达可阻止TGF-β1/Smad7信号传导,抑制肺纤维化的发生、发展。
综上所述,肺纤维化大鼠肺组织中Smurf2表达增加,并通过调控TGF-β1/Smad7信号传导促进肺纤维化的发生、发展。Smurf2有可能成为防止肺纤维化发生、发展的一个新靶点。
参考文献:
[1] Spagnolo P, Rossi G, Cavazza A. Pathogenesis of idiopathic pulmonary fibrosis and its clinical implications[J]. Expert Rev Clin Immunol, 2014,10(8):1005-1017.
[2] Overed-Sayer C, Rapley L, Mustelin T, et al. Are mast cells instrumental for fibrotic diseases[J]. Front Pharmacol, 2014,21(4):174.
[3] Zhou Y, He Z, Gao Y, et al. Induced pluripotent stem cells inhibit Bleomycin-Induced pulmonary fibrosis in mice through suppressing TGF-β1/Smad-Mediated epithelial to mesenchymal transition[J]. Front Pharmacol, 2016,15(7):430.
[4] 邱静,李万成.特发性肺纤维化中Smurf2对TGF-β1/Smad通路调控机制[J].国际呼吸杂志,2016,36(15):1183-1186.
[5] Cai Y, Zhou CH, Fu D, et al. Overexpression of Smad ubiquitin regulatory factor 2 suppresses transforming growth factor-βmediated liver fibrosis[J]. J Dig Dis, 2012,13(6):327-334.
[6] 骆菁怡,张立婷,鲁明霞,等.Smurf2对肝纤维化中TGF-β/Smad通路的影响[J].医学综述,2015,21(17):3113-3116.
[7] Wang C, Gu S, Cao H, et al. miR-877-3p targets Smad7 and is associated with myofibroblast differentiation and bleomycin-induced lung fibrosis[J]. Sci Rep, 2016(6):30122.
[8] Rafii R, Juarez MM, Albertson TE, et al. A review of current and novel therapies for idiopathic pulmonary fibrosis[J]. J Thoracic Dis, 2013,5(1):48-73.
[9] Verrecchia F, Mauviel A. Transforming growth factor-beta and fibrosis[J]. World J Gastroenterol, 2007,13(22):3056-3062.
[10] Piera-Velazquez S, Jimenez SA. Molecular mechanisms of endothelial to mesenchymal cell transition (EndoMT) in experimentally induced fibrotic diseases[J]. Fibrogenesis Tissue Repair, 2012,5(Suppl 1):S7.
[11] 杨俊侠,曹述任,张敏.Smad泛素化调节因子2在转化生长因子β1诱导人肺成纤维细胞活化中的作用及其分子机制[J].吉林大学学报(医学版),2015,41(5):891-897.
[12] Bhattacharyya S, Wei J, Varga J. Understanding fibrosis in systemic sclerosis: shifting paradigms, emerging opportunities[J]. Nat Rev Rheumatol, 2011,8(1):42-54.
[13] Attisano L, Wrana JL, Signal transduction by the TGF-β superfamily[J]. Science, 2012,296 (5573):1646-1648
[14] Budi EH, Xu J, Derynck R. Regulation of TGF-β Receptors[J]. Methods Mol Biol, 2016,13(44):1-33.
[15] Liu FY, Li XZ, Peng YM, et al. Arkadia-Smad7-mediated positive regulation of TGF-β signaling in a rat model of tubulointerstitial fibrosis[J]. Am J Nephrol, 2007,27(2):176-83.
[16] Wu B, Guo B, Kang J, et al. Downregulation of Smurf2 ubiquitin ligase in pancreatic cancer cells reversed TGF-β-induced tumor formation[J].Tumour Biol, 2016(11):1-15.
[17] Ganji A, Mosayebzadeh H, Varasteh A, et al. The effects of WW2/WW3 domains of Smurf2 molecule on TGF-β signaling and arginase I gene expression[J]. Cell Biol Int, 2015,39(6):690-695.
[18] 叶燕青,张细曼.泛素-蛋白酶体抑制剂对大鼠肺纤维化的影响[J].中国医院药学杂志,2013,33(3):196-198.

