糖尿病听力损害大鼠耳蜗组织糖基化终末产物受体表达及意义
高海涛,曲雁,张勋,穆俊晌,张璞,王欣,赵秀棉
(1河北医科大学第三医院,石家庄050000;2河北省平泉县医院)
糖尿病患者耳蜗微血管病变会引起细胞损伤,造成听力损害[1~3]。研究显示,氧化应激、代谢异常、糖基化终末产物(AGEs)等参与糖尿病并发症的发生[4,5]。糖基化终末产物受体(RAGE)可以与AGEs特异性结合,影响细胞内信号传递,调控生长因子或细胞因子表达,促进糖尿病并发症的发生[6]。但是,AGEs/RAGE在糖尿病听力损害发生中的作用尚未明确。2016年2月~2017年1月我们进行本研究,探讨糖尿病听力损害大鼠模型耳蜗组织RAGE表达及意义。
1 材料与方法
1.1材料Wistar雄性大鼠32只,11~12周龄,体质量190~200 g,购自河北实验动物中心[SCXK(冀)2013-1-003];RNA提取试剂盒购自美国Promega公司;链脲佐菌素(STZ)购自大连美仑生物技术有限公司;反转录试剂盒购自美国Invitrogen公司;RT-PCR试剂盒购自德国QIAGEN公司;RAGE一抗、生物素标记的二抗购自美国Abcam公司;GAPDH一抗购自美国Santa Cruz公司;DAB显色试剂盒购自北京索莱宝科技有限公司;LDL-c检测试剂盒购自卡迈舒(上海)生物科技有限公司。
1.2模型制作及处理Wistar大鼠饲养温度为21.5~23.5 ℃,自然采光,通风良好,湿度为50%~60%。所有大鼠饲喂7天后禁食12 h。将大鼠随机分为两组,每组16只。模型组静注含0.1% STZ的柠檬酸溶液(55 mg/kg),对照组给予同等剂量的柠檬酸溶液。注射后第3天,鼠尾采血,血糖仪检测血糖,模型组血糖均>16.7 mmol/L,即造模成功。造模后模型组每天给予生理盐水灌胃,在20周内保持空腹血糖>16.7 mmol/L。造模过程中模型组死亡2只,对照组随机选取2只大鼠剔除,最终两组大鼠均为14只。
1.3相关指标观察
1.3.1脑干听觉诱发电位(ABR)相关指标饲养20周时检测两组ABR。具体方法:两组均腹腔注射2%戊巴比妥钠(40 mg/kg),在电屏蔽室中采用多功能ABR仪检测ABR阈值,隔音室的本底噪声为30 dB SPL。将银制的针形电击放在大鼠颅顶外耳道和正中线交汇部分的皮下位置,参考电极放在给声侧的耳垂,接地电极放在鼻尖。每个电极置于皮下约8 mm处,给声耳机放在距离测定耳的外耳道15 mm处。用短声刺激,扫描时间为20 ms,刺激频率为20次/s,迭加512次,带通滤波为190~2 000 Hz。按照10 dB依次递减,从100 dB SPL开始,当接近阈值后按照2 dB逐渐递减。听反应阈定义为刚好能够引起重复性较好的波Ⅲ最小的声压级。以70 dB SPL的刺激强度为标准,统计波Ⅰ、波Ⅲ及波Ⅴ潜伏期,波Ⅰ~Ⅲ间期、波Ⅲ~Ⅴ间期、波Ⅰ~Ⅴ间期。
1.3.2血清LDL-c、HbA1c、AGEs水平两组大鼠在饲养20周结束时断头处死,处死前14 h禁食,处死后迅速心脏采血。采用ELISA法检测血清LDL-c,采用BIO-RAD-D10高效液相色谱法检测血清HbA1c。采用荧光分光光度计检测血清AGEs,激发波长为370 nm,发射波长为440 nm,以荧光强度表示AGEs水平。
1.3.3组织病理学改变采用HE染色。两组大鼠断头处死后将两侧听泡取出,将一侧听泡的听骨和鼓膜挑出,在蜗尖钻孔,将卵圆窗和圆窗开放,置于4%多聚甲醛中固定,4 ℃过夜;PBS洗涤后置于10% EDTA脱钙7天,每天更换1次脱钙液;将耳蜗组织放入70%、80%、85%、95%、100%浓度梯度乙醇中脱水,二甲苯透明,浸蜡,石蜡包埋,5 μm厚切片;将切片裱在预先用多聚赖氨酸处理的玻片上,65 ℃烘烤4 h;HE染色,光镜下观察耳蜗组织病理变化。
1.3.4耳蜗组织RAGE蛋白表达采用免疫组化法检测。取1.3.3中常规石蜡包埋后切片的组织标本,用3%过氧化氢孵育10 min,加入复合消化液在37 ℃孵育0.5 h,蒸馏水洗涤,加入山羊血清室温封闭20 min,加入1∶300稀释的RAGE抗体4 ℃过夜,PBS洗涤,加入生物素标记的二抗37 ℃孵育0.5 h,PBS洗涤,DAB显色,苏木素复染,浓度梯度乙醇脱水,二甲苯透明,中性树胶封片。在光学显微镜下观察棕黄色颗粒为RAGE阳性。
1.3.5耳蜗组织RAGE mRNA表达采用RT-PCR法检测。取1.3.3中两组另一侧听泡各100 mg,采用TRIzol提取RNA,逆转录合成cDNA,PCR扩增后检测RAGE mRNA相对表达量。RAGE及GAPDH(内参)引物由生工生物工程(上海)股份有限公司合成。
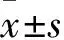
2 结果
2.1两组ABR相关指标比较模型组ABR阈值,波Ⅰ、Ⅲ、Ⅴ潜伏期,波Ⅰ~Ⅲ间期、波Ⅲ~Ⅴ间期、波Ⅰ~Ⅴ间期阈值均高于对照组(P均<0.01)。见表1。
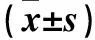
表1 两组ABR相关指标比较
注:与对照组比较,*P<0.01。
2.2两组血清LDL-c、HbA1c、AGEs水平比较模型组血清LDL-c、HbA1c、AGEs水平均高于对照组(P均<0.01)。见表2。
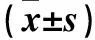
表2 两组血清LDL-c、HbA1c、AGEs水平比较
注:与对照组比较,*P<0.01。
2.3两组耳蜗组织病理学变化HE染色结果显示,对照组耳蜗组织中血管纹正常,模型组耳蜗中毛细血管管径变小、管腔变细。
2.4两组耳蜗组织RAGE蛋白表达比较模型组11只大鼠耳蜗组织表达RAGE,阳性率为78.57%;且RAGE主要在血管纹细胞胞质中,在螺旋神经节中也有RAGE表达。对照组1只大鼠耳蜗组织血管纹细胞胞质中表达RAGE,阳性率为7.14%。两组RAGE表达阳性率比较P<0.05。
2.5两组耳蜗组织RAGE mRNA表达比较模型组大鼠耳蜗组织RAGE mRNA相对表达量为1.82±0.13,对照组为1.00±0.08,两组比较P<0.01。
3 讨论
周围神经和血管病变是糖尿病并发症发生的主要原因[7,8]。Kazmierczak等[9]研究显示,糖尿病患者眩晕、听力下降等内耳疾病的发生率约为正常人的2倍。原因为长期高血糖状态引起外周神经损伤,导致内耳细胞和神经间突触、颅神经、中枢神经系统等发生病变,引起听神经发生障碍[10]。王士礼等[11]研究表明,糖尿病大鼠模型的内耳毛细血管基底膜异常。因耳蜗组织内耳动脉相互之间没有分支循环,微血管发生病变以后会引起其中一支动脉发生堵塞,影响血液循环,导致听力障碍[12]。
在高糖状态下,氧化应激会损害蛋白质、核酸等结构,AGEs变成修饰蛋白,而修饰蛋白可以成为自身抗原,从而影响基因表达[13]。AGEs还可与细胞膜上的受体结合,趋化白细胞,分泌细胞因子,导致邻近的细胞产生大量代替物质,引起基质异常增生。LDL-c糖基化会引起动脉粥样硬化,糖尿病患者血液中可出现AGEs-LDL复合物,导致LDL-c的正常识别和降解发生延迟,引起血脂异常升高;而机体内的AGEs-LDL被吞噬细胞吞噬后积聚在血管壁,又会进一步加重血管病变[14]。本研究模型组血清AGEs、LDL-c、HbA1c水平均升高,说明AGEs参与糖尿病的发生过程。
脑干的ABR能够间接反映脑干功能和蜗后功能,ABR又称为脑干听觉诱发电位(BAEP)。ABR波的来源分别为:波Ⅰ:反映耳蜗以及听神经颅外段电位水平,波Ⅲ:反映上橄榄核电活动水平,波Ⅴ:反映下丘脑电活动水平[15,16]。当机体的听觉系统受到炎症、占位病变、缺血等影响时,耳蜗组织发生水肿、纤维脱髓鞘,导致电活动异常,使ABR波型异常,潜伏期或波间期延长,ABR异常发生的概率随着病程的增加而增加。研究显示,糖尿病患者波Ⅰ、Ⅲ、Ⅴ潜伏期延长,而对于波Ⅰ~Ⅲ、波Ⅰ~Ⅴ、波Ⅲ~Ⅴ间期变化的报道结果不同,可能与耳蜗神经通路的病变程度不同有关[17]。本研究模型组波Ⅰ、Ⅲ、Ⅴ潜伏期均延长,而波Ⅰ~Ⅲ、波Ⅰ~Ⅴ、波Ⅲ~Ⅴ间期亦均延长,且ABR阈值增加;提示糖尿病大鼠存在听力损害,声波的中枢神经传递时间延长。HE染色结果显示,模型组耳蜗中毛细血管管径变小,管腔变细,进一步明确了糖尿病大鼠存在耳蜗血管病变。
AGEs的受体RAGE存在于多种细胞膜上,RAGE属于免疫球蛋白超家族的成员之一,是一个跨膜受体,与AGEs形成的AGEs-RAGE系统参与糖尿病血管病变过程[18]。在正常的人体中AGEs和RAGE均呈现低表达的状态,当受到高糖等刺激后其表达水平迅速升高,打破组织内的氧化平衡,引起炎症因子、生长因子异常分泌,导致组织损伤[19,20]。本研究结果显示,糖尿病大鼠耳蜗组织中RAGE表达阳性率高于正常大鼠,且其mRNA水平高于正常大鼠,说明RAGE参与了糖尿病听力损害的发生。
综上所述,AGEs、RAGE表达上调可促进糖尿病大鼠听力损害的发生。
参考文献:
[1] 张伟,马维青.胰高糖素样肽1类似物对2型糖尿病患者体质量的影响及作用机制研究进展[J].山东医药,2015,55(31):92-95.
[2] De Felice FG, Ferreira ST. Inflammation, defective insulin signaling, and mitochondrial dysfunction as common molecular denominators connecting type 2 diabetes to Alzheimer disease[J]. Diabetes, 2014,63(7):2262-2272.
[3] 魏双平,郭靠山,李瑞玉,等.糖尿病对听力及耳蜗形态学结构影响的相关因素[J].中国组织工程研究,2013,17(7):1305-1312.
[4] Tsuda J, Sugahara K, Hori T, et al. A study of hearing function and histopathologic changes in the cochlea of the type 2 diabetes model Tsumura Suzuki obese diabetes mouse[J]. Acta Otolaryngol, 2016,136(11):1097-1106.
[5] Singh VP, Bali A, Singh N, et al. Advanced glycation end products and diabetic complications[J]. Korean J Physiol Pharmacol, 2014,18(1):1-14.
[6] Thomas MC, Woodward M, Neal B, et al. Relationship between levels of advanced glycation end products and their soluble receptor and adverse outcomes in adults with type 2 diabetes[J]. Diabetes Care, 2015,38(10):1891-1897.
[7] 杜倩,田秋霞,付莉萍,等.银杏叶提取物对糖尿病大鼠视网膜病变的作用[J].中国病理生理杂志,2016,32(7):1323-1326.
[8] 王杨,刘畅.依帕司他治疗糖尿病周围神经病变的疗效及机制[J].中国老年学杂志,2015,35(1):93-95.
[9] Kazmierczak H, Doroszewska G. Metabolic disorders in vertigo, tinnitus, and hearing loss[J]. Int Tinnitus J, 2001,7(1):54-58.
[10] 于飞,张文越,赵越,等.膳食铁过量诱导的2型糖尿病雄性小鼠听力脑干反应及耳蜗带状突触损伤的初步研究[J].环境与健康杂志,2016,33(1):5-8.
[11] 王士礼,陈学明,毕道周,等.实验性糖尿病大鼠内耳毛细血管超微结构变化[J].听力学及言语疾病杂志,2006,14(4):278-279.
[12] Contrera KJ, Sung YK, Betz J, et al. Change in loneliness after intervention with cochlear implants or hearing aids[J]. Laryngoscope, 2017,127(8):1885-1889.
[13] 张艳,宿英英.脑干听觉诱发电位对重症脑功能损伤的评价[J].中华神经科杂志,2004,37(5):452-454.
[14] 徐欢欢,齐新伟,王忠勋,等.2型糖尿病听力损害患者与AGEs及APN的相关性研究[J].中华耳科学杂志,2013,11(2):243-246.
[15] Yamagishi S. Role of advanced glycation end products (AGEs) and receptor for AGEs (RAGE) in vascular damage in diabetes[J]. Exp Gerontol, 2011,46(4):217-224.
[16] Chao PC, Huang CN, Chengchin H, et al. Association of dietary AGEs with circulating AGEs, glycated LDL, IL-1α and MCP-1 levels in type 2 diabetic patients[J]. Eur J Nutr, 2010,49(7):429-434.
[17] Thirumala P, Meigh K, Dasyam N, et al. The incidence of high-frequency hearing loss after microvascular decompression for trigeminal neuralgia, glossopharyngeal neuralgia, or geniculate neuralgia[J]. J Neurosurg, 2015,123(6):1500-1506.
[18] 毛艳,尹登科,桂双英.中药抑制AGEs-RAGE系统治疗糖尿病血管并发症的研究进展[J].安徽医药,2011,15(7):796-798.
[19] 苏纪武,毛翔,孙远征,等.温针灸对糖尿病大鼠坐骨神经AGEs mRNA、RAGE mRNA表达的影响[J].针灸临床杂志,2010,26(2):51-54.
[20] Yamamoto Y, Yamagishi S, Yonekura H, et al. Roles of the AGE-RAGE system in vascular injury in diabetes[J]. Ann N Y Acad Sci, 2000,902(1):163-172.

