纳洛酮配伍曲马多对炎性疼痛大鼠的镇痛作用及机制
李鹏涛,秦颖,肖智,文松
(1遵义医学院,贵州遵义563000;2遵义医学院附属医院)
按照病因疼痛可以分为创伤性疼痛、炎性疼痛、神经病理性疼痛、癌痛和精神(心理)性疼痛,其中炎性疼痛由生物源或化学源性炎症引发,常见于风湿性关节炎、类风湿性关节炎、强直性脊柱炎等疾病。多模式镇痛(MMA)是联合应用不同作用机制的镇痛药物和镇痛方法,通过作用于疼痛形成和维持机制的不同时相和靶位,减少外周或中枢敏化,从而获得最佳镇痛效果。曲马多是一种非典型中枢阿片类受体镇痛药,可单独使用也可与其他药物配伍应用[1,2]。纳洛酮是一种人工合成的阿片受体拮抗剂,是羟二氢吗啡酮的衍生物。研究发现,小剂量纳洛酮与曲马多联合应用可增强曲马多的镇痛作用,并减少曲马多的毒副作用,但其多用于术后镇痛,对炎性疼痛的影响及作用机制尚不明确[3,4]。2017年3~5月,我们观察了曲马多联合纳洛酮对炎性疼痛大鼠的镇痛作用,现分析结果并探讨其作用机制。
1 材料与方法
1.1材料①动物:清洁级雄性成年SD大鼠72只,体质量220~270 g,由第三军医大学动物实验中心提供,合格证号:SCXK(渝)2012-0005。每4只一笼饲养,置于湿度55%、温度(25±3)℃环境中,自由饮食,自然采光,适应环境1周。本研究严格按照有关动物伦理纲要进行操作。②主要试剂及仪器:兔抗大鼠c-Fos多克隆抗体、兔抗大鼠β-actin抗体(美国abcam公司),3%牛血清白蛋白、辣根过氧化物酶标记山羊抗兔IgG、DAB显色试剂盒、抗体稀释液、RIPA裂解液(碧云天生物技术有限公司)。盐酸曲马多注射液(2 mL∶100 mg),批号:16062411(多多药业有限公司);盐酸纳洛酮注射液(1 mL∶0.4 mg),批号:17080120(药友制药有限责任公司)。冰冻切片机(Leica-CM1950型,德国)。
1.2炎性疼痛模型制作及分组干预将72只SD大鼠按随机数字表法分为空白组、模型组、曲马多组、纳洛酮组、低剂量纳洛酮+曲马多(NL+T)组、高剂量纳洛酮+曲马多(NH+T)组,每组12只。建模日大鼠适应环境30 min,空白组左后足底注射生理盐水100 μL,10 min后鞘内注射生理盐水20 μL;另五组左足后底注射5%甲醛100 μL,10 min后模型组鞘内注射生理盐水20 μL,曲马多组鞘内注射曲马多25 μg/kg(溶于20 μL生理盐水),纳洛酮组鞘内注射纳洛酮100 ng/kg(溶于20 μL生理盐水),NL+T和NH+T组分别鞘内注射纳洛酮1 ng/(kg·10 μL)+曲马多25 μg/(kg·10 μL)、纳洛酮100 ng/(kg·10 μL)+曲马多25 μg/(kg·10 μL)。鞘内注射方法:大鼠经持续低浓度异氟烷麻醉,俯卧置于操作台上。腹部置一圆筒形支撑物,使腰骶部隆起,充分暴露腰椎间隙。左手手指探查到脊柱下段钝形突起(髋结节),其水平位置为大鼠L6,使用25 μL微量进样器沿脊柱向上,于L5~6椎间隙进针,出现轻微的甩尾反射视为穿刺成功,30 s内缓慢注射相应药物20 μL。药物注射后出现运动障碍的大鼠排除在外,重新建模补足动物数。
1.3疼痛行为学观察及评分观察各组大鼠建模前后步态、姿势,后肢(特别是左后肢)着地协调程度、着地/离地时间,有无跛行、鼠爪畸形、安静时屈腿以及舔趾、咬等行为学表现。将大鼠置于观察台上,台下斜放一镜子(与平台成30°),观察大鼠行为反应。记录注射药物后60 min内注射侧后足的舔足时间,每隔5 min计算一次疼痛分数。评分标准:0分:注射爪行走正常,大鼠无舔趾、抬爪等行为;1分:注射爪轻触观测台面;2分:注射爪抬离观测台面;3分:大鼠舔趾、咬、甩动或过分关注注射爪。疼痛分数=∑各行为得分×持续时间(s)/300 s。
1.4脊髓背角c-Fos蛋白表达检测
1.4.1免疫组化法取建模后1 h各组大鼠,每组随机取6只,腹腔内注射4%水合氯醛(20 mL/kg),深度麻醉后开胸暴露心脏,生理盐水和4%多聚甲醛溶液先快后慢进行灌注。取出脊髓节段组织后按分组置于4%多聚甲醛溶液中,4 ℃冰箱保存;4 h后转移至30%蔗糖多聚甲醛溶液中,4 ℃冰箱保存;3天后取出脊髓节段组织,取脊髓腰膨大段(L4~6)包埋后置于冰冻切片机,沿脊髓冠状位连续切片,厚25 μm;每4~5张脊髓切片取一张进行免疫组化染色分析,每只大鼠取10张。脊髓片漂洗和血清封闭后加入兔抗大鼠c-Fos一抗(1∶400)和二抗;DAB显色,梯度乙醇脱水,二甲苯透明后封片,光镜下观察并采集图像。采用 Image-Pro Plus6.0图像分析软件(Media Cybernetics公司,美国)对脊髓图片进行c-Fos阳性产物的平均光密度(AOD)值检测。
1.4.2Western blotting法建模后1 h每组随机取6只大鼠,腹腔注射4%水合氯醛(20 mL/kg)麻醉,迅速取脊髓组织腰膨大段(L4~6),-80 ℃冰箱保存备用。实验操作时,取出脊髓组织称重,研碎后加入RIPA裂解液(含PMSF,1∶100),超声波粉碎;离心后取上清液,BCA法蛋白定量(蛋白定量为100 μg/mL);2倍上样缓冲液与样品等比例煮沸8 min,离心后-20 ℃冰箱保存;配胶,各泳道取20 μL(每个泳道蛋白含量为20 μg)加样,电泳,电转至PVDF膜,TBST封闭1 h;加入兔抗大鼠c-Fos抗体(1∶200)和小鼠抗大鼠β-actin抗体(1∶2 000),4 ℃冰箱孵育,过夜后洗膜;加入二抗,室温孵育、洗膜;化学增强发光试剂与PVDF膜共孵育后显影,定影。进行目标条带扫描,采用Bio-Rad生物图像处理系统对条带进行分析,以β-actin为内参对照,对所测目标蛋白的条带光密度(OD)值进行标准化,得到各组c-Fos蛋白相对光密度(ROD)值。
2 结果
2.1各组疼痛行为学表现及疼痛评分比较空白组在观察时间内未见明显缩腿、舔爪等疼痛行为学表现。模型组出现明显的两时相疼痛行为学表现(跛行、缩腿、舔足等),第一时相为注射后约5 min开始,持续约10 min;第二时相为注射后15~60 min。曲马多组、NH+T组、NL+T组疼痛行为学表现与模型组类似但程度减弱,以NL+T组减弱最为明显;纳洛酮组疼痛行为学表现与模型组类似。各造模组注射甲醛后5 min时疼痛评分比较差异均无统计学意义(P均>0.05),但均大于空白组(P均<0.01);从注射甲醛10 min后,各观察时间点疼痛评分:模型组、纳洛酮组>曲马多组>NH+T组>NL+T组>空白组,组间比较P均<0.01;纳洛酮与模型组比较差异均无统计学意义(P均>0.05)。见表1。
2.2各组脊髓背角c-Fos蛋白表达比较①免疫组化法:c-Fos阳性产物主要表达在脊髓背角灰质浅层,空白组、模型组、曲马多组、纳洛酮组、NL+T组、NH+T组c-Fos阳性产物的AOD值分别为1.23±0.10、1.71±0.21、1.58±0.18、1.68±0.22、1.26±0.12、1.42±0.17,模型组高于空白组及曲马多组,NL+T和NH+T组低于曲马多组,NL+T组低于NH+T组,组间比较P均<0. 01。② Western blotting法:各组脊髓背角中均观察到c-Fos蛋白免疫阳性条带。空白组、模型组、曲马多组、纳洛酮组、NL+T组、NH+T组阳性产物的ROD值分别为(145.63±23.47)%、(462.22±53.56)%、(298.44±36.27)%、(451.36±45.08)%、(173.46±27.62)、(235.52±33.70)%,模型组高于空白组和曲马多组,NL+T组和NH+T组低于曲马多组,NL+T组低于NH+T组,组间比较P均<0.01。
3 讨论
曲马多为临床常用的镇痛药。曲马多的镇痛效果与吗啡相当,且无明显的副作用。其镇痛作用机制主要包括:①对阿片受体产生弱激动作用;②通过抑制神经元突触对去甲肾上腺素和5-羟色胺(5-HT)的再摄取,加强机体下行性疼痛抑制系统的作用进而产生镇痛效果[5]。有研究发现,曲马多对切口疼痛大鼠和神经病理性疼痛大鼠的镇痛机制与曲马多下调脊髓背角c-Fos蛋白表达有关[6,7]。纳洛酮是经典阿片受体特异性拮抗剂,与阿片受体的亲和力是吗啡的16倍,主要用于阿片类或其他麻醉性镇痛药(哌替啶、美沙酮、芬太尼)过量中毒、吗啡类复合麻醉术后,以解除呼吸抑制和各种原因所致的休克[8]。
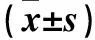
表1 各组各时间点疼痛评分
炎性疼痛是由各种因素(包括物理、化学、生物等)刺激机体产生炎性介质并造成促炎因子释放增加引起的疼痛。组织损伤后可导致促炎因子(如缓激肽、5-HT、IL-1、IL-6等)、细胞因子释放,激活与痛觉有关的受体,致使神经传导功能出现异常,外周和中枢神经敏化,导致疼痛产生与维持。研究发现,足底局部注射甲醛可刺激机体组织释放炎性因子,如缓激肽、5-HT、三磷酸腺苷(ATP),其中促炎症因子IL-1β水平升高后可激活星形胶质细胞NMDA受体,形成并加重中枢痛觉敏化[9]。局部炎性因子水平升高同样可引起周围神经致敏,外周敏化促进疼痛的产生和维持。因此,研究者常采用足底局部注射甲醛制备炎性疼痛动物模型。本研究通过对SD大鼠足底注射甲醛建立炎性疼痛大鼠模型。建模后,炎性疼痛大鼠疼痛评分升高,提示炎性疼痛大鼠建模成功;在炎性疼痛大鼠鞘内注射曲马多后,大鼠疼痛缓解,疼痛评分降低;对炎性疼痛大鼠伍用不同剂量的纳洛酮和曲马多后,其复合镇痛效果好于单独使用曲马多,并且小剂量纳洛酮与曲马多复合使用后镇痛效果好于大剂量纳洛酮与曲马多复合使用后。
疼痛刺激可引起细胞基因转录和蛋白质合成的变化,表现为外周伤害性刺激传入引起中枢神经元兴奋,其神经细胞基因表达迅速发生改变,这种基因称为早期或即刻反应基因,包括原癌基因如c-Fos、c-Jun等。当细胞受到外来刺激后,即刻反应基因c-Fos能快速表达,进而影响细胞功能,引起多种生理和病理改变。有研究发现,外周伤害性刺激或神经损伤可引起脊髓背角神经元c-Fos蛋白表达上调,突触形成长时程增强导致中枢敏化和疼痛形成及维持[10]。通过阻断脊髓和外周c-Fos蛋白表达可达到镇痛的目的[11]。研究发现,当纳洛酮与阿片类药物联用,可影响炎症激活的星形胶质细胞及其网络,对中枢敏化起抑制作用,缓解疼痛的产生和维持[12];同时,纳洛酮与阿片类药物联用可明显降低促炎性因子释放,两者合用不影响吗啡的镇痛效果,还可缓解吗啡耐受的形成[13,14],其机制可能与纳洛酮抑制兴奋性G蛋白偶联受体,促进突触兴奋性氨基酸的重摄取有关[15]。本研究结果显示,曲马多的镇痛作用以及纳洛酮与曲马多联用后的镇痛作用均与降低炎性疼痛大鼠脊髓背角c-Fos蛋白表达有关。
本研究中我们发现小剂量纳洛酮伍用曲马多的镇痛效果好于大剂量纳洛酮伍用曲马多,其原因考虑如下:外周伤害性损伤可刺激机体产生和释放内啡肽、脑啡肽等阿片类镇痛物质,但长时间或过量的阿片类镇痛药物可形成负反馈,引起阿片类物质释放减少,形成阿片耐受,降低其镇痛作用。小剂量纳洛酮可以阻断这种负反馈[16],促进曲马多的镇痛作用;大剂量纳洛酮主要通过对阿片类物质产生竞争性抑制,减弱与曲马多联用后产生的镇痛作用,且有引起短暂过敏反应的风险[17,18]。
综上所述,小剂量纳洛酮能更好地促进曲马多对炎性疼痛的镇痛作用,其机制与下调脊髓背角c-Fos蛋白表达有关。
参考文献:
[1] Vadivelu N, Chang D, Helander EM, et al, Ketorolac, oxymorphone, tapentadol, and tramadol: a comprehensive review[J]. Anesthesiol Clin, 2017,35(2):e1-e20.
[2] 孟馥芬,维拉,杨峰.曲马多伍用小剂量纳洛酮在术后镇痛中的应用效果[J].临床麻醉学杂志,2012,28(5):436-438.
[3] 胡柳青,宋苏沛,王振恒,等.低剂量纳洛酮对曲马多镇痛效应的影响[J].四川医学,2012,33(7):1169-1171.
[4] Zhuo M. Cortical plasticity as a new endpoint measurement for chronic pain[J]. Mol Pain, 2011,7(1):54.
[5] Miotto K, Cho AK, Khalil MA, et al, Trends in tramadol: pharmacology, metabolism, and misuse[J]. Anesth Analg, 2017,124(1):44-51.
[6] Mei XP, Chen L, Wang W, et al, Combination of tramadol with minocycline exerted synergistic effects on a rat model of nerve injury-induced neuropathic pain[J]. Neurosignals, 2013,21(3-4):184-196.
[7] Liu YM, Zhu SM, Wang KR, et al. Tramadol inhibits c-fos expression in spinal cord dorsal horn and serum IL-6 levels induced by plantar incision in rats[J]. Zhejiang Da Xue Xue Bao Yi Xue Ban, 2009,38(4):392-398.
[8] 张宏波.纳洛酮的临床应用[J].山东医药,2008,48(42):35.
[9] Gerard FE, Hansson E. Inflammatory activation enhances NMDA-triggered Ca2+signalling and IL-1beta secretion in primary cultures of rat astrocytes[J]. Brain Res, 2012(1473):1-8.
[10] Terayama R, Yamamoto Y, Kishimoto N, et al. Differential changes in neuronal excitability in the spinal dorsal horn after spinal nerve ligation in rats[J]. Neurochem Res, 2016,41(11):2880-2889.
[11] Hsieh MT, Donaldson LF, Lumb BM. Differential contributions of A-and C-nociceptors to primary and secondary inflammatory hypersensitivity in the rat[J]. Pain, 2015,156(6):1074-1083.
[12] Block L, Forshammar J, Westerlund A, et al, Naloxone in ultralow concentration restores endomorphin-1-evoked Ca(2)(+) signaling in lipopolysaccharide pretreated astrocytes[J]. Neuroscience, 2012(205):1-9.
[13] Lin SL, Tsai RY, Shen CH, et al, Co-administration of ultra-low dose naloxone attenuates morphine tolerance in rats via attenuation of NMDA receptor neurotransmission and suppression of neuroinflammation in the spinal cords[J]. Pharmacol Biochem Behav, 2010,96(2):236-245.
[14] 鲍杨,马丽敏,贺广宝,等.超低剂量纳洛酮对阿片类药物镇痛效能的影响及可能机制[J].医学与哲学,2015,36(4):70-71.
[15] Condes-Lara M, Martinez-Lorenzana G, Rubio-Beltran E, et al. Hypothalamic paraventricular nucleus stimulation enhances c-Fos expression in spinal and supraspinal structures related to pain modulation[J]. Neurosci Res, 2015(98):59-63.
[16] Imasogie NN, Singh S, Watson JT, et al. Ultra low-dose naloxone and tramadol/acetaminophen in elderly patients undergoing joint replacement surgery: a pilot study[J]. Pain Res Manag, 2009,14(2):103-108.
[17] Lynn RR, Galinkin JL. Naloxone dosage for opioid reversal: current evidence and clinical implications[J]. Ther Adv Drug Saf, 2018,9(1):63-88.
[18] Pereira MP, Werner MU, Dahl JB. Erratum to: ′Effect of a high-dose target-controlled naloxone infusion on pain and hyperalgesia in patients following groin hernia repair: study protocol for a randomized controlled trial′[J]. Trials, 2016,17(1):41.

