肌肽对人乳腺癌MDA-MB-231细胞迁移、侵袭的影响及机制
戴世龙,李浩,许博文,张青松
(华北理工大学附属开滦总医院,河北唐山063000)
肌肽即丙氨酰组氨酸,是一种内源性二肽。近年来多项研究发现,肌肽在体外动物及细胞实验中具有较强的抗肿瘤作用[1~4],但其对乳腺癌细胞恶性生物学行为的影响鲜见报道。转移相关蛋白1(MTA1)是肿瘤转移相关基因之一,与上皮源性恶性肿瘤细胞的转移、侵袭关系密切[5]。2016年10月~2017年2月,本研究观察了肌肽对人乳腺癌MDA-MB-231细胞侵袭、迁移及MTA1表达的影响,现分析结果并探讨其作用机制。
1 材料与方法
1.1材料人乳腺癌MDA-MB-231细胞由华北理工大学生物实验室保存。肌肽,VETEC公司;DMEM(高糖),CORNING公司;总RNA提取试剂盒,宁波市重鼎生物技术有限公司;RNA逆转录试剂盒,北京庄盟国际生物基因科技有限公司;Matrigel,美国Sigma公司;实时荧光定量PCR试剂盒(SYBRGreenⅠ法),日本TAKARA公司;兔抗人MTA1抗体,Abcom公司;鼠抗人β-actin抗体,台湾Arigo公司;辣根过氧化物酶标记的羊抗兔及羊抗鼠IgG(二抗),美国KPL公司。MTA1 引物由美国Invitrogen公司合成。
1.2细胞培养及干预将MDA-MB-231细胞置于含10% FBS的高糖DMEM培养基中,37 ℃、5% CO2孵育箱内培养至对数生长期。
1.3细胞迁移、侵袭能力检测
1.3.1细胞划痕实验将1.2中培养的细胞以0.25%胰酶消化;调整细胞密度为1×106个/mL接种于6孔板中,继续培养至细胞重新贴壁;待单层长满,弃去培养基,用无菌10 μL枪头在孔板底均匀间隔划6条直线,以无菌PBS清洗3次。将细胞随机分为三组,分别为50 mmol/L肌肽组、100 mmol/L肌肽组、对照组,前两组分别以含终浓度为50、100 mmol/L肌肽的培养基培养,对照组常规培养基培养;培养24 h时在倒置显微镜下观察划痕处细胞愈合情况并拍照,每组重复3次。以划痕愈合率评估细胞迁移能力。划痕愈合率=(0 h时划痕平均宽度-24 h时划痕平均宽度)/0 h时划痕平均宽度×100%。
1.3.2细胞迁移实验将Transwell小室置于24孔板中,DMEM水化1 h;取密度为1×106个/mL MDA-MB-231细胞100 μL种植于小室中,下室(24孔板内小室外)加入含20% FBS的DMEM 500 μL;参照1.3.1将细胞分组并处理,继续培养24 h;小心取出小室采用Giemsa染色液染色10 min,PBS清洗3次,棉球擦拭干净小室内膜细胞及小室周围残留染液,倒置显微镜下观察穿膜细胞数量并拍照。
1.3.3细胞侵袭实验将Transwell小室置于24孔板中,以1∶8稀释的Matrigel胶体100 μL包被Transwell上室,待其凝固后,吸除Matrigel 胶上析出的液体,DMEM水化1 h;取密度为1×106个/mL MDA-MB-231细胞100 μL种植于小室(上室)中,下室(24孔板内小室外)加入含20% FBS的DMEM 500 μL;参照1.3.1将细胞分组及处理,继续培养24 h;小心取出小室,Giemsa染色液染色10 min,PBS清洗3次,棉球擦拭干净小室内胶质上未侵袭的残留细胞,倒置显微镜下观察穿膜细胞数量并拍照。
1.4MTA1 mRNA及MTA1蛋白表达检测① MTA1 mRNA检测:采用实时荧光定量PCR法。将1.2中培养的细胞接种于6孔板,参照1.3.1分组及处理,培养24 h时按照RNA提取试剂盒说明书提取总RNA,参照RNA逆转录合成试剂盒说明书合成cDNA,以cDNA为模板行实时荧光定量PCR扩增。反应条件:95 ℃预变性180 s,95 ℃ 20 s、60 ℃ 30 s,40 个循环。MTA1 引物序列:上游5′-AAGACCACCGACAGATAC-3′,下游5′-GTTGTTGA-
CGCTGATTTG-3′。以β-actin 为内参照,采用2-ΔΔCt法计算MTA1 mRNA 相对表达量。每组设3个复孔,实验重复3次,以平均值为最终结果。② MTA1蛋白表达检测:采用Western blotting法。将1.2中培养的细胞接种于6孔板,参照1.3.1分组及处理,培养24 h时,使用裂解液RIPA与PMSF(200∶1)混合液提取各组蛋白,分光光度计检测蛋白浓度;蛋白与上样缓冲液按照体积比4∶1混合,100 ℃金属浴5 min;取适量处理后的蛋白样品进行SDS-PAGE凝胶电泳(200 V,30 min),15 V条件下电转15 min到NC膜,丽春红预染、洗涤;5%脱脂奶粉封闭6~8 h,弃去牛奶,加入MTA1一抗,4 ℃过夜;TBST洗涤3~5次,加入二抗室温孵育2 h;洗膜,15 min后显影,化学发光仪中显影并拍摄。采用Image J软件分析条带灰度值,以目的蛋白条带与内参(β-actin)条带灰度值之比表示目的蛋白的相对表达量。
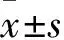
2 结果
2.1三组细胞迁移、侵袭能力比较对照组细胞划痕宽度愈合率、迁移及侵袭穿膜细胞数均高于50、100 mmol/L肌肽组,50 mmol/L肌肽组均高于100 mmol/L肌肽组,组间比较P<0.05或<0.01。见表1。
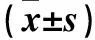
表1 三组细胞迁移、侵袭能力比较
注:与对照组比较,*P<0.01;与50 mmol/L肌肽组比较,△P<0.05。
2.2三组MTA1 mRNA和蛋白表达比较对照组MTA1 mRNA和蛋白相对表达量均低于50、100 mmol/L肌肽组,50 mmol/L肌肽组均低于100 mmol/L肌肽组,组间比较P<0.05或<0.01。见表2。
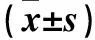
表2 三组MTA1 mRNA和蛋白相对表达量比较
注:与对照组比较,*P<0.01;与50 mmol/L肌肽组比较,△P<0.05。
3 讨论
化疗通常作为乳腺癌患者手术前后的辅助治疗或作为保守治疗方法应用于不能接受手术的患者,但有研究表明,化疗具有潜在的促进肿瘤转移的作用[6],其机制可能与化疗对耐药细胞和高侵袭性细胞的筛选作用以及诱导促转移因子表达有关[7~9]。
肌肽分子式为C9H14N4O3,相对分子量为226.24 bp,是一种生物体内内源性物质,存在于多数动物骨骼肌中。肌肽具有强烈的抗氧化作用,可作为自由基清除剂,具有螯合金属、抗衰老及促进伤口愈合等功能,被广泛应用于帕金森病、糖尿病、脑卒中、胃溃疡及老年性白内障等疾病的治疗[10]。研究发现,肌肽可抑制结肠癌、胶质母细胞瘤等肿瘤细胞增殖[1~4]。肌肽作为一种天然内源性二肽,不仅对正常细胞具有保护作用,而且具有杀伤肿瘤细胞的作用,是一种十分理想的抗肿瘤药物或作为其他化疗药物的辅助用药。肿瘤在人体内的转移能力与肿瘤细胞的迁移及侵袭能力密切相关,迁移及侵袭能力强则肿瘤易于转移,抑制迁移及侵袭能力则可以明显抑制肿瘤的转移。本研究细胞划痕实验和侵袭实验结果显示,肌肽可明显抑制MDA-MB-231细胞的迁移及侵袭能力,且100 mmol/L肌肽的效果好于50 mmol/L。
MTA1作为肿瘤转移相关基因家族的一员,在多种人类上皮源性肿瘤如乳腺癌、大肠癌、胰腺癌、食管癌、胃癌等细胞中高表达,与肿瘤的侵袭、转移能力紧密相关,且其表达水平与肿瘤临床病理分级、肿瘤侵袭能力呈正相关[11~13]。三阴性乳腺癌具有远处转移发生率高、侵袭能力强及缺乏HER2靶点等特点,患者预后差[14]。Jiang等[15]研究发现,利用RNA干扰技术抑制雌激素受体(ER)阴性MDA-MB-231细胞中MTA1表达可以增强ERα表达,干扰沉默MTA1表达后ERα表达明显上调,细胞株对雌激素拮抗剂的敏感性显著增强,且细胞的迁移、侵袭能力显著减弱。有研究指出,乳腺癌细胞MTA1可能通过合成MTA1细胞周期素依赖性蛋白激酶激活激酶(MTA1-CAK)复合物中的组蛋白去乙酰基酶复合物(HDAC),进而抑制CAK诱导ER激活的功能,阻滞ER介导的基因转录[16]。Sankaran等[17]报道,MTA1通过促进透明质酸介导的能动受体(HMMR)表达,进而促进乳腺癌细胞的迁移及侵袭。本研究结果显示,肌肽可抑制乳腺癌MDA-MB-231细胞MTA1 mRNA和蛋白表达,且作用具有剂量依赖性,提示肌肽可能通过下调MTA1表达而抑制肿瘤细胞的迁移及侵袭能力。鉴于肌肽具有抑制MDA-MB-231细胞迁移及侵袭的作用,其或许可以作为乳腺癌临床化疗药物的补充。但本研究未对肌肽调节MTA1表达的机制进行探讨,肌肽是否可通过抑制MTA1表达而增强ERα表达,进而提高乳腺癌对化疗药物的敏感性等问题均是未来研究的方向。
综上所述,肌肽可抑制乳腺癌MDA-MB-231细胞的迁移及侵袭,抑制MTA1表达可能是其作用机制。
参考文献:
[1] Holliday R, McFarland GA. Inhibition of the growth of transformed and neoplastic cells by the dipeptide carnosine[J]. Br J Cancer, 1996,73(8):966-971.
[2] Gaunitz F, Hipkiss AR. Carnosine and cancer: a perspective[J]. Amino Acids, 2012,43(1):135-142.
[3] Renner C, Asperger A, Seyffarth A, et al. Carnosine inhibits ATP production in cells from malignant glioma[J]. Neurol Res, 2010,32(1):101-105.
[4] Zhang Z, Miao L, Wu X, et al. Carnosine inhibits the proliferation of human gastric carcinoma cells by retarding Akt/mTOR/p70S6K signaling[J]. J Cancer, 2014,5(5):382-389.
[5] Nicolson GL, Nawa A, Toh Y, et al. Tumor metastasis-associated human MTA1 gene and its MTA1 protein product: role in epithelial cancer cell invasion, proliferation and nuclear regulation[J]. Clin Exp Metastasis, 2003,20(1):19-24.
[6] De Larco JE, Wuertz BR, Manivel JC, et al. Progression and enhancement of metastatic potential after exposure of tumor cells to chemotherapeutic agents[J]. Cancer Res, 2001,61(7):2857-2861.
[7] Cui W, Yazlovitskaya EM, Mayo MS, et al. Cisplatin-induced response of c-jun N-terminal kinase 1 and extracellular signal--regulated protein kinases 1 and 2 in a series of cisplatin-resistant ovarian carcinoma cell lines[J]. Mol Carcinog, 2000,29(4):219-228.
[8] Lee S, Yoon S, Kim DH. A high nuclear basal level of ERK2 phosphorylation contributes to the resistance of cisplatin-resistant human ovarian cancer cells[J]. Gynecol Oncol, 2007,104(2):338-344.
[9] Tornatore L, Thotakura AK, Bennett J, et al. The nuclear factor kappa B signaling pathway: integrating metabolism with inflammation[J]. Trends Cell Biol, 2012,22(11):557-566.
[10] 臧皓,李晓东,李丽,等.肌肽药理活性研究新进展[J].吉林中医药,2014(3):274-278.
[11] Toh Y, Pencil SD, Nicolson GL. Analysis of the complete sequence of the novel metastasis-associated candidate gene, mta1, differentially expressed in mammary adenocarcinoma and breast cancer cell lines[J]. Gene, 1995,159(1):97-104.
[12] Toh Y, Oki E, Oda S, et al. Overexpression of the MTA1 gene in gastrointestinal carcinomas: correlation with invasion and metastasis[J]. Int J Cancer, 1997,74(4):459-463.
[13] Iguchi H, Imura G, Toh Y, et al. Expression of MTA1, a metastasis-associated gene with histone deacetylase activity in pancreatic cancer[J]. Int J Oncol, 2000,16(6):1211-1214.
[14] Dent R, Trudeau M, Pritchard KI, et al. Triple-negative breast cancer: clinical features and patterns of recurrence[J]. Clin Cancer Res, 2007,13(15 Pt 1):4429-4434.
[15] Jiang Q, Zhang H, Zhang P. ShRNA-mediated gene silencing of MTA1 influenced on protein expression of ER alpha, MMP-9, CyclinD1 and invasiveness, proliferation in breast cancer cell lines MDA-MB-231 and MCF-7 in vitro[J]. J Exp Clin Cancer Res, 2011(30):60.
[16] Talukder AH, Mishra SK, Mandal M, et al. MTA1 interacts with MAT1, a cyclin-dependent kinase-activating kinase complex ring finger factor, and regulates estrogen receptor transactivation functions[J]. J Biol Chem, 2003,278(13):11676-11685.
[17] Sankaran D, Pakala SB, Nair VS, et al. Mechanism of MTA1 protein overexpression-linked invasion: MTA1 regulation of hyaluronan-mediated motility receptor (HMMR) expression and function[J]. J Biol Chem, 2012,287(8):5483-5491.

