LTBP4过表达对舌鳞状细胞癌细胞侵袭能力的影响及机制
顾杰林,李正华,叶翀
(贵港市人民医院,广西贵港537100)
舌鳞状细胞癌(简称舌鳞癌)的发生位置血管及淋巴管非常丰富,故肿瘤细胞易于转移[1,2],患者预后较差。细胞伪足的形成被认为是肿瘤细胞获得侵袭性的标志之一[3,4]。侵袭性伪足的功能主要为通过基质金属蛋白酶(MMP)家族降解细胞外基质,进而调控上皮细胞-间充质转化(EMT)[5]。已有文献证实,转化生长因子β(TGF-β)诱导的EMT过程能促进侵袭性伪足的形成和肿瘤转移[6]。潜伏转化生长因子β结合蛋白1(LTBP1)被认为是TGF-β诱导EMT通路中重要的调控因子。2017年1~10月,我们观察了LTBP4过表达对舌鳞癌细胞侵袭能力的影响,现分析结果,探讨LTBP4在舌鳞癌发生、发展中的作用。
1 材料与方法
1.1材料舌鳞癌细胞系TCA8113购自美国ATCC公司,DMEM与FBS购自美国Gibico公司,LTBP4、E钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)、锌指E盒结合蛋白1(ZEB1)、锌指蛋白(Slug)一抗购自美国Cell Signal Techology,二抗购自北京中杉金桥有限公司,TRIzol购自美国Invitrogen公司,Gelatin购自美国Thermo Fisher公司;Transwell小室购自美国Corning公司。质粒的构建由汉恒生物技术有限公司完成。
1.2CON与LTBP4过表达腺病毒构建CON质粒为空载穿梭pHBAd-CMV-IRES-GFP质粒。LTBP4 CDS序列首先使用PCR合成,模板为293t cDNA,引物序列为Sense: 5′-GTCGACACCGGTATGCCGAGGCCTGGCACCAG-3′,Antisense: 5′-GATAGAAAATAGGTGGTTTTTTAGCTATAGCTA-3′。在合成LTBP4后,首先克隆至pHBAd-CMV-IRES-GFP得到LTBP4-pHBAd-CMV-IRES-GFP穿梭质粒,将2 μg穿梭质粒、4 μg p-BHG(delta)E1,3 cre腺病毒基因组质粒转入接种于6 cm2平皿的293A细胞中,转染方式为Lipofectamine2000,步骤根据说明书进行。转染10天形成病毒空斑,挑起空斑移入新的平皿中,进行扩增,随后收集感染病毒细胞,反复冻融3次,裂解细胞得到第一代细胞;进一步扩增,待形成第四代细胞时行大量扩增(30个10 cm2平皿);随后反复冻融细胞得到病毒,使用氯化铯梯度离心法纯化腺病毒,2 000 r/min离心2 h,取2.0 mL 1.40 g/mL与3.0 mL 1.30 g/mL中间乳白色条带,加入透析袋中,4 ℃过夜,得到LTBP4过表达腺病毒。
1.3细胞培养及分组处理TCA8113细胞培养于37 ℃、5% CO2孵箱中,培养基为DMEM+10% FBS。培养24 h,将细胞分为对照组与LTBP4组,分别感染CON与LTBP4过表达腺病毒,感染复数(病毒数∶细胞数)为100 MOI,感染48 h,换液并行后续试验。
1.4相关指标观察
1.4.1细胞LTBP4蛋白表达采用Western blotting法。RIPA裂解细胞后,加入0.2倍体积的5×loading buffer,煮沸15 min后加入预制胶中,50 V电泳20 min,待marker分开时将电压加至120 V,恒压电泳至溴酚蓝跑到胶板底部,湿法将蛋白电转至PVDF膜;5%脱脂奶粉室温封闭2 h,加入LTBP4一抗(1∶200),4 ℃孵育过夜,PBS漂洗,加入二抗(1∶500),37 ℃孵育2 h,PBS漂洗3次,ECL液显色,计算各电泳条带灰度值。目的蛋白相对表达量=目的蛋白灰度值/GAPDH灰度值。结果显示,LTBP4组LTBP4 蛋白相对表达量为24.31±5.87,高于对照组的1.00±0.22(P<0.01),提示转染成功。
1.4.2细胞侵袭能力采用Transwell小室法。将两组细胞重悬于200 μL无血清培养基中,加入Transwell上室,同时在下室加入500 μL完全培养基(DMEM+10% FBS),12 h后上室正面使用PBS洗2遍,4%多聚甲醛固定30 min,风干Transwell小室,并使用0.1%结晶紫染色10 min,棉签拭去上室正面细胞,显微镜拍摄上室背面迁移细胞,使用Image J软件计数迁移细胞数。实验重复3次,取平均值。
1.4.3细胞基质降解能力采用基质胶降解实验。首先将200 μL 50 μg/mL多聚赖氨酸铺于激光共聚焦小皿,室温静置20 min;PBS洗2遍,加入200 μL 0.5%戊二醛,室温静置15 min;PBS洗2遍,加入200 μL Gelatin胶,室温静置15 min;加入200 μL 5 mg/mL四氢硼酸钠,PBS洗2遍后即得到Gelatin pig oregon green 488激光共聚焦小皿。两组细胞血清饥饿处理后,使用TGF-β(2 ng/mL)诱导24 h,4%多聚甲醛固定20 min,0.2% TRIton-X 100破膜,5% FBS室温封闭30 min,加入5 μg/mL Tritc-鬼笔环肽标记细胞骨架,加入DAPI标记细胞核。激光共聚焦显微镜观察基质胶降解情况,Image J软件计算基质胶的降解面积。
1.4.4细胞侵袭性伪足形成情况采用荧光共聚焦显微镜观察。将两组细胞铺于激光共聚焦小皿中,待细胞贴壁后,4%多聚甲醛固定,使用0.2% TRIon-X 100破膜,5% FBS封闭,加入兔抗cortactin抗体(1∶400),4 ℃孵育过夜,加入抗兔的绿色荧光标记二抗(1∶400),DAPI染核,PBS洗2遍,激光共聚焦显微镜观察两组细胞,以出现cortactin阳性颗粒作为出现侵袭性伪足的指标,计算侵袭伪足出现的细胞比例。
1.4.5E-cadherin、Vimentin、ZEB1、Slug蛋白表达采用Western blotting法。具体方法及结果计算均参照1.4.1。E-cadherin、Vimentin、ZEB1、Slug、GAPDH一抗浓度均为1∶200。
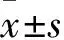
2 结果
2.1两组侵袭能力比较LTBP4组侵袭细胞数为(139±32)个,对照组为(343±49)个,组间比较P<0.01。
2.2两组基质降解能力比较LTBP4组基质胶降解面积为(412.4 ±72.1)μm2,对照组为(1 123±82.3)μm2,组间比较P<0.01。
2.3两组侵袭性伪足形成情况比较LTBP4组侵袭性伪足出现的细胞比例为(7.23±3.12)%,对照组为(18.24±2.31)%,组间比较P<0.01。
2.4两组E-cadherin、Vimentin、ZEB1、Slug蛋白表达比较见表1。
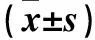
表1 两组E-cadherin、Vimentin、ZEB1、Slug蛋白相对表达量比较
注:与对照组比较,*P<0.05。
3 讨论
LTBP家族是一种EMT糖蛋白,其主要功能为结合TGF-β,促进TGF-β的正确组装及运输[5,6]。LTBP与TGF-β在经过特定的蛋白酶或其他因素解离后才能被活化[7,8]。LTBP家族最受关注的功能为通过与TGF-β结合调控TGF-β通路。LTBP包括1、2、3、4 四种蛋白,尽管四种蛋白的结构极为相似,但在肿瘤中的表达截然不同。其中,LTBP4主要在心肌、骨骼肌及平滑肌组织中高表达[9]。研究发现,LTBP4在人与小鼠乳腺肿瘤组织中低表达[10],通过调节TGF-β表达,参与肿瘤的发生、发展。但LTBP4与EMT通路及肿瘤细胞侵袭性之间的关系尚不明确。
本课题组前期研究发现,LTBP4在舌鳞癌组织中低表达,提示LTBP4低表达可能参与舌鳞癌的发生。本研究中我们首先构建了LTBP4过表达腺病毒,并用该病毒感染舌鳞癌细胞TCA8113,Western blotting检测结果显示LTBP4组LTBP4蛋白相对表达量显著升高,提示LTBP4过表达腺病毒成功感染舌鳞癌细胞。进一步通过Transwell检测发现,LTBP4过表达可抑制舌鳞癌细胞侵袭。既往文献报道,LTBP家族与EMT通路的关系密切[11]。E-cadherin、Vimentin、ZEB1、Slug均为EMT通路的关键因子,共同介导EMT过程。在EMT过程中,上皮表型标志物E-cadherin表达下调,间质表型Vimentin表达上调;ZEB1和Slug作为E-cadherin转录因子,可通过调控E-cadherin表达,进而调控EMT过程[12]。本研究结果显示,LTBP4过表达可促进E-cadherin蛋白表达,抑制Vimentin、ZEB1、Slug蛋白表达,提示LTBP4可抑制EMT过程。
在肿瘤转移过程中,强侵袭性的肿瘤细胞可通过侵袭性伪足降解细胞外基质从而实现转移[13]。LTBP4已被证实能够结合于细胞外基质中的TGF-β,从而调控TGF-β的功能[14]。本研究采用基质胶降解实验检测LTBP4过表达对细胞外基质降解能力的影响,结果LTBP4组基质胶降解面积显著降低,初步证实了LTBP4过表达TCA8113细胞的细胞外基质降解能力降低。进一步通过免疫荧光检测侵袭性伪足标记物cortactin表达,结果显示对照组中出现圆形粗大的cortactin阳性颗粒,并在细胞腹侧面聚集,即认为是侵袭性伪足[15];本研究LTBP4过表达组该类细胞显著减少,提示LTBP4在改变EMT通路的同时,能够通过影响舌鳞癌细胞侵袭性伪足的形成达到对细胞侵袭的调控。
综上所述,LTBP4过表达可抑制舌鳞癌细胞侵袭;调控EMT信号通路,抑制细胞外基质降解与侵袭性伪足的形成可能是其作用机制。
参考文献:
[1] Howard J, Masterson L, Dwivedi RC, et al. Minimally invasive surgery versus radiotherapy/chemoradiotherapy for small-volume primary oropharyngeal carcinoma [J]. Cochrane Database Syst Rev, 2016,11(12):CD010963
[2] O′Donnell RK, Feldman M, Mick R, et al. Immunohistochemical method identifies lymphovascular invasion in a majority of oral squamous cell carcinomas and discriminates between blood and lymphatic vessel invasion[J]. J Histochem Cytochem, 2008,56(9):803-810.
[3] Glogauer JE, Sun CX, Bradley G, et al. Neutrophils increase oral squamous cell carcinoma invasion through an invadopodia-dependent pathway[J]. Cancer Immunol Res, 2015,3(11):1218-1226.
[4] Hwang YS, Park KK, Chung WY. Epigallocatechin-3 gallate inhibits cancer invasion by repressing functional invadopodia formation in oral squamous cell carcinoma[J]. Eur J Pharmacol, 2013,715(1):286-295.
[5] Honda Y, Takigawa N, Ichihara E, et al. Effects of (-)-epigallocatechin-3-gallate on EGFR-or Fusion Gene-driven Lung Cancer Cells[J]. Acta Medica Okayama, 2017,71(6):505-512.
[6] Moustakas A, Heldin CH. Mechanisms of TGFβ-induced epithelial-mesenchymal transition[J]. J Clin Med, 2016,5(7):63.
[7] Bultmann-Mellin I, Dinger K, Debuschewitz C, et al. Role of LTBP4 in alveolarization, angiogenesis, and fibrosis in lungs[J]. Am J Physiol Lung Cell Mol Physiol, 2017,313(4):L687-L698.
[8] Wan F, Peng L, Zhu CY, et al. Knockdown of latent transforming growth factor-β (TGF-β)-binding protein 2 (LTBP2) inhibits invasion and tumorigenesis in thyroid carcinoma cells[J]. Oncol Res, 2017, 25(4): 503-510.
[9] Lamar KM, Bogdanovich S, Gardner BB, et al. Overexpression of latent TGFβ binding protein 4 in muscle ameliorates muscular dystrophy through myostatin and TGFβ[J]. PLoS Genet, 2016,12(5):e1006019.
[10] Kretschmer C, Conradi A, Kemmner W, et al. Latent transforming growth factor binding protein 4 (LTBP4) is downregulated in mouse and human DCIS and mammary carcinomas[J]. Cell Oncol, 2011,34(5):419-434.
[11] Chandramouli A, Simundza J, Pinderhughes A, et al. Ltbp1L is focally induced in embryonic mammary mesenchyme, demarcates the ductal luminal lineage and is upregulated during involution[J]. Breast Cancer Res, 2013,15(6):R111.
[12] Serrano-Gomez SJ, Maziveyi M, Alahari SK. Regulation of epithelial-mesenchymal transition through epigenetic and post-translational modifications[J]. Mol Cancer, 2016,15(1):18.
[13] 陈婷婷,于韶荣,曹海霞,等.外泌体在肿瘤侵袭转移中的促进作用研究进展[J].山东医药, 2016,56(23):106-108.
[14] Munger JS, Sheppard D. Cross talk among TGF-β signaling pathways, integrins, and the extracellular matrix[J]. Cold Spring Harb Perspect Biol, 2011,3(11):005017.
[15] 周家名,陈莉,王桂兰,等.沉默EMS1/cortactin 基因对肝癌HepG2细胞迁移、侵袭和细胞周期的影响[J].基础医学与临床,2016,36(12):1664-1669.

