DHEA对卵巢储备功能降低不孕患者妊娠结局的影响
经瑛,张翠莲
(郑州大学人民医院 河南省人民医院,郑州450003)
脱氢表雄酮(DHEA)是机体外周循环中最常见的甾体激素,主要是由肾上腺皮质网状带和卵巢卵泡膜细胞产生,是睾酮(T)和雌二醇(E2)生成的中间产物。雌二醇对女性生殖系统功能的正常维持发挥重要的调控作用。T可以通过与雄激素受体(AR)结合促进正常卵泡发育和非优势卵泡闭锁,调节卵泡颗粒细胞分泌的促卵泡激素(FSH)活性,是颗粒细胞分化和卵泡成熟的重要调节剂[1],但其对卵巢功能的影响仍存在争议。本研究探讨DHEA预处理对行体外受精-胚胎移植(IVF-ET)的卵巢储备功能降低(DOR)不孕患者妊娠结局的影响。
1 资料与方法
1.1临床资料选取2016年1月~2017年4月河南省人民医院收治的DOR不孕患者160例,年龄35~45(40.71±3.14)岁,BMI 18.5~23.9(21.73±1.34)。 纳入标准:①符合DOR诊断标准,即自然月经周期第2~3天,血清基础卵泡雌激素(bFSH)>10 IU/L或FSH/促黄体生成素(LH)>3∶2,且双侧卵巢窦卵泡总数(AFC)<10个。②不孕原因为女方输卵管梗阻、输卵管手术史等输卵管因素。③排卵障碍。④多次人工授精失败。⑤男方精液正常。排除标准:子宫内膜异位症;生殖器畸形;输卵管积水;行卵胞质内单精子显微注射(ICSI);高泌乳素血症;近3个月内应用激素类药物;有卵巢囊肿切除术或卵巢切除术史;内分泌及全身各系统疾病等。将患者随机分为联合组55例、DHEA组57例、VE组48例,三组年龄、BMI具有可比性。本研究经河南省人民医院伦理委员会批准通过,研究对象均签署知情同意书。
1.2治疗方法联合组:口服DHEA(美国GNC公司)25 mg/次、3次/d,维生素E 10 mg/次、3次/d,连用2个月经周期;DHEA组:口服DHEA 25 mg/次、3次/d,连用2个月经周期;VE组:口服维生素E 10 mg/次、3次/d,连用2个月经周期。三组结束上述2个月经周期治疗后均采用高孕激素状态下促排卵(PPOS)方案行IVF-ET[3]。具体方法:月经第2~4天开始使用安宫黄体酮片(MPA,2 mg/片)10 mg/d和尿促性素针225 IU/d至人绒毛膜促性腺激素(hCG)注射日(即扳机日),以促进卵泡与卵母细胞成熟。两种药物剂量在促排卵过程中保持恒定,根据卵泡直径、全血激素水平确定扳机时间。当成熟卵泡直径达18 mm或至少有2个卵泡直径达17 mm或3个卵泡直径达16 mm时,肌肉注射hCG 10 000 IU。注射后34~35 h进行阴道超声引导下取卵,随后给予黄体支持。取卵后第3天进行胚胎选择(Ⅱ级4细胞以上)及移植,最多移植2枚胚胎。移植后继续黄体支持至9~10周。
1.3相关指标观察①卵巢储备相关指标:患者均于治疗前和治疗2个月经周期后第1次月经的第2~3天抽取静脉血,检测血清FSH、LH、E2、T、抗苗勒氏管激素(AMH),计算FSH/LH;行阴道B超检查,记录AFC。②促排卵相关指标:统计两组Gn用量及其用药时间,hCG日E2、LH水平,以反映促排卵情况。③妊娠结局:随访12个月,统计两组获卵数、受精率、优质胚胎率、临床妊娠率、早期自然流产率、周期取消率。获卵数为卵巢穿刺获得卵子的数量;受精率=受精数/获卵数×100%;优质胚胎率=优质胚胎数/总胚胎数×100%;临床妊娠率=临床妊娠周期数/移植周期数×100%;早期自然流产率=早期自然流产周期数/临床妊娠周期数×100%;周期取消率=取消周期数/总周期数×100%。胚胎移植后28~30天超声下显示孕囊即为临床妊娠。
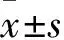
2 结果
2.1三组治疗前后卵巢储备相关指标比较见表1。
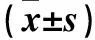
表1 三组治疗前后卵巢储备相关指标比较
注:与治疗前比较,*P<0.05。与VE组同时间点比较,△P<0.05。
2.2三组促排卵相关指标比较见表2。
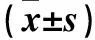
表2 三组促排卵相关指标比较
注:与VE组比较,*P<0.05。
2.3三组妊娠结局比较联合组获卵数为(4.56±3.98)个,DHEA组为(3.14±1.94)个,VE组为(2.95±1.71)个,联合组和DHEA组获卵数均高于VE组(P均<0.05)。联合组和DHEA组优质胚胎率、临床妊娠率均高于VE组,且联合组临床妊娠率高于DHEA组(P均<0.05)。见表3。

表3 三组妊娠结局比较(%)
注:与VE组比较,*P<0.05;与DHEA组比较,#P<0.05。
3 讨论
卵巢储备功能降低是>35岁女性不孕不育的常见原因。AFC是指早卵泡期阴道超声下测量直径2~10 mm的窦卵泡数目,是反映卵巢储备功能的直接指标。血FSH水平在临床上也常用于评价卵巢功能,但其波动性较大、反映卵巢功能具有延时性的局限。AMH是随年龄增长发生变化的卵巢功能评估指标,能在早期准确预测卵巢储备功能,而且AMH水平在月经周期内和周期间保持稳定。
DHEA是睾酮生物合成中的一个中间产物,具有较弱的雄性激素作用。有研究报道,DHEA可提高卵母细胞及胚胎的数量和质量,增加DOR患者妊娠率、降低流产风险[4,5];可提高高龄卵巢储备正常患者的优质胚胎率和AMH水平,改善妊娠结局[6,7]。一项双盲随机对照研究报道, 补充和未补充DHEA者卵巢AFC无明显变化,但补充组优质胚胎数量显著增加,原因可能为DHEA能够降低胚胎非整倍性[8,9]。Hassa等[10]对兔DOR模型(应用4-乙烯基环已烯双环氧化合物建立)给予DHEA干预,结果原始卵泡、初级卵泡、次级卵泡数量均有明显增加,卵泡闭锁情况有所改善。Narkwichean等[11]报道,DHEA可增加颗粒细胞增殖标记物Ki-67表达以及窦前卵泡和早卵泡期的AMH水平,促进卵泡生成,增加获卵数和卵母细胞质量。粘连蛋白作为细胞外基质的组成成分,一定程度上可反映细胞的功能。Chu等[12]报道,DHEA有可能通过抑制卵泡凋亡和减慢粘连蛋白水平降低的速度来增加老龄鼠的卵泡数量。有研究发现,DHEA可能通过上调AR、FSHR表达或直接与AR、FSHR 作用,进而转导T和FSH信号通路而发挥作用[13,14]。也有研究证明,DHEA能够有效减缓卵巢衰老[15],且对卵巢免疫反应具有重要的调控作用[16]。
维生素E作为一种抗氧化剂,能够在一定程度上改善胚胎质量。补充适量的维生素E可以改善母体孕期的健康状况,降低胎儿先天性缺陷、早产及低体质量等不良妊娠结局的发生率;可促进性激素分泌,使女性体内雌性激素水平升高,提高生育能力,预防流产[2];还能逆转活性氧诱导的胚胎发育毒性、降低氧化应激对生殖系统的损害,缓解某些物质对生殖系统发育的毒性作用,提高胚胎的正常发育率。但维生素E只有在一定的剂量范围内才能改善机体的生殖机能,剂量过高反而产生抑制作用,出现不良反应[9]。
本研究结果显示,单独使用DHEA或联合使用DHEA和维生素E均可改善DOR患者的卵巢储备功能,降低FSH,增加AFC和AMH,提高卵巢反应性,且效果均较单独使用维生素E更好。联合用药同样能够提高IVF受精率和临床妊娠率,且临床妊娠率高于单独应用DHEA。
综上所述,DHEA能改善DOR不孕患者的卵巢储备功能和IVF-ET的妊娠结局;维生素E作为人体必要营养素,适量添加有助于提高DHEA的上述作用。目前DOR不孕患者日益增多,DHEA联合维生素E可能广泛应用于辅助生殖领域,但是DHEA的作用机制及临床应用的有效性和安全性仍需进一步大样本、多中心研究来验证。
参考文献:
[1] Lenie S, Smitz J. Functional AR signaling is evident in an in vitro mouse follicle culture bioassay that encompasses most stages of folliculogenesis [J]. Biol Reprod, 2009,80(4):685-95.
[2] 王义.谈维生素E的作用[J].现代中西医结合杂志,2003,12(7):779-80.
[3] 张少娣,陈圆辉,王雪,等.高孕激素状态下促排卵方案(PPOS)与非典型微刺激方案在卵巢低反应患者体外受精-胚胎移植(IVF-ET)中的效果[J].生殖与避孕,2016,36(12):981-985.
[4] Gleicher N, Ryan E, Weghofer A, et al. Miscarriage rates after dehydroepiandrosterone (DHEA) supplementation in women with diminished ovarian reserve: a case control study[J]. Reprod Biol Endocrinol, 2009(7):108.
[5] Barad D, Brill H, Gleicher N. Update on the use of dehydroepiandrosterone supplementation among women with diminished ovarian function [J]. J Assist Reprod Genet, 2007,24(12):629-634.
[6] 梁琦,李静,崔薇.脱氢表雄酮预治疗对高龄卵巢储备正常患者体外受精-胚胎移植结局的影响[J].实用医学杂志,2015,31(24):4116-4119.
[7] Tartagni M, Cicinelli MV, Baldini D, et al. Dehydroepiandrosterone decreases the age-related decline of the in vitro fertilization outcome in women younger than 40 years old[J]. Reprod Biol Endocrinol, 2015,13:18.
[8] Yeung TW, Chai J, Li RH, et al. A randomized, controlled, pilot trial on the effect of dehydroepiandrosterone on ovarian response markers, ovarian response, and in vitro fertilization outcomes in poor responders[J]. Fertil Steril, 2014,102(1):108-115.
[9] 徐建平,周显青.维生素E对机体免疫、生殖和发育功能影响的研究进展[J].中国比较医学杂志,2006,16(8):4.
[10] Hassa H, Aydin Y, Ozatik O, et al. Effects of dehydroepiandrosterone (DHEA) on follicular dynamics in a diminished ovarian reserve in vivo model[J]. Syst Biol Reprod Med, 2015,61(3):117-121.
[11] Narkwichean A, Jayaprakasan K, Maalouf WE, et al. Effects of dehydroepiandrosterone on in vivo ovine follicular development[J]. Hum Reprod, 2014,29(1):146-154.
[12] Chu N, Gui Y, Qiu X, et al. The effect of DHEA on apoptosis and cohesin levels in oocytes in aged mice[J]. Biosci Trends, 2017,11(4):427-438.
[13] Gleicher N, Weghofer A, Barad DH. Dehydroepiandrosterone (DHEA) reduces embryo aneuploidy: direct evidence from preimplantation genetic screening (PGS)[J]. Reprod Biol Endocrinol, 2010,8:140.
[14] Hu Q, Hong L, Nie M, et al. The effect of dehydroepiandrosterone supplementation on ovarian response is associated with androgen receptor in diminished ovarian reserve women[J]. J Ovarian Res, 2017,10(1):32.
[15] Lin LT, Cheng JT, Wang PH, et al. Dehydroepiandrosterone as a potential agent to slow down ovarian aging [J]. J Obstet Gynaecol Res, 2017,43(12):1855-1862.
[16] Zhang J, Qiu X, Gui Y, et al. Dehydroepiandrosterone improves the ovarian reserve of women with diminished ovarian reserve and is a potential regulator of the immune response in the ovaries[J]. Biosci Trends, 2015,9(6):350-359.

