初花后短日照诱导对小豆形态、生理参数及产量的影响
董伟欣,尹宝重,魏 岩,张月辰*
(1.河北农业大学农学院,河北省作物生长调控重点实验室,河北保定 071001;2.河北广播电视大学,石家庄 050080)
小豆(Vigna angularis)生育期短,耐瘠、耐阴,适应性广,且高蛋白、低脂肪、医食同源,但是小豆落花落荚严重,产量较低且不稳定成为制约小豆发展的瓶颈问题,尤其开花后的自然灾害对小豆的成熟也具有非常重要的影响。小豆属于典型的短日照作物,研究证实小豆在初花前对光照的敏感性很强[1],开花后的光照条件对小豆的生长发育也至关重要。因此,初花后分时期进行短日照诱导来调控小豆的植株生长,叶片生理指标以及产量具有重要的研究价值。
短日照诱导使作物的生育期发生改变,形态学指标也随之发生改变。如短日照诱导使小豆的生育期缩短,花期提前,株高、茎粗和叶面积指数都降低,且表现为短日照诱导时间越长,降低就越多,但降低程度为晚熟品种>中熟品种[2];相关的大豆研究也发现[3],短日照诱导使大豆植株的株高降低,主茎节数、分枝数和出生叶片数减少。短日照诱导会影响植株的生长并导致一系列生理参数发生变化:在短日照诱导下小麦旗叶的叶绿素a和叶绿素b含量增加,但叶绿素a/b的比值降低[4];花生叶片净光合速率、气孔导度、细胞间隙CO2浓度会随着日照缩短而显著降低[5];短日照还会诱导大豆功能叶片中的蛋白质含量显著降低[6];同样使水稻籽粒内蔗糖和淀粉含量随着日照缩短而均呈现显著的降低趋势[7];短日照诱导使黄瓜中POD酶活性升高[8];短日照会使紫花苜蓿叶片内的IAA、GA3、ZR含量逐渐减少,而ABA含量逐渐增加[9]。因此,光照是作物产量的重要来源,光照强弱直接影响籽粒产量。如花前短日照诱导使薏苡的单荚粒重和单株粒重都明显降低,降低程度因品种而异[10];对大豆的研究也发现,开花后短日照诱导使开花节位下降,花荚数量减少,产量降低[11],说明开花后的光照长度对大豆干物质积累和产量形成作用的意义重大。
从以上研究可以看出,在其他作物上,开花前后通过短日照处理都有相关报道,但对于小豆初花后通过短日照诱导的研究却尚未见报道。因此,本研究采用晚熟品种唐山红小豆作为试验材料,在初花后分时期进行短日照诱导,旨在阐明初花后短日照诱导对小豆植株的生长、叶片生理及产量形成的影响,为花后小豆的管理及高产优质栽培提供理论参考。
1 材料和方法
1.1 试验材料
本试验于2014—2015年在保定河北农业大学教学实验基地进行(河北省保定市,经度和纬度分别为 115°28′E 和 38°52′N),以 2015 年试验结果为准,选用晚熟品种唐山红小豆作为试验材料(由河北省农林科学院粮油作物研究所提供)。
1.2 试验设计
本试验设置10 h光/14 h暗和12 h光/12 h暗2种日照长度,文中光照时间分别用10 hL和12 hL表示,分别在初花-初荚(early flowering-early podding,EF-EP)、初荚-初粒(early podding-early seed,EPES)和初花-初粒(early flowering-early seed,EF-ES)3个时期进行短日照处理,以自然光(试验季节自然光大约每天的光照时间为14.5 h)作为对照(CK)。
6月24日播种,7月2号出苗,短日照处理方法是每天18∶00和19∶00点用不透明的布遮光,次日早晨8∶00和7∶00揭开。小区排列采用随机区组排列,小区面积5 m×1 m,每个小区种植2行,行距40 cm,株距15 cm,3次重复,短日照结束后在自然条件下生长至成熟,整个生育期间的管理同生产大田。
1.3 试验方法
1.3.1 取样方法
分别在盛花期、盛荚期和鼓粒期,于上午8∶00采取自上数第2片完全展开的叶片测定生理指标。
1.3.2 叶片生理指标测定
①叶绿素含量的测定[12]。
于上午8∶00采取自上数第2片完全展开的叶片,测定时称取0.1 g叶片,用95%乙醇避光提取48 h将叶绿素抽提完全后,将抽提液分别在470 nm、649 nm和665 nm波长下比色。
②可溶性蛋白含量测定[13]。
称取0.1 g样品,放入5 mL蒸馏水中充分研磨,转移至离心管离心5 min,吸取上清液1 mL于试管中后加入5 mL考马斯亮蓝,595 nm处测定OD值。
③可溶性糖含量测定[14]。
称取叶片鲜样0.5 g,加85%乙醇5 mL研磨成匀浆,转移至离心管中。80℃水浴浸提10 min,冷却后离心5 min。将上清液倒入25 mL容量瓶中,用85%乙醇定容至刻度。从容量瓶中取2.5 mL,80℃蒸干,加入5 mL蒸馏水搅拌,离心后取上清液0.5 mL+1.5 mL蒸馏水+5 mL硫酸蒽酮试剂,混匀,在100℃沸水浴中加热10 min,冷却后620 nm比色测定。
④SOD酶活性测定[15]。
称取新鲜植物材料0.5 g于预冷的研钵中,加1 mL磷酸缓冲液磨成匀浆,于4℃ 10 000 r/min下离心10 min。取透明青霉素小瓶,加入50 μL的酶提取液再加50 μL核黄素,立即置于4000LX的荧光灯下进行光还原反应,15 min后,用黑纸遮光,终止反应,在560 nm波长下比色测定OD值。
⑤POD酶活性测定[12]。
取2.9 mL POD反应液+0.1 mL酶液于小管中,充分混匀后,在34℃恒温水浴中反应3 min,然后加20%三氯乙酸20 μL,终止酶活性,已加入反应液3 mL,20 mmol/L KH2PO41 mL作为调零管,在470nm波长下测其光密度。
⑥激素含量的测定[16]。
称取0.5 g新鲜植物材料,加2 mL样品提取液,在冰浴下研磨成匀浆,转入10 mL试管,再用2 mL提取液分次将研钵冲洗干净,一并转入试管中,摇匀后放置在4℃冰箱中,用酶联免疫法测定。
⑦叶片光合生理参数的测定。
选取展开复叶的中间叶片,采用LI-6400光合仪(型号:LI-COR LI-6400XT,产地:美国)在光照达到1400LX时测定净光合速率(Pn)和蒸腾速率(Tr)。
1.3.3 小豆植株生长及产量指标调查
在盛花期、盛荚期和鼓粒期,每个处理选取具有代表性植株9株,分别测定株高、茎粗、叶面积和地上部干重。株高指植株真叶处至生长点的距离;茎粗用游标卡尺测量真叶处植株的直径,再折算成周长。周长=2×3.14×(直径/2);叶面积采用 YMJ-B 叶面积测量仪(产自杭州汇尔仪器设备有限公司)测定;将植株的地上部置于烘箱内105℃杀青30 min后在80℃下烘干至恒重后称重。在成熟期测定小区产量和产量构成因素。
1.4 数据分析
采用Microsoft Excel 2007整理数据并作图,利用SPSS 17.0数据处理软件在α=0.05水平上进行Duncan新复极差法方差分析及多重比较。
2 结果与分析
2.1 初花后短日照诱导对小豆植株形态及地上部干物质积累的影响
由图1可知,初花后短日照诱导使唐山红小豆的株高、茎粗、叶面积和地上部干重降低,3种处理相比较,EF-ES最多,EF-EP次之,EP-ES降低最少,10 h较12 h降低较多。
株高在盛花期10 h下的3个处理较对照都明显降低,12 h下EF-ES处理显著降低21.53%,盛荚期和鼓粒期在10 h下的3个处理都显著降低,但12h下降低不明显(见图1a)。茎粗在盛荚期10h下的EFEP和EF-ES处理较对照分别显著降低11.65%和17.23%,12 h下的EF-ES显著降低13.25%,鼓粒期只有 EF-ES(10 hL)和 EF-ES(12 hL)处理显著降低20.73%和19.83%,其余处理无显著影响(见图1b)。
叶面积在盛花期的 EF-EP(10 hL)、EF-ES(10 hL)和EF-ES(12 hL)处理下较对照分别显著降低12.68%、18.83%和21.65%,盛荚期在10 h下的3个处理都显著降低,12 h下EF-ES处理显著降低24.39%,鼓粒期只有EF-ES(12 hL)较对照显著降低20.26%,其余处理对叶面积的影响不明显(见图1c)。地上部干重在盛花期较对照稍有降低,盛荚期EF-ES(10 hL)处理显著降低39.23%,鼓粒期10 h下EF-EP和EF-ES处理降低22.08%和40.97%,12h下EF-ES处理降低31.61%,由此可见,EF-ES期处理使2个小豆品种地上部干重降低幅度较大且在10 h下降低较多(见图1d)。
2.2 初花后短日照诱导对小豆叶片生理参数的影响
2.2.1 对小豆叶片叶绿素含量及叶绿素a/b比值的影响
由表1可见,初花后短日照诱导使唐山红小豆的叶绿素含量总体呈现降低,而叶绿素a/b呈现升高趋势。叶绿素含量在盛花期的EF-EP(10 hL)和EF-EP(12 hL/12 hD)处理下较对照升高,其余处理都降低,盛荚期和鼓粒期上述参数都呈现降低趋势。叶绿素含量的变化会影响叶绿素a/b比值的波动,盛花期的 EF-ES(10 hL/14 hD)、EP-ES(12 hL/12 hD)和EF-ES(12 hL/12 hD)处理较对照分别显著升高22.40%、21.58%和24.75%,而在盛荚期和鼓粒期光合色素的升高程度都达显著差异。
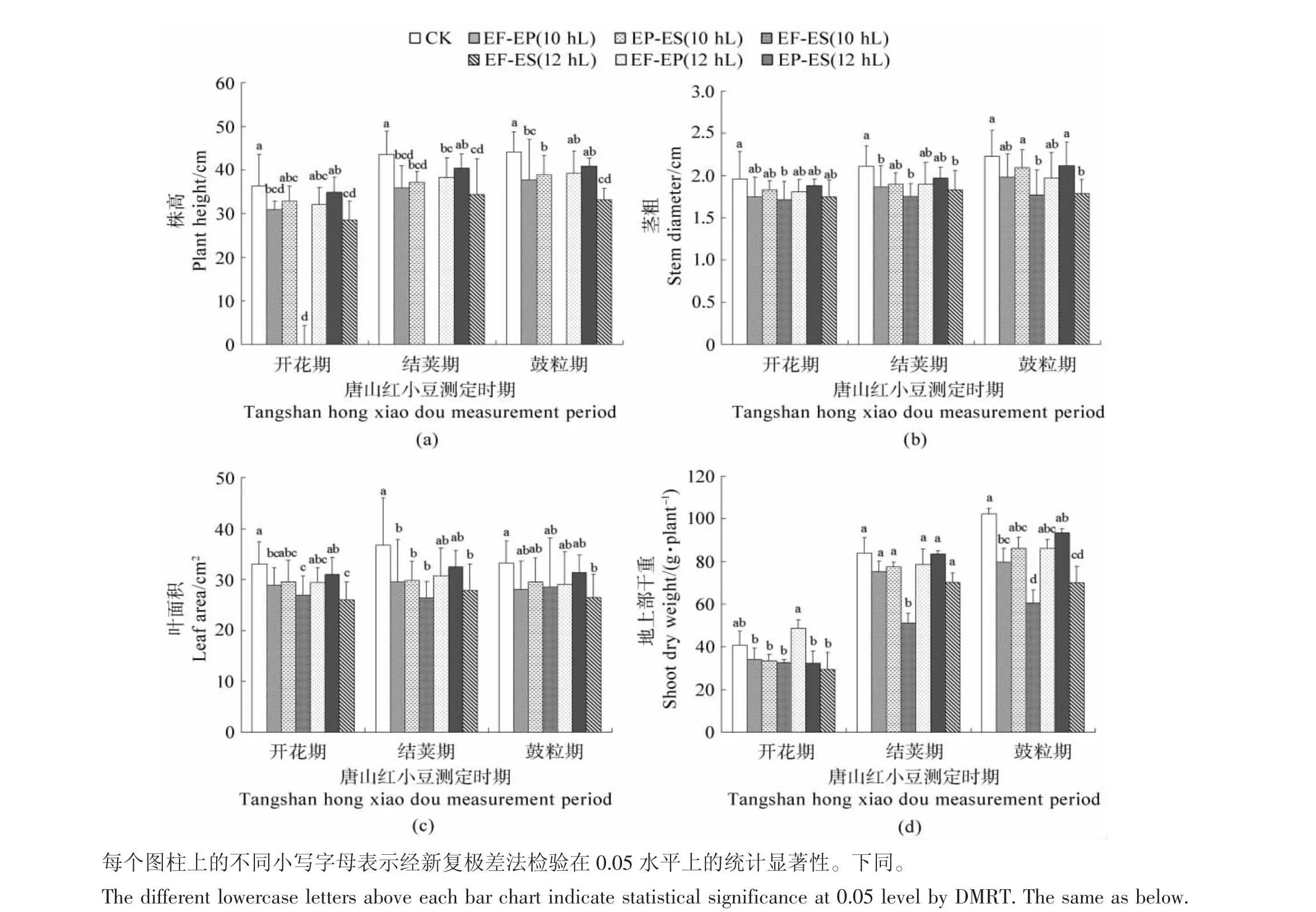
图1 初花后短日照诱导对小豆株高、茎粗、叶面积和地上部干重的影响Figure 1 Effects of short-day photoperiod inducement after early flowering on plant height,stem diameter,leaf area and shoot dry weight in adzuki bean
2.2.2对小豆叶片净光合速率(Pn)和蒸腾速率(Tr)的影响
由表2可见,初花后短日照诱导使唐山红小豆的Pn和Tr从盛花期至鼓粒期逐渐降低。Pn在盛花期、盛荚期和鼓粒期的各个处理较对照都呈现下降趋势,但差异都未达到显著水平,短日照诱导时间越长,降低就越多。Tr的变化与Pn类似,降低Pn的同时,也降低了Tr,盛花期和鼓粒期都呈现降低趋势,盛荚期在2种短日照诱导条件下的EP-ES处理稍有升高,EF-EP和EF-ES处理降低,上述参数的差异都未达到显著水平。
2.2.3 对小豆叶片可溶性蛋白和可溶性糖含量的影响
由图2可知,可溶性蛋白含量在盛花期的EFES(10 hL)和 EF-ES(12 hL)处理下较对照显著降低16.96%和10.69%,其余处理降低不显著。盛荚期EP-ES(10 hL)和 EP-ES(12 hL)处理较对照显著升高18.74%和13.56%,其余处理降低不显著,而在鼓粒期的各个处理较对照都显著降低(图2a)。可溶性糖含量在盛花期和盛荚期呈现降低趋势,但较对照都为达到显著差异,鼓粒期10 h下的3个处理都显著升高,12 h下的EP-ES处理较对照显著升高22.35%,而EF-EP和EF-ES处理升高程度都未达到显著差异(图2b)。
2.2.4 对小豆叶片SOD和POD酶活性的影响
由图3可知,初花后短日照诱导使唐山红小豆的SOD和POD酶活性呈降低趋势,但在不同的时期
稍有差异。盛花期的SOD酶活性在EF-EP(10 hL)和EP-ES(10 hL)处理下较对照稍有升高,其余处理都降低,在盛荚期有一定程度的降低,差异都未达到显著水平,鼓粒期12 h下的EF-EP和EP-ES处理使SOD活性分别降低21.39%和34.43%(见图3a)。盛花期的POD酶活性在EF-EP(10 hL)、EF-ES(10 hL)和EF-ES(12 hL)处理下较对照分别显著降低18.11%、17.53%和22.16%,盛荚期和鼓粒期在10 h下较对照无明显变化,在12 h下的3个处理较对照都显著降低(见图3b)。
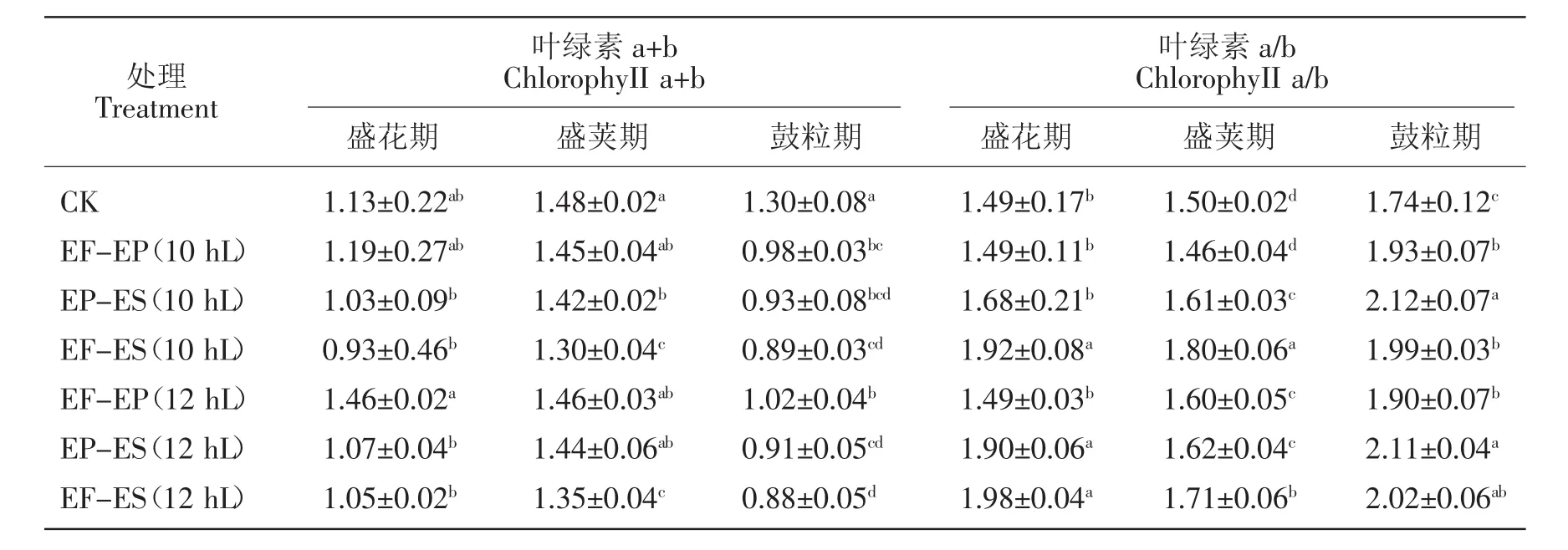
表1 初花后短日照诱导对小豆叶绿素a+b和叶绿素a/b比值的影响Table 1 Effects of short-day photoperiod inducement after early flowering on chlorophyII a+b and chlorophyII a/b in adzuki bean mg·g-1
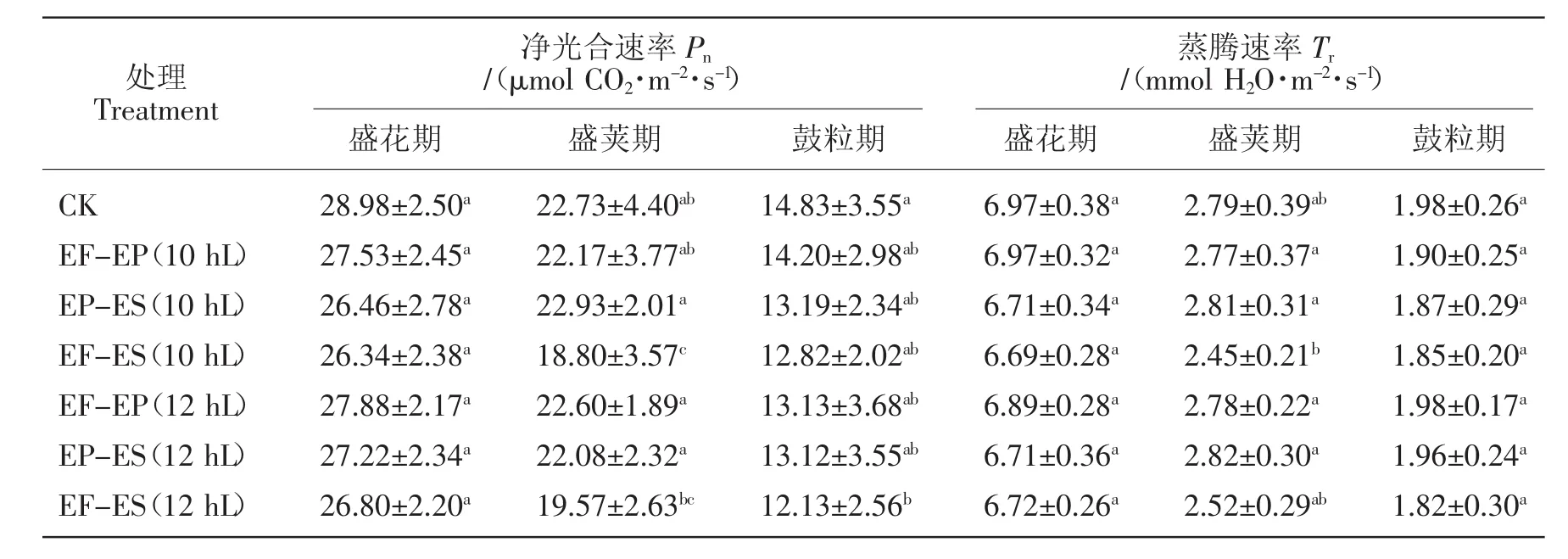
表2 初花后短日照诱导对小豆净光合速率(Pn)和蒸腾速率(Tr)的影响Table 2 Effects of short-day photoperiod inducement after early flowering on Pnand Trin adzuki bean

图2 初花后短日照诱导对小豆可溶性蛋白和可溶性糖含量的影响Figure 2 Effects of short-day photoperiod inducement after early flowering on soluble protein and soluble sugar content in adzuki bean

图3 初花后短日照诱导对小豆SOD和POD酶活性的影响Figure 3 Effects of short-day photoperiod inducement after early flowering on SOD and POD in adzuki bean
2.2.5 对小豆叶片GA1+3和ABA含量的影响
由表3可知,初花后短日照诱导使唐山红小豆的GA1+3和ABA含量在盛花期和盛荚期较对照都显著降低,鼓粒期有所差异,GA1+3含量在EF-EP(10 hL)和EF-EP(12 hL)处理下降低不明显,其余处理都显著下降,而ABA含量在10 h下的3个处理分别升高6.73%、13.64%和18.07%,12 h下3个处理分别降低13.16%、8.96%和5.14%。
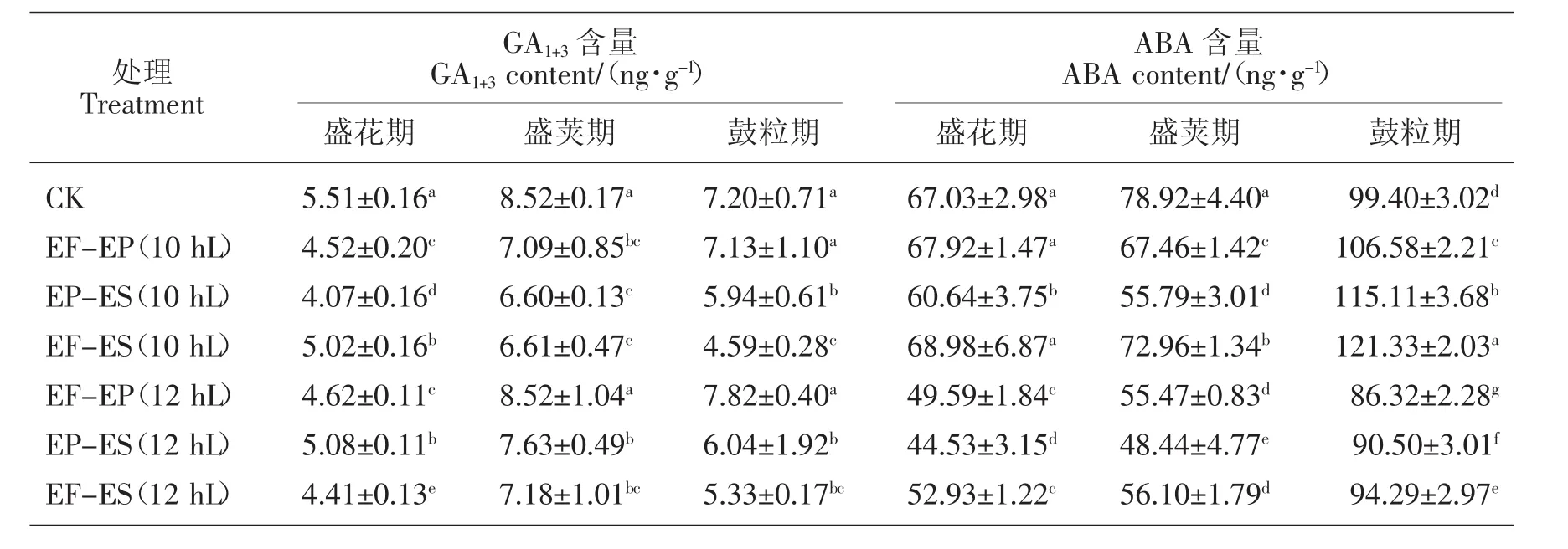
表3 初花后短日照诱导对小豆GA1+3和ABA含量的影响Table 3 Effects of short-day photoperiod inducement after early flowering on GA1+3and ABA in adzuki bean
2.3 初花后短日照诱导对小豆产量构成因素及小区产量的影响
由表4可知,初花后短日照诱导使唐山红小豆的产量构成因素及小区产量呈现降低趋势,10 h较12 h降低较多且短日照诱导时间越长,降低就越多。单株粒重和小区产量较对照降低不明显,单株荚重在 EF-ES(10 hL)和 EF-ES(12 hL)处理下显著降低33.83%和26.83%,单荚重和单荚粒数在EFEP(10 hL)和 EF-ES(10 hL)处理下显著降低 15.22%和17.39%、13.15%和17.25%,单荚粒重只有在EFES(10 hL)处理下较对照降低14.77%外,其余处理都未达到显著水平。
3 讨论与结论
3.1 初花后短日照诱导对小豆植株生长及干物质积累的影响
光照作为外界环境中主要的影响因子,对作物的生长和物质积累起着至关重要的作用。水稻在插秧至幼穗分化期短日照处理使叶面积指数显著降低[17]。而花铃期短日照诱导可以使中棉所49号和新陆早36号植株地上部各器官的干物质积累有不同程度的降低[18]。另有研究表明,延长光照使茄子幼苗的生长速率加快,株高和茎粗增加,同时根冠比和壮苗指数提高,产量也提高[19]。本研究发现,初花后不同时期短日照诱导使小豆的株高、茎粗、叶面积降低,10 h较12 h下降较多,且EF-ES处理降低最多,EF-EP次之,EP-ES处理降低最少,同时,干物质积累也受到明显影响,且短日照诱导时间越长,降低就越多,这与前人的研究结果相一致[2,20]。这一结果说明初花后不同时期短日照诱导可促进物质向到籽粒中迅速转移,具有促进成熟的效果。该效应造成产量降低,是否如大豆一样在初花后适当延长光照,可积累较多的干物质来提高产量值得进一步深入研究。
3.2 初花后短日照诱导对小豆生理参数的影响
开花后是籽粒生长的主要时期,而开花后的光合特性直接关系到同化产物的多少和分配,也会影响作物的产量。生育后期对玉米进行短日照诱导后叶片的ChII(a+b)降低,同时Pn较对照也降低,Ci显著升高[21]。小麦在拔节至成熟期短日照诱导后可使小麦旗叶的Pn降低[22]。在开花后对小麦进行短日照诱导后小麦旗叶的Pn降低,同化产物减少[23]。本研究发现,初花后短日照诱导使唐山红小豆的叶绿素含量降低,同时,Pn和Tr较对照也呈现下降趋势,这可能是初花后短日照诱导使小豆叶片的光合能力降低,小豆植株对光照的利用能力增强,同时导致Gs下降而引起Tr降低。短日照时间越长,Pn降低就越多,对籽粒库容的影响就越大,而此时期叶片逐渐衰老,叶片恢复功能减弱,所以同化能力也降低,对产量造成不利影响。本研究还发现初花后短日照诱导使叶片的可溶性蛋白和糖含量降低,因为短日照诱导后暗期变长导致光照不足,使叶片加速衰老,促使营养物质迅速转移到果荚中。
短日照诱导影响作物的酶活性,玉米叶片在短日照诱导后的SOD、POD和CAT酶活性显著降低,而MDA酶活性却增加,生物膜保护系统受到破坏,细胞内的有机物质外渗[24]。本研究发现,初花后短日照诱导使小豆叶片的保护酶SOD和POD呈现降低趋势。本研究另外发现,在12 h下酶活性降低较多且短日照诱导时间越长,降低就越多,说明伴随着植株的不断衰老,在短日照诱导后植株的代谢能力缓慢,自我调节能力下降,抗氧化酶的能力降低,细胞膜透性加强,植株提前成熟,但其内部机理非常复杂,有关短日照诱导时期及处理调控小豆的生化代谢机制仍有待进一步探讨。
环境条件改变会引起激素含量及比例的变化,其中,日照长度是影响激素的含量及动态平衡的重要环境因子。短日照诱导使水稻叶片内的ABA含量增加,GA3含量逐渐减少[25]。利用短日照诱导处理菊花也得到了相同的结果[26]。本研究发现,初花后短日照诱导使小豆叶片的GA1+3和ABA含量都呈现降低趋势,这与前人研究稍有不同,本研究中初花后短日照诱导使ABA的含量降低,可能由于初花后在ZR含量高而促进GA1+3的合成,从而使ABA含量降低有关。在初花后短日照诱导使小豆植株保持细胞分裂旺盛,生长迅速,营养物质快速转移至果荚中,调控小豆植株提前成熟和衰老且激素之间的比例和平衡影响小豆生长发育的机理仍有待进一步研究。
3.3 初花后短日照诱导对小豆产量的影响
初花后短日照诱导对作物产量和籽粒品质有明显的影响。在抽穗期进行短日照诱导使水稻的穗重降低了45%左右,同时也降低了向穗部分配干物质能力,抽穗后短日照诱导使水稻的产量降低主要是因为结实率和千粒重显著降低所致[27]。另有研究也发现,在花粒期对玉米进行短日照诱导使玉米的产量降低最多[28]。本研究发现,在初花-初荚(EF-EP)、初荚-初粒(EP-ES)和初花-初粒(EF-ES)期进行10 h和12 h的短光照后小豆的产量构成因素和小区产量都呈现降低趋势且在EF-ES处理下降低最多,10h较12 h下降低较多,与前期短日照诱导相比较,在初花后短日照诱导对小豆的产量影响较大,尤其在初花-初粒(EF-ES)期光照越短,产量降低越多。这与前人研究结果相一致,原因可能是此时期短日照诱导影响小豆鼓粒期营养物质的积累所致。但由于不同作物品种间存在差异,可能与不同作物对光照的敏感度不同有关。
参考文献:
[1]蒋陵秋,金文林.小豆生长发育规律的研究Ⅷ小豆短日处理的效应[J].北京农学院学报,1991,6(1):22-27.
[2]尹淑丽,张月辰,陶佩君,等.苗期日照长度对红小豆生育特性和产量的影响[J].中国农业科学,2008,41(8):2286-2293.
[3]张桂茹.光周期对大豆品种生育进程及农艺性状的影响[J].中国油料作物学报,1997,19(4):37-41.
[4]郭翠花,高志强,苗果园.花后遮阴对小麦旗叶光合特性及籽粒产量和品质的影响[J].作物学报,2010,36(4):673-679.
[5]张昆,万勇善,刘风珍.苗期弱光对花生光合特性的影响[J].中国农业科学,2010,43(1):65-71.
[6]宋艳霞,杨文钰,李卓玺,等.套作遮荫对大豆不同品种苗期氮代谢的影响[J].中国油料作物学报,2010,32(3):390-394.
[7]李天,大杉立,山岸徹,等.灌浆结实期弱光对水稻籽粒淀粉积累及相关酶活性的影响[J].中国水稻科学,2005,19(6):545-550.
[8]文明玲,牛应泽,刘小俊,等.光周期处理对黄瓜花性分化及其氧化酶活性影响[J].长江蔬菜,2007(4):46-49.
[9]吴鹏举.光周期对不同秋眠类型紫花苜蓿phyA、phyB、mRNA和植物激素含量的影响[D].郑州:河南农业大学,2011.
[10]姚凤娟.光周期和播种期对薏苡生长发育及其产量的影响[D].雅安:四川农业大学,2005.
[11]KARMAKA P G,TIWARI S P,KUMAR V.Seed-filling duration and height of insertion of the lowest pod in Indian soybean varieties[J].Soybean Genetics Newsletter,1994(21):104-107.
[12]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:21-22.
[13]READ S M,NORTHCOTE D H.Minimization of variation in the response to different proteins of the Coomassie blue G dye-binding assay for protein[J].Anal Biochem,1981,116(1):53-64.
[14]白宝璋,靳占忠,李存东.植物生理学试验教程[M].中国农业科技出版社,1996:61-62.
[15]韩胜芳,邓若磊,徐海荣,等.缺磷条件下不同磷效率水稻品种光合特性和细胞保护酶活性[J].应用生态学报,2007,18(11):2462-2467.
[16]何钟佩.农作物化学控制实验指导[M].北京:北京农业大学出版社,1992:13-14.
[17]蔡昆争,骆世明.不同生育期遮光对水稻生长发育和产量形成的影响[J].应用生态学报,1999,10(2):193-196.
[18]侍伟红.花铃期遮光对棉花产量、品质及光合生理特性的影响[D].乌鲁木齐:新疆农业大学,2012.
[19]陈敏,李海云.不同光周期对茄子幼苗生长的影响[J].北方园艺,2010(16):53-55.
[20]尹宝重,陶脯,张月辰.短日照对不同叶龄红小豆幼苗的诱导效应[J].作物学报,2011,7(8):1475-1484.
[21]贾士芳.生育后期遮光对玉米产量和品质及生理特性的影响[D].泰安:山东农业大学,2007.
[22]牟会荣,姜东,戴廷波,等.遮阴对小麦旗叶光合及叶绿素荧光特性的影响[J].中国农业科学,2008,41(2):599-606.
[23]贺明荣,王振林,高淑萍.不同小麦品种千粒重对灌浆期弱光的适应性分析[J].作物学报,2001,27(5):640-644.
[24]张烈.玉米不同基因型耐密、耐荫、耐瘩特性及遗传相关研究[D].泰安:山东农业大学,2001.
[25]杨世民.杂交水稻对生态环境和弱光胁迫的适应性研究[D].雅安:四川农业大学,2011.
[26]林贵玉,郑成淑,孙宪芝,等.光周期对菊花花芽分化和内源激素的影响[J].山东农业科学,2008(1):35-39.
[27]姜楠.遮光对北方粳稻产量和品质的形成及其生理机制的研究[D].沈阳:沈阳农业大学,2013.
[28]张吉旺.光温胁迫对玉米产量和品质及其生理特性的影响[D].泰安:山东农业大学,2005.

