酶法辅助提取黑果枸杞花色苷工艺优化
郑覃,王青霞,李建颖
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津300134)
黑果枸杞(Lycium ruthenicum Murr.)是一种枸杞属(Lycium)茄科(Solanceae)的多年生灌木野生荒漠植物。黑果枸杞果实在成熟后呈近球形,为蓝紫色,富含花色苷类色素,远远高于其他有色果实[1]。花色苷是花青素与糖以糖苷键结合而成的一类化合物,是一种天然的抗氧化剂[2],其抗氧化活性远强于维生素C、维生素E等[3-4],因其结构上含有的众多酚羟基能够阻断自由基链式反应,从而有效清除活性氧簇(Reactive Oxygen Species,ROS)[5-6]。目前国内研究大多采用溶剂提取的方法对黑果枸杞中的花色苷进行提取[7],采用生物酶辅助提取黑果枸杞花色苷的研究还相对较少。由于花色苷存在于细胞内或吸附在由纤维素组成的细胞壁上,常规方法提取花色苷很难获得较高的提取率,果胶酶可以破坏细胞壁,使花色苷得到充分的释放[8],且生物酶的反应条件相对温和,更加有助于花色苷这种光敏、热敏性物质的提取[9-12]。本试验采用果胶酶辅助乙醇提取黑果枸杞中花色苷,在单因素的基础上,利用响应面试验设计,优化出最佳提取工艺条件,这对黑果枸杞花色苷的开发利用及工业化生产具有重要意义。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
黑果枸杞干果:甘肃省民勤县;果胶酶(酶活力500 U/mg):上海源叶生物科技有限公司;乙醇(AR):天津市凯通化学试剂有限公司;盐酸(AR):天津市风船化学试剂科技有限公司;冰乙酸(AR):天津大学科威公司;醋酸钠(AR):天津市德恩化学试剂有限公司;氯化钾(AR):天津光复科技发展有限公司。
1.1.2 仪器
BSA224S-CW分析天平、PB-10pH计:德国Sartorius;RV10DIGITAL 旋转蒸发仪:德国 IKA;UV-2600紫外可见分光光度计:日本Shimadzu;Spex 6875冷冻研磨仪:美国Spex;Heraguard ECO超净工作台:美国Thermo;DK-8AS电热恒温水浴锅、DH-101电热鼓风干燥箱:上海精密科学仪器有限公司;SHB-Ⅲ循环水式多用真空泵:郑州长城科技工贸有限公司。
1.2 试验方法
1.2.1 样品预处理
将黑果枸杞摘去叶子,放入35℃干燥箱中烘干40 min,黑果枸杞干粉是通过将黑果枸杞干果粉碎得到,粉碎工艺为:温度严格控制在20℃以内,每次粉碎时间为0.5 min,相邻两次粉碎时间间隔为5 min,粉碎3次,之后过30目筛。
1.2.2 缓冲液的配置
pH 1.0 的缓冲溶液:0.2 mol/L KCl∶0.2 mol/L HCl=25∶67,体积比;pH 4.5 的缓冲溶液:0.2 mol/L NaAc·3H2O∶0.2 mol/L HAc=1∶1,体积比。
1.2.3 总花色苷提取工艺
准确称取0.500 0 g黑果枸杞干粉,按一定料液比加入蒸馏水中,复水30 min,加入0.10%果胶酶,用醋酸钠缓冲液调节pH值至3.0,充分混合,于40℃水浴中进行酶解反应2 h,4 000 r/min,离心15 min,取上清液。滤渣按液料比20∶1(mL/g),加入80%体积浓度的乙醇溶液,在50℃条件下水浴回流提取1 h,4 000 r/min,离心15 min,与酶解后得到的上清液合并,即得提取液。
1.2.4 总花色苷含量测定
用pH试差法,以锦葵色素-3-葡萄糖苷为计量标准,测定总花色苷含量。
将提取液转移至100.0 mL容量瓶内,用乙醇定容,再分别用pH 1.0和pH 4.5缓冲液稀释10倍,混匀后,放入40℃水浴中静置平衡40 min。对照组将乙醇用pH 1.0和pH 4.5缓冲液稀释10倍,混合均匀后放入40℃水浴中平衡40 min,平衡结束后,测其在530 nm和700 nm处的吸光度A530和A700。按下式计算总花色苷含量[13-14]:
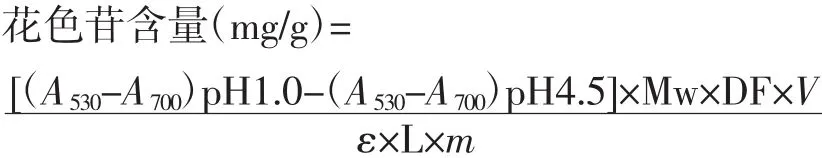
式中:Mw为锦葵色素-3-葡萄糖苷的相对分子质量,493 200 mg/mol;DF为稀释因子;V为提取液的体积,0.1 L;ε为摩尔消光系数,29 600 L/(mol·cm);L为光程厘米数,1 cm;m为原料的质量,0.500 0 g。
1.2.5 单因素试验
按照1.2.3所述花色苷提取工艺,分别研究在提取时间 1 h、乙醇浓度 80%、液料比 20∶1(mL/g)、提取温度50℃和加酶量0.10%条件下,改变其中单一因素对花色苷提取率(以花色苷含量表示)的影响,单因素试验水平如下:提取时间 0.5、1、1.5、2、2.5 h,乙醇浓度50%、60%、70%、80%、90%,液料比 10∶1、20∶1、30∶1、40∶1、50∶1(mL/g),提取温度 30、40、50、60、70 ℃,加酶量0.05%、0.10%、0.15%、0.20%、0.25%。每个单因素试验平行重复3次,结果取平均值。
1.2.6 响应面优化试验
根据响应面的设计原理,综合单因素试验结果(加酶量0.10%),选取提取时间、乙醇浓度、液料比和提取温度4个因素,以花色苷提取率作为响应值,设计响应面试验[15-17]。因素水平表见表1。
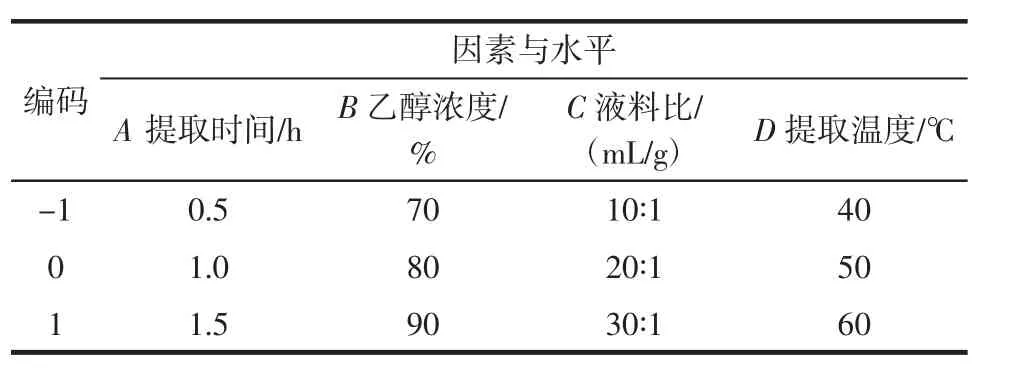
表1 试验因素水平Table 1 Experimental factors and levels
1.2.7 数据处理
作图采用Origin8.0软件,采用Design-Expert 8.0软件对响应面试验数据进行方差分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 提取时间对花色苷提取效果的影响
提取时间对黑果枸杞花色苷提取率的影响如图1所示。
从图1可以得出,随着提取过程的不断进行,花色苷的提取率开始有所增加。但当时间超过1 h后,花色苷的提取率呈明显下降的趋势,一方面是由于提取时间过长,氧化或光照作用会导致花色苷发生分解,使其提取率降低;另一方面是由于提取时间过长导致其它非花色苷成分大量溶出,从而使得提取率降低。所以最佳提取时间为1 h。
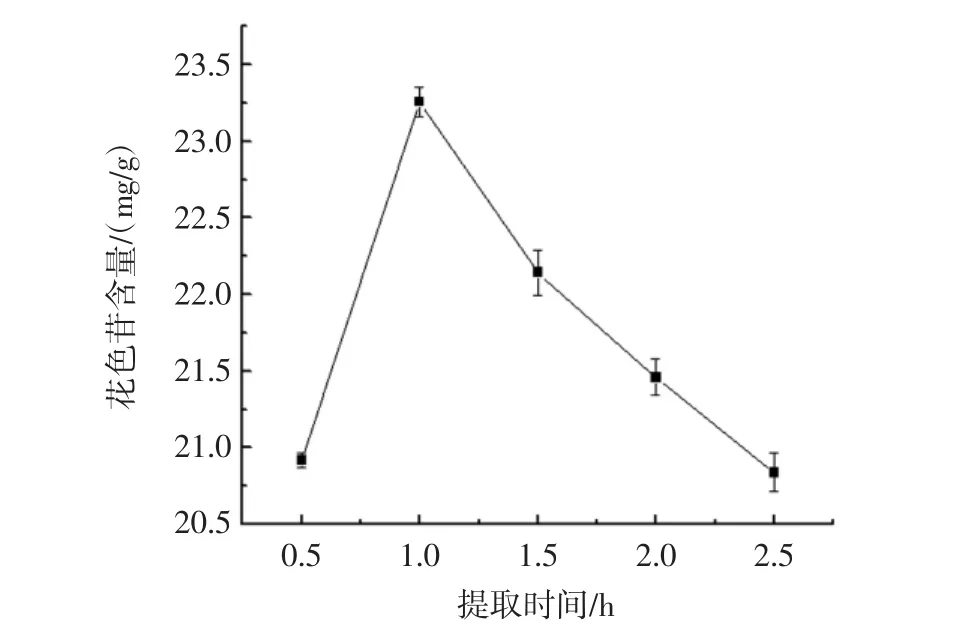
图1 提取时间对花色苷提取效果的影响Fig.1 Effect of extraction time on the anthocyanins extraction
2.1.2 乙醇浓度对花色苷提取效果的影响
乙醇浓度对黑果枸杞花色苷提取的影响如图2所示。
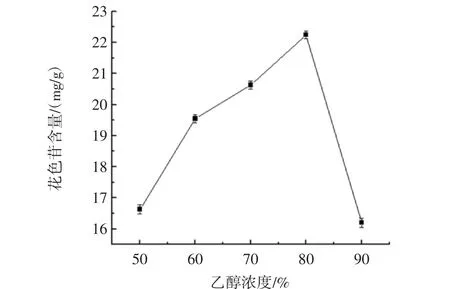
图2 乙醇浓度对花色苷提取效果的影响Fig.2 Effect of ethanol concentration on the anthocyanins extraction
由图2可知,随着乙醇浓度的不断增高,黑果枸杞花色苷的提取率逐渐上升,说明在一定范围内,随着乙醇浓度的增加,溶剂的渗透力也随之增加,从而有利于花色苷的溶出,但当乙醇浓度过高时,溶液的极性降低不利于极性的花色苷的溶出。所以80%的乙醇为最佳提取剂。
2.1.3 液料比对花色苷提取效果的影响
液料比对黑果枸杞提取效果的影响如图3所示。
由图3可以看出,随着液料比的逐渐增加,黑果枸杞花色苷的提取率逐渐上升后趋于平稳,原因是溶剂在一定范围内能较为充分的提取花色苷,若进一步增加液料比,对其影响不大,且成本会增大,所以最佳液料比为 20∶1(mL/g)。
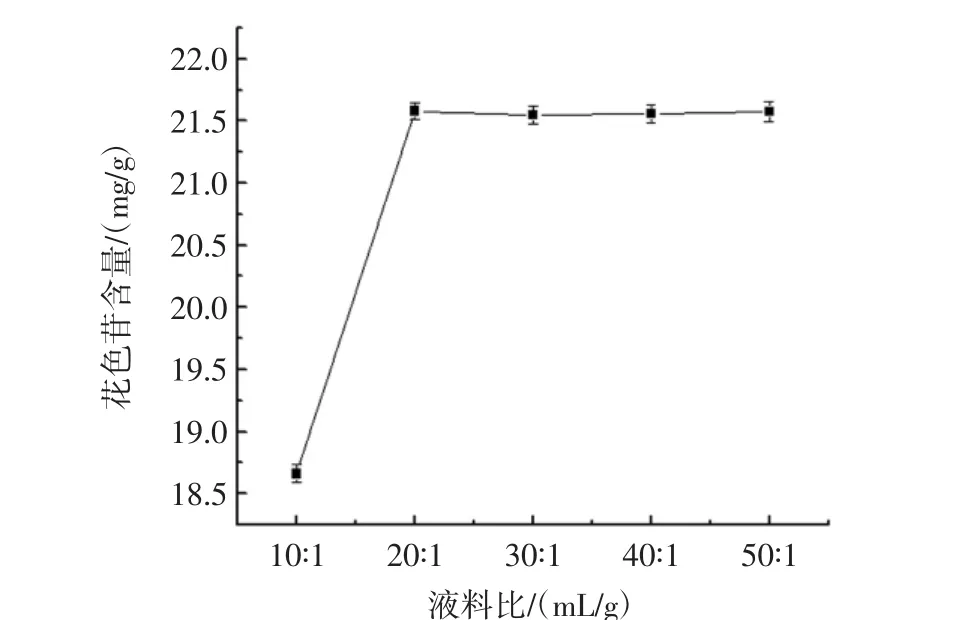
图3 液料比对花色苷提取效果的影响Fig.3 Effect of liquid-solid ratio on the anthocyanins extraction
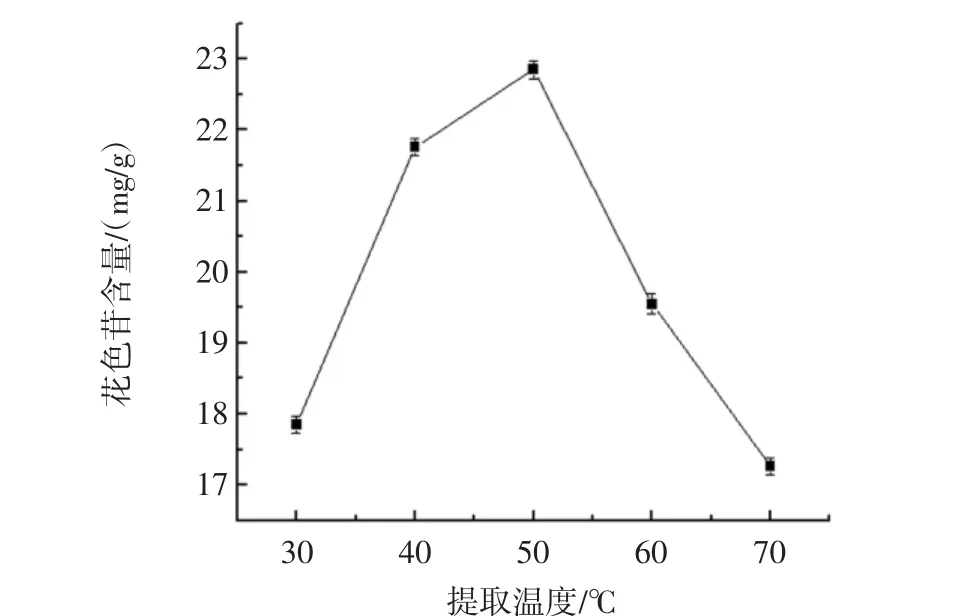
图4 提取温度对花色苷提取效果的影响Fig.4 Effect of extraction temperature on the anthocyanins extraction
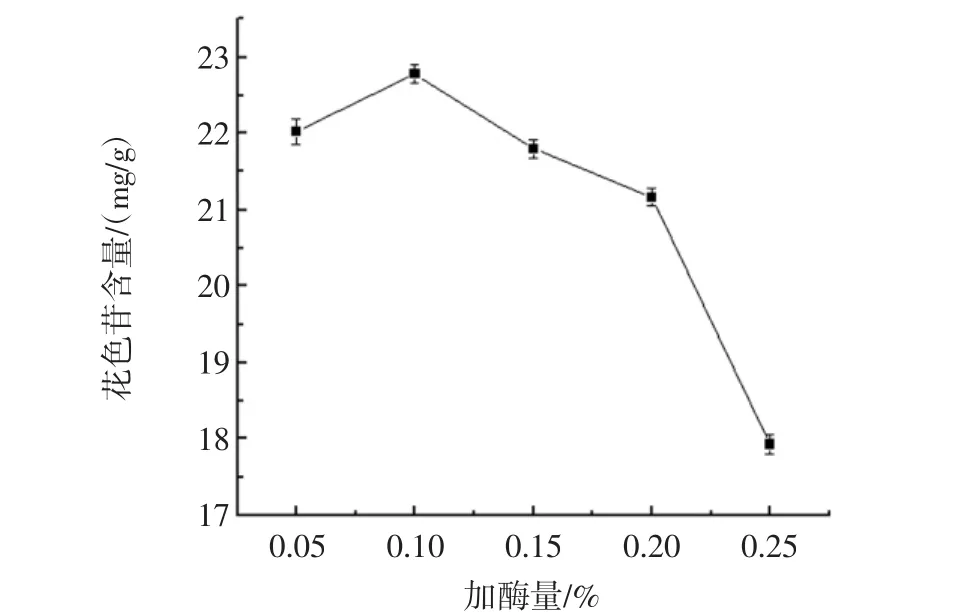
图5 加酶量对花色苷提取效果的影响Fig.5 Effect of enzyme dose on the anthocyanins extraction
2.1.4 提取温度对花色苷提取效果的影响
提取温度对花色苷提取效果的影响如图4所示。
由图4可知,随着温度的升高,花色苷的提取率开始上升。由分子运动论可知,温度升高会使分子运动加快,溶解和扩散的速度也随之加快,温度较高可能会使细胞膜结构发生变化,更易使花色苷被释放到溶剂中,从而使其花色苷的提取率逐渐上升。但温度到达50℃以后,花色苷的提取效果明显下降。可能是由于温度过高产生的强氧化作用使部分花色苷的结构遭到破坏,最终使得提取效果降低,所以50℃为最佳提取温度。
2.1.5 加酶量对花色苷提取效果的影响
加酶量对花色苷提取效果的影响如图5所示。
由图5可知,随着加酶量的增大,花色苷的提取率也在逐渐上升。由于黑果枸杞细胞壁主要成分为果胶和纤维素,但果胶所占比例较大,所以提取时所加果胶酶的量越多,更有利于花色苷被释放到溶剂中。但加酶量超过0.10%之后,花色苷的提取效果明显降低。是由于过量的果胶酶能够使花色苷中的糖苷键水解断裂[18],使部分花色苷的结构遭到破坏,最终使得提取效果降低,所以0.10%为最佳加酶量。
2.2 响应面试验结果
响应面试验设计与结果见表2。
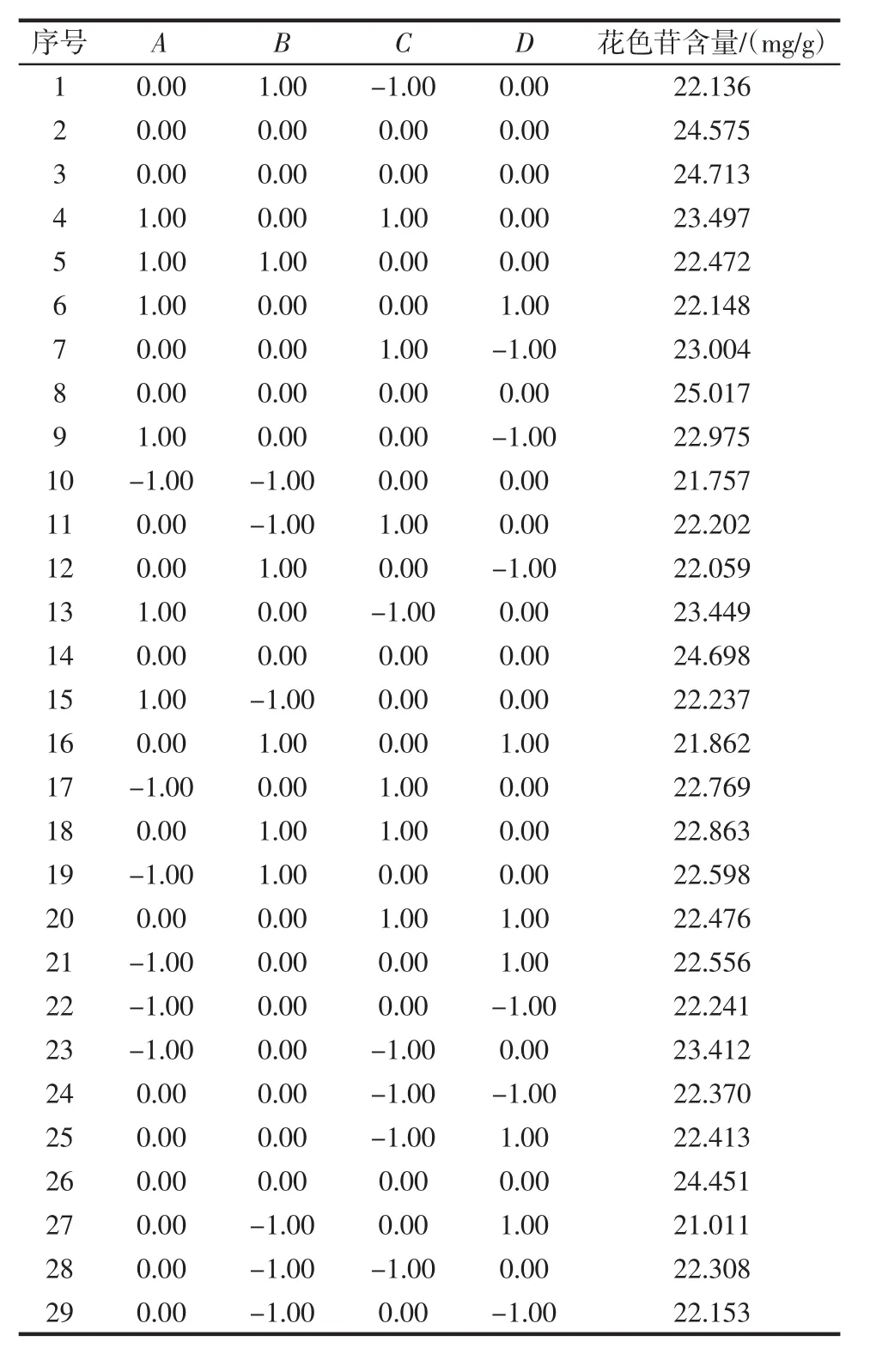
表2 响应面试验结果Table 2 Result of response surface test
根据试验结果经回归拟合后,得到黑果枸杞花色苷提取率对各试验因子的二次多项回归方程为:

各因素对响应值的影响程度可以由此方程中各项系数的绝对值的大小直接反映,系数的正、负决定了影响的方向。因为此方程中的平方项系数是负的,可以知道方程所对应的是开口向下的抛物面,所以最高点即为极大值点,能够进行优化分析。回归方程中一次项系数的大小比较之后得出结论,上述试验中影响黑果枸杞中花色苷提取效果因素的重要程度顺序为:D(提取温度)>B(乙醇浓度)>A(提取时间)>C(液料比)。
为进一步对得到的回归方程进行显著性检验,使用Design-Expert 8.0软件对其进行方差分析[19-20],见表3。
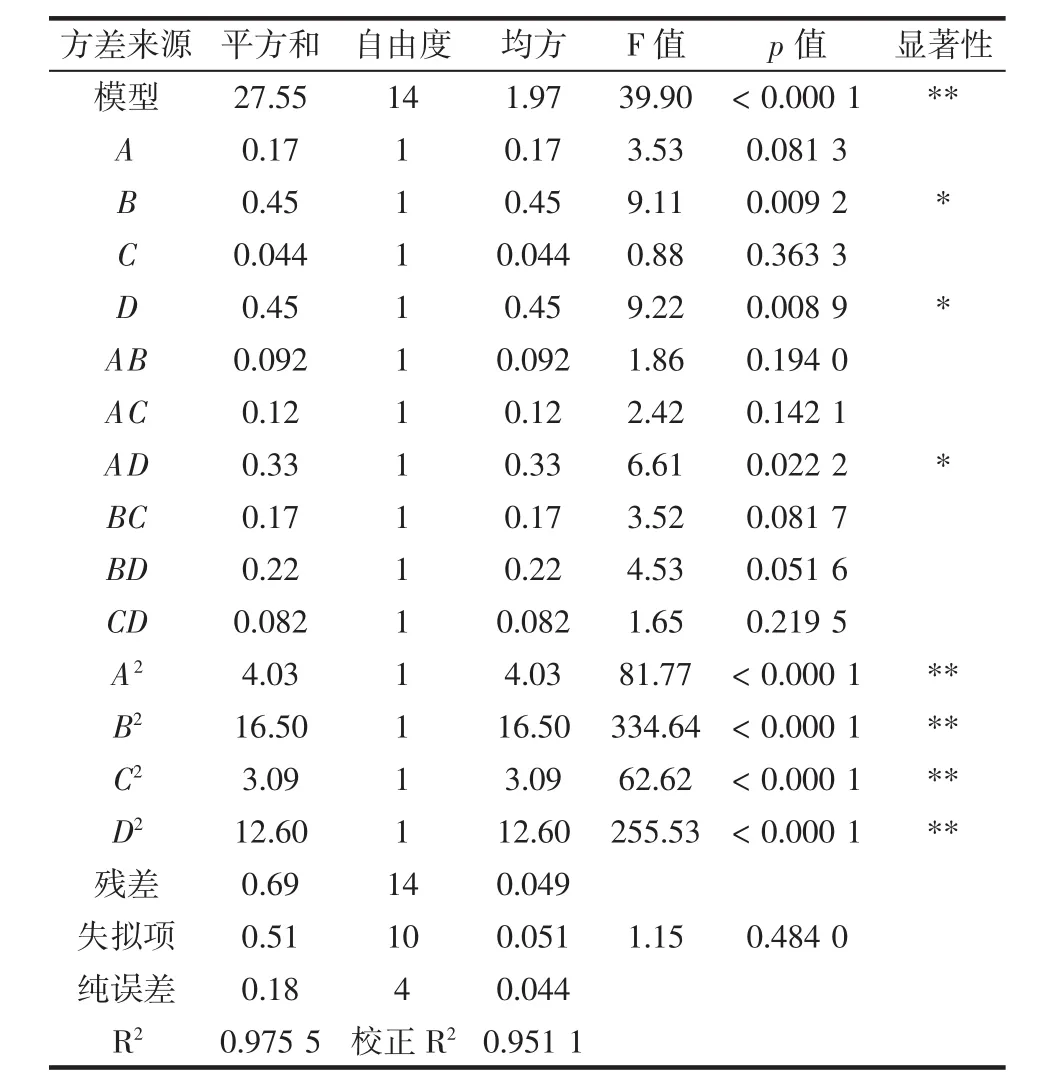
表3 回归模型的方差分析Table 3 Variance analysis of regression model
由方差分析可知,模型(p<0.0001)是有意义的:失拟项(p=0.4840>0.05)不显著,表明模型和实际情况拟合较好:矫正R2=0.9511表明该模型能够说明95.11%响应值的变化。一次项B、D显著,A、C不显著,AD交互项影响显著,其他交互项不显著,二次项 A2、B2、C2、D2影响极其显著。图6为回归模型中提取温度—提取时间的交互作用的响应曲面图,其他交互项类似,但影响不显著。
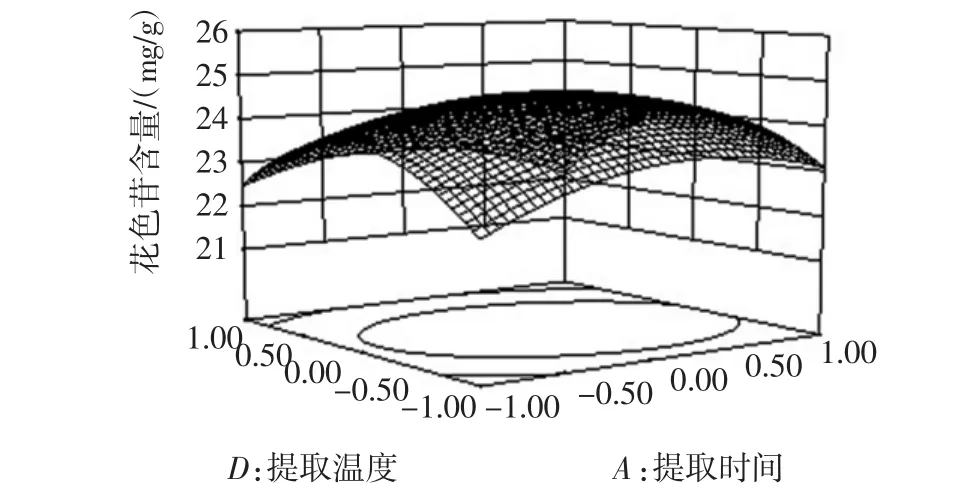
图6 提取温度与提取时间对花色苷含量的交互作用Fig.6 Effect of interaction between extraction time and extraction temperature on the anthocyanin content
2.3 最佳提取工艺的预测及验证
应用Design-Expert 8.0求解经过优化的回归方程,在试验范围内可以得出,当加酶量为0.10%时,提取花色苷的最佳条件:提取时间1.047 h,乙醇浓度80.55%,液料比 20.72∶1(mL/g),提取温度 49.22 ℃,此条件下理论值可达到24.7115 mg/g。考虑到实际试验条件的精度,将其校正为:提取时间1.05 h,乙醇浓度80%,液料比 21∶1(mL/g),提取温度 49 ℃,在此条件下进行3组平行试验,提取得到的花色苷含量为(24.675±0.027)mg/g,结果与预测值基本相符,证明了该模型的有效性。
3 结论与讨论
本试验对果胶酶辅助乙醇提取黑果枸杞中花色苷进行了单因素试验,各因素对花色苷提取效果的影响依次为:提取温度>乙醇浓度>提取时间>液料比;并进一步优化出最佳工艺条件,在加酶量为0.10%条件下,提取时间1.05 h,乙醇浓度 80%,液料比 21∶1(mL/g),提取温度49℃时提取得到黑果枸杞花色苷含量为(24.675 ±0.027)mg/g。
参考文献:
[1]闫亚美,罗青,冉林武,等.黑果枸杞功效研究进展及产业发展前景[J].宁夏农林科技,2015(1):21-24
[2]何如喜.超声波辅助提取野生黑果枸杞花青素工艺研究 [J].青海师范大学学报(自科版),2015,31(1):49-55
[3]Araceli C,Madelourdes P H,Maelena P,et al.Chemical studies of anthocyanins:A review[J].Food Chemistry,2009,113(4):859-871
[4]Jin H L,Lee H J,Choung M G.Anthocyanin compositions and biological activities from the red petals of Korean edible rose(Rosa hybrida,cv.Noblered)[J].Food Chemistry,2011,129(2):272-278
[5]潘自皓,顾子杨,周帅,等.黑枸杞花色苷提取工艺的优化[J].食品工业科技,2016,37(16):302-307
[6]Riceevans C A,Miller N J.Antioxidant activities of flavonoids as bioactive components of food[J].Biochemical Society Transactions,1996,24(3):790-795
[7]马养民,逯文静.蓝莓果中花青素的乙醇提取工艺研究[J].安徽农业科学,2011,39(35):21768-21769,21958
[8]邱业先,王桃云,龙月桂,等.野菊花黄色素提取工艺研究[J].食品与发酵工业,2002,28(3):31-34
[9]赵立仪,李路宁,申芮萌,等.酰基化蓝莓花青素的稳定性研究[J].食品工业科技,2014,35(22):299-303,312
[10]Maran J P,Sivakumar V,Thirugnanasambandham K,et al.Extraction of natural anthocyanin and colors from pulp of jamun fruit[J].Journal of Food Science&Technology,2015,52(6):3617-3626
[11]Chandrasekhar J,Madhusudhan M C,Raghavarao K S M S.Extraction of anthocyanins from red cabbage and purification using adsorption[J].Food&Bioproducts Processing,2012,90(4):615-623
[12]Anuar N,Adnan A F M,Saat N,et al.Optimization of Extraction Parameters by Using Response Surface Methodology,Purification,and Identification of Anthocyanin Pigments in Melastoma malabathricum Fruit[J].The scientific world journal,2013(2).doi.org/10.1155/2013/810547
[13]涂宗财,尹月斌,姜颖,等.超声波辅助提取玫瑰茄花青素的工艺优化[J].食品研究与开发,2011,32(10):1-5
[14]师文添,扶庆权.玫瑰茄中花青素的超声波提取工艺研究[J].食品研究与开发,2010,31(12):86-89
[15]吕春茂,王新现,董文轩,等.响应面法优化越橘花色苷微波辅助提取工艺参数[J].食品科学,2011,32(6):71-75
[16]刘青梅,高娟,姜敏芳,等.响应面法优化杨梅渣中花色苷提取工艺[J].中国食品学报,2014,14(6):90-96
[17]吐尔逊,王选东,李婷.黑果枸杞色素的提取工艺研究[J].安徽农业科学,2007,35(4):1111-1112
[18]赵昶灵,李云,陈中坚,等.花色苷的酶降解[J].热带亚热带植物学报,2011,19(6):576-584
[19]李娜.水酶法制备芝麻油和蛋白的研究[D].郑州:河南工业大学,2007
[20]杨青.山竹壳中原花青素的提取纯化与活性研究[D].厦门:集美大学,2013

