柑橘PGIP的B细胞抗原表位分析和原核表达
陈波,罗庆华,谭雅芹,闫慧清
(贵州师范大学生命科学学院,贵州贵阳 550001)
柑橘(Citrus reticulataBlanco)的栽培面积和果实产量均居各类水果首位。柑橘果实中富含维生素C、类胡萝卜素、类黄酮、橙皮柑和膳食纤维等多种次生代谢产物,具有抗氧化活性、抗癌、预防心脑血管疾病以及抗菌作用等[1,2]。但在生活中有仍有部分人群食用后会有发痒、肿胀、哮喘及过敏性休克等过敏反应[3]。柑橘过敏反应主要是由IgE介导的I型变态反应,其反应包括呼吸系统、中枢神经系统和皮肤等不同形式的临床症状[4]。过敏原分布在少数限定功能蛋白家族中[5],包括有运输蛋白、病程相关蛋白、结构蛋白、蛋白酶及蛋白酶抑制剂,如多聚半乳糖醛酸酶抑制蛋白 PGIP (Polygalacturonase inhibiting protein,PGIP)[6]。由于这些过敏原蛋白在不同物种之间的序列具有保守性,因此三维空间结构很相似,易具有相似的抗原表位,因而易引起不同物种间的交叉过敏反应[7],它包括同一科(属)水果和不同科(属)内的水果[8],水果过敏原是导致水果过敏复杂性的关键物质基础之一,而不同植物过敏原分子结构上共同的表位是免疫交叉反应的基础。
本文利用BLAST将柑橘中PGIP蛋白序列同其他物种进行同源性对比,根据相似程度,利用其它植物在过敏原蛋白方面的研究与成果将有助于研究柑橘的过敏原蛋白,而这些过敏原表位往往位于细胞表面易于检测与鉴定,所以本文对柑橘的柑橘多聚半乳糖醛酸酶抑制蛋白(PGIP)的B细胞抗原表位结构域进行分析,为寻找柑橘多聚半乳糖醛酸酶抑制蛋白(PGIP)B细胞抗原表位的最佳优势提供支持。同时本文构建PET-28a-PGIP载体,对目的基因诱导进行原核表达,为纯化后进行免疫学的深入研究提供理论基础。
1 材料与方法
1.1 柑橘中PGIP氨基酸序列及同源比对
通过 NCBI(http://www.ncbi.nlm.nih.gov/)中检索到PGIP的蛋白序列及其登录号,得到PGIP多肽链中氨基酸的排列顺序为一级结构,并利用生物软件BioEdit对不同中间的一级结构进行同源比对。
1.2 PGIP的二级结构及蛋白特性分析
将在 NCBI上检索到的氨基酸序列,利用DNAStar生物软件中的Gamier-Robson方法对蛋白质α-螺旋、β-折叠、β-转角和无规则卷曲的氨基酸区域进行分析。再利用 DNAStar生物分析软件中的protean程序,采用 Jameson-Wolf法[9]、Kyte-Doolittle法[10]、Emini法[11]和 Karplus-Schulz法[12]对柑橘过敏原蛋白PGIP的抗原指数、亲水性、蛋白表面可及性及柔韧性进行分析。将柑橘过敏原蛋白PGIP的二级结构分析结果与抗原指数、亲水性、蛋白表面可及性及柔韧性分析结果相结合,进行综合分析得出B细胞抗原表位。
1.3 原核表达载体PET-28a-PGIP的构建
利用Trizol试剂盒(Invitrogen,货号:15596026)提取成熟温州蜜柑的果实总RNA,经cDNA反转录试剂盒(Thermo,K1622)后生成 cDNA,并设计用于扩增 PGIP基因的特异引物 F1:GGAATTCCATATGATGAGCAACACGTCACTG;R1:CCCCCCCGCTCGAGTCACTTGCAGCTTTCGA GGGGCGC。
PCR产物电泳检测回收,连接入PMD18-T载体转化测序。准备经测序可用的菌斑质粒和 pET28a(+)载体质粒,用BamHI和HindIII分别酶切、回收后进行过夜连接,获得重组质粒 pET-28a-PGIP,经 PCR验证、酶切验证和测序证明后将重组质粒转移到大肠杆菌(Escherichia coli)中,对目的基因诱导进行原核表达。
1.4 PET-28a-PGIP表达产物SDS-PAGE检测
挑取阳性克隆,接种于 LB液体培养基(含Km=100 μg/mL)振荡培养过夜,振荡培养至 OD600约为0.6~1.0时,加IPTG至1.0 mM诱导0、1、2、5和7 h,收集菌液12000 r/min离心1 min,沉淀用SDS凝胶加样缓冲液(Tris-HCl 50 mmol/L,pH 6.8;SDS 2%;二硫苏糖醇100 mmol/L;溴酚蓝0.1%;甘油10%)100 μL重悬。按比例配置5%浓缩胶溶液和10%分离胶溶液。在两玻璃板的间隙中灌注分离胶,留出浓缩胶所需体积,用少量水封盖。待分离胶聚合后(30 min),倾出水;在已聚合的分离胶上直接灌注浓缩胶,并插入干净的梳子。浓缩胶聚合完全后(30 min),小心移出梳子,每个样品 20 μL,接上电源。所选用的蛋白Marker是 140-15 ku(NexusView™20 ku Dual Color,Bionexus, USA)。电泳完成后经考马斯亮蓝R250染色后,更换脱色液四、五次。脱色后可将凝胶浸于水中以便观察。
2 结果与分析
2.1 PGIP蛋白质序列的同源比对
通过 NCBI(http://www.ncbi.nlm.nih.gov/)中检索柑橘中PGIP的蛋白质序列,其登陆号为BAA31841.1。PGIP一共编码327个氨基酸,所对应序列为:
MSNTSLLSLFFFLCLCISPSLSDLCNPNDKKVL LKFKKSLNNPYVLASWNPKTDCCDWYCVTCDLT TNRINSLTIFAGDLPGQIPPEVGDLPYLETLMFHKL PSLTGPIQPAIAKLKNLKTLRISWTNISGPVPDFISQL TNLTFLELSFNNLSGTIPGSLSKLQKLGALHLDRN KLTGSIPESFGTFTGSIPDLYLSHNQLSGKIPASLGS MDFNTIDLSRNKLEGDASFLFGLNKTTQRIDVSRN LLEFNLSKVEFPQSLTNLDLNHNKIFGSIPAQITSLE NLGFLNVSYNRLCGPIPVGGKLQSFGYTEYFHNR CLCGAPLER。

图1 柑橘中PGIP与其他物种的同源比较Fig.1 Amino acid sequence alignments of PGIP in citrus with other plants
PGIP的结构域包含有LRR_2、LRR_1和Internal repeat 1,分别位于柑橘氨基酸序列的26-64、142-164和189-310。利用BLAST对柑橘中PGIP蛋白的蛋白质序列与其他物种,如苹果(Malus pumila)、梨(Pyrus)、中国李(Prunus salicina)和葡萄(Vitis vinifera)进行同源性比对搜索后的结果如下图 1,且氨基酸序列的相似度分别为74%、75%、73%和73%,表明其在氨基酸序列上有较高的相似性,说明这些物种之间可能存在着交叉过敏的现象。
2.2 柑橘PGIP的B细胞抗原表位分析
2.2.1 柑橘中PGIP蛋白二级结构分析结果
利用DNAStar生物软件中Gamier-Robson方法对柑橘中PGIP蛋白的α-螺旋、β-折叠、β-转角和无规则卷曲的氨基酸区域进行分析,得到的结果如图2所示。

图2 柑橘多聚半乳糖醛酸酶抑制蛋白的α-螺旋、β-折叠、β-转角和无规则卷曲相对应的氨基酸序列Fig.2 The corresponding α-helix, β-helix, β-turn and coil amino acid sequences of citrus PGIP
将PGIP的二级结构和其所对应的氨基酸序列分别列出,得到柑橘中过敏原 PGIP蛋白的序列如表 1所示。

表1 分析柑橘多聚半乳糖醛酸酶抑制蛋白的二级结构氨基酸序列Table 1 Prediction secondary amino acid sequences of citrus PGIP
2.2.2 Profilin蛋白与PGIP蛋白抗原指数、柔韧性、亲水性及蛋白表面可及性分析
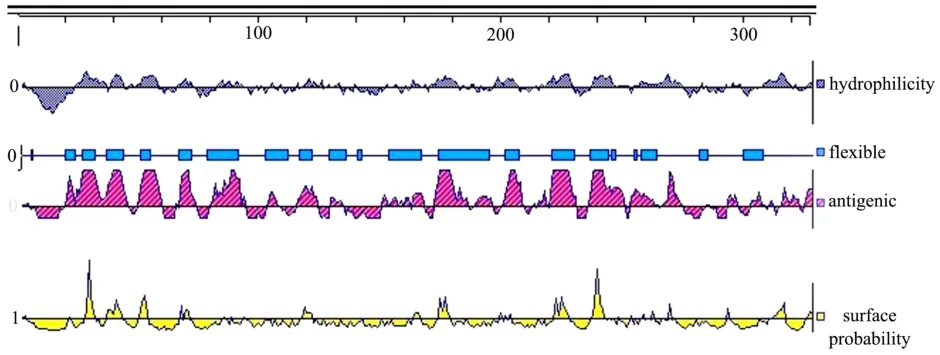
图3 柑橘中PGIP蛋白的抗原指数、柔韧性、亲水性及蛋白表面相对应的氨基酸序列Fig.3 The hydrophilicity, flexible regions, antigenic index and surface probability amino acid sequences of citrus PGIP
利用DNAStar生物软件中Jameson-Wolf方法分析得到柑橘过敏原蛋白PGIP的抗原指数、Karplus-Schulz得到柔韧性,Kyte-Doolittle法和Emini法分别获得亲水性和表面可及性的氨基酸序列,其具体的序列分布如图3所示。
当蛋白质的亲水性>0、柔韧性>0蛋白表面可及性>1和抗原指数>0时,形成与抗原结合表位的可能性增大,因此根据上图 3中显示的区域结合 Profilin在亲水性>0、柔韧性>0蛋白表面可及性>1和抗原指数>0时所对应的氨基酸序列进行列表,结果如表2所示。

表2 柑橘中PGIP蛋白抗原指数、柔韧性、亲水性及蛋白表面可及性的氨基酸序列Table 2 Prediction of citrus PGIP antigenic index, flexible Regions, hydrophilicity and surface Probability

柔韧性>0 5、19~22、26~30、36~42、50~53、66~70、78~90、102~110、116~120、128~134、139~131、153~165、173~194、200~206、220~229、235~243、244~245、254、257~263、281~284、299~306抗原指数>0 1~3、18~44、48~58、64、66~72、79~92、102~105、114~122、128~133、149~155、157、159~160、162~166、171~184、188~194、199~207、212、214~217、219~229、235~249、252~263、265~273、283~284、292`296、302~307、310、315~321、324~327蛋白表面可及性>1 1~20、27~30、35~41、49~52、66、68~69、83~84、87、92、116~120、160、163~165、172~177、198、200、202、221~226、236~240、243、247、252、254、256~257、259、261、268、292、309~315、325~327
2.2.3 PGIP的B细胞抗原表位分析蛋白质的表面可及性、亲水性和柔韧性等在抗原的形成方面发挥着重要作用,当亲水性>0、柔韧性>0、抗原指数>0、表面可及性>1时,形成抗原表位的可能性大[9],PGIP二级结构中的α-螺旋和β-折叠因氢键存在使得结构较稳定,因此不易与B细胞等其他物质发生作用,而PGIP的β-转角和无规则卷曲的氨基酸区域多位于蛋白质表面,较易与抗体结合,形成B细胞抗原表位的可能性也越大。因此综合以上所有参数,将满足要求的氨基酸序列进行综合,得到柑橘中PGIP的抗原结合区氨基酸的序列分别为 19~22、37~41、49~52、68~69、117~120、163~164、173~177、221~226、236~240。
2.3 柑橘PET-28a-PGIP的载体构建及表达产物检测
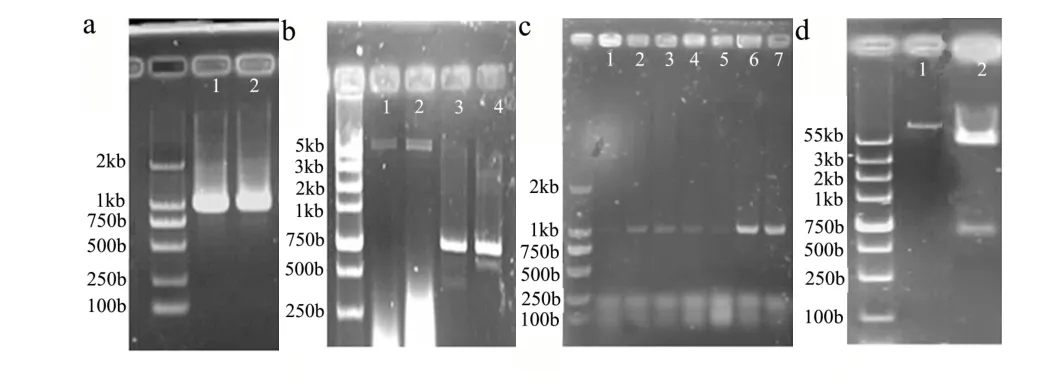
图4 PET-28a-PGIP载体构建图Fig.4 The construction of PET-28a-PGIP
从温州蜜柑的果实中扩增得到PGIP的cDNA片段大约在1 kb(图4a)。用BamH Ⅰ和Hind Ⅲ分别酶切PGIP和PET-28a(图4b)后,并连接转化到大肠杆菌中,得到的阳性克隆经菌液PCR(图4c)和酶切验证后(图4d)表示载体构建PET-28a-PGIP成功。将重组质粒转移到大肠杆菌(Escherichia coli)进行增值。经IPTG诱导原核细胞表达和SDS-PAGE电泳后,得到的结果如图5所示,可以发现在36 ku和50 ku之间有大量的蛋白质被诱导产生,而PGIP蛋白的大小36.69 ku,说明将重组载体转入到大肠杆菌中得到大量的PGIP蛋白。

图5 不同时间诱导下PGIP的SDS-PAGE电泳检测图(CK为空载,M为marker)Fig.5 The SDS-PAGE detection of PGIP expressed at different time (CK was used as control, M is abbreviation of marker)
3 讨论
抗原表位是抗原分子中能激发B细胞产生抗体并与抗体分子结合的一段序列,是抗原分子启动机体免疫反应最基本的结构单位[13]。引发柑橘过敏反应的免疫学物质基础就是过敏原 PGIP的结构表位[14,15]。对柑橘过敏原PGIP进行B细胞表位的分析,可为开展低过敏性或无过敏性的柑橘制品加工以及过敏原的检测等研究工作提供理论和技术依据。
PGIP的结构域包括LRRNT_2(富含亮氨酸重复N端结构域)和LRR_1(富亮氨酸重复)。多序列比对表明,PGIP与其他物种的PGIP蛋白在氨基酸序列上有较高的相似性,都参与至于的抗病免疫系统。丰富的亮氨酸重复结构域是参与形成蛋白质与蛋白质相互作用[16]。
富含亮氨酸的结构域较小,是经典的免疫球蛋白域的特征。LRR是丰富重复的亮氨酸在其他植物生长发育和抗病反应等方面发挥着重要作用[17],同时也会影响植物病原体和综合防御反应的感染[18]。很多数据表明动物组织和植物之间在非自我识别系统和抗菌防御之间有着惊人的相似之处[19]。
4 结论
通过对PGIP的B细胞抗原表位的分析,可利用该片段进行基因功能改造,为后续研究培育低过敏的柑橘品种提供了一定的理论依据。本文中对于抗原性的分析均为二级结构,对一些表位特别是通过三维结构表现其抗原性的构象依赖型抗原表位具有一定的局限性,研究结果可以作为确定柑橘PGIP蛋白潜在表位的参考。实验通过构建PET-28a-PGIP原核表达得到大量诱导产生的 PGIP蛋白,可以将诱导产生的蛋白质与病原菌进行免疫杂交反应和蛋白质结构鉴定,进一步验证其生物学功能。
[1]Kundusen S, Saha P, Bhattacharya S, et al. Evaluation of in vitro antioxidant activity ofCitrus LimettaandCitrus Maximaon reactive oxygen and nitrogen species [J]. Pharma Cologyonline, 2010, 3(24-5): 850-857
[2]Georgina E O, Kingsley O, Esosa U S, et al. Comparative evaluation of antioxidant effects of watermelon and orange,and their effects on some serum lipid profile of Wister albino rats [J]. International Journal of Nutrition & Metabolism,2011, 8: 97-102
[3]Bourrier C T. Allergy to citrus juice [J]. Clinical and Translational Allergy, 2013, 3(S3): 1-1
[4]杨朝崴.桃过敏原表达鉴定和免疫分析[D].杭州:浙江大学,2013 YANG Chao-wei. Expression and immunological characterization of peach allergens [D]. Hangzhou: Zhejiang University, 2013
[5]徐国强,倪海东,杨明,等.食物过敏原蛋白家族分类及其结构特点[J].检验检疫学刊,2012,22(5):66-70 XU Guo-qiang, NI Hai-dong, YANG Ming, et al. The classification and structural characteristics of food allergen protein families [J]. Journal of Inspection and Quarantine,2012, 22(5): 66-70
[6]Wang X H. Molecular cloning and functional analysis of polygalacturonase-inhibiting protein (PGIP) gene from mulberry (Roxb.) [J]. Acta Agronomica Sinica, 2015, 41(9):1361
[7]Antunez C, Blanca-Lopez N, Torres M J, et al. Immediate allergic reactions to cephalosporins: evaluation of cross-reactivity with a panel of penicillins and cephalosporins[J]. J Allergy Clin Immunol, 2006, 117(2): 404-410
[8]Romano A, Mayorga C, Torres M J, et al. Immediate allergic reactions to cephalosporins: cross-reactivity and selective responses [J]. Journal of Allergy & Clinical Immunology,2000, 106(6): 1177-83
[9]Jameson B A, Wolf H. The antigenic index: a novel algorithm for predicting antigenic determinants [J]. Computer Applications in the Biosciences Cabios, 1988, 4(1): 181-186[10]Karplus P A. Schulz G E. Prediction of chain flexibility in proteins [J]. Naturwissenschaften, 1985, 72(4): 212-213
[11]Kyte J, Doolittle R F. A simple method for displaying the hydropathic character of a protein [J]. Journal of Molecular Biology, 1982, 157(1): 105-132
[12]EmminI E A, Hughes J V, Perlow D S, et al. Induction of hepatitis a virus-neutralizing antibody by a virus-specific synthetic peptide [J]. Journal of Viorology, 1985, 55(3):836-839
[13]沈海旺,陈亨莉,曹敏杰,等.甲壳类动物 4种过敏原的序列分析、抗原表位预测及三维结构建模[J].免疫学杂志,2012,7:613-619 SHEN Hai-wang, CHEN Heng-li, CAO Min-jie, et al.Sequence analysis, antigen epitopes prediction, and three dimensional structure modeling of four allergens in crustaceans [J]. Immunological Journal, 2012, 7: 613-619
[14]Brandström J, Lilja G, Nilsson C, et al. IgE to novel citrus seed allergens among cashew-allergic children [J]. Pediatric Allergy & Immunology Official Publication of the European Society of Pediatric Allergy & Immunology, 2016, 27(5):550-553
[15]Claudianos C, Campbell H D. The novel flightless-I gene brings together two gene families, actin-binding proteins related to gelsolin and leucine-rich-repeat proteins involved in Ras signal transduction [J]. Molecular Biology &Evolution, 1995, 12(3): 405-414
[16]Zhang J, Wang X, Zhang Y, et al. Leucine-rich repeats and immunoglobulin-like domains protein 1 and fascin actin-bundling protein 1 expression in nonsmall cell lung cancer [J]. Journal of Cancer Research & Therapeutics, 2016,12 (Supplement): C248-C251
[17]Freiberg A, Machner M P, Pfeil W, et al. Folding and stability of the leucine-rich repeat domain of internalin B fromListeri monocytogenes[J]. Journal of Molecular Biology, 2004,337(2): 453-461
[18]Schubert W D, Gobel G, Diepholz M, et al. Internalins from the human pathogen Listeria monocytogenes combine three distinct folds into a contiguous internalin domain [J]. J Mol.Biol., 2001, 312: 783-794
[19]Wang C, Cai Y, Gu Z, et al. Clinical profiles of Parkinson's disease associated with common leucine-rich repeat kinase 2 and glucocerebrosidase genetic variants in Chinese individuals [J]. Neurobiol Aging, 2014, 35(3): 725 e721-726

