基于线粒体COI和Cytb基因序列的6种锦鲤(Cyprinus carpio Koi)遗传多样性分析
李梦荣,田 雪,庞小磊,王良炎,胡 菊,董传举,李学军,王团记
(河南师范大学水产学院,河南新乡 453007)
锦鲤(CyprinuscarpioKoi)属于鲤形目(Cypriniformes)鲤科(Cyprinidae)鲤属(Cyprinus)。鲤科为鱼类中最大的一个科,分布广泛[1]。锦鲤体表被鳞色彩艳丽、花纹多变,具极高的观赏和饲养价值,是风靡当今世界的一种体型较大的观赏鱼类,素有“会游泳的艺术品”、“水中活宝石”等美称[2,3]。经过200多年的培育,锦鲤中出现了众多品系,可分为13类126种[4],锦鲤品系一般由杂交和长期的人工选择获得,在观赏和养殖过程中主要是以色斑来进行挑选与分类,因此,即使表形特征一样的个体,其基因型却可能存在极大的差异,这也导致其遗传背景十分复杂,体色变化有很强的不确定性,所以在养殖过程中找到体色稳定遗传的锦鲤必须万中挑一[5]。
现今,关于鲤科鱼类种属间系统发育关系的报道较多,但锦鲤养殖品系间的亲缘关系研究很少,多利用形态学[6,7]或微卫星标记[8,9]方法对红白锦鲤、昭和锦鲤、大正锦鲤和乌鲤进行遗传分析,其它主要养殖品系间的遗传差异尚不清晰。鱼类线粒体基因是结构高度紧凑的共价双链闭环分子[10],长度约为15~20 kb[11],具有分子小、进化速度快、结构简单和母性遗传[12]等特点,在分子遗传学领域应用较多。本研究以河南师范大学水产养殖基地培育的6个锦鲤养殖品系为研究对象,利用线粒体COI和Cytb基因分析锦鲤养殖品系间的遗传差异,探讨各品系间的进化和亲缘关系,为锦鲤的系统进化提供分子生物学依据,也为优质锦鲤选育提供参考资料。
1 材料与方法
1.1 研究样品来源及总DNA提取
6个锦鲤品系为河南师范大学水产养殖基地培育,表1为品系的名称和数量等信息。酚-氯仿抽提法从锦鲤鳍条组织中提取总DNA,1%琼脂糖凝胶电泳检测其质量。

表1 锦鲤品系的名称和数量Tab.1 C.carpio Koi sample names and quantity
1.2 COI和Cytb基因扩增及序列测定
根据NCBI中锦鲤COI基因和Cytb基因序列设计特异性引物进行PCR扩增,具体引物序列如下:正向引物COIF(AGTATAAGCGTCTGGGTAGTC)、CytbF(AACCACCGTTGTATTCAACTACAA)和反向引物COIR(CCTGCAGGAGGAGGAGAYCC)、CytbR(ACCTCCGATCTTCGGATTACAAGACCG),由武汉天一辉远生物科技有限公司合成。PCR反应体系:2×PCR Taq MasterMix12.5 μL、上下游引物(10 μmol/L)各0.75 μL、DNA模板1 μL,补足dd H2O到25 μL。PCR扩增条件为:预变性94 ℃ 3 min,变性94 ℃ 30 s,退火60 ℃ 1 min,延伸72 ℃ 1 min,共30个循环,终延伸72 ℃ 5 min。扩增产物经琼脂糖凝胶电泳检测后,送武汉天一辉远生物科技有限公司、金斯瑞公司和生工进行测序。
1.3 序列分析
测序结果用Clustalx 2.1软件进行比对,MEGA7.0[13]计算线粒体COI和Cytb基因序列的碱基组成,确定变异位点和简约信息位点的个数,群体内和群体间的遗传距离。DNAsp v.5[14]统计单倍型个数,计算单倍型多样性(Haplotype diversity,Hd)和核苷酸多样性(π)等。Arlequin3.1[15]计算品系间的遗传分化系数等。MEGA7.0软件中的邻接法(Neighbor-Joining,NJ)构建单倍型和品系全部个体的系统进化树,系统树各节点支持率采用Bootstrap 1 000次重复检验置信度[16]。
2 结果
2.1 序列与单倍型分析
用于进行品系间分析的COI基因序列长602 bp,A、T、G、C的平均碱基含量分别为26.6%、30.4%、18.5%、24.5%。其中包括594个保守位点,8个变异位点,3个简约信息位点。COI基因中检测到的7种单倍型及单倍型序列变异位点见表2,其中H1、H2、H4为群体间共有单倍型, H3为黑锦鲤(HL)所特有,H5为全白锦鲤(QB)所特有,H6、H7为全红锦鲤(QH)所特有。
用于进行品系间分析的Cytb基因序列长1 117 bp,A、T、G、C的平均碱基含量分别为29.5%、26.5%、13.8%、30.2%。其中包括1 102个保守位点,15个变异位点,12个简约信息位点。Cytb基因中检测到的6种单倍型及单倍型序列变异位点见表3,其中HH1、HH2、HH4为群体间共有单倍型,HH3为HL所特有,HH5为QB所特有,HH6为QH所特有。
6个锦鲤品系基于COI和Cytb基因序列的遗传多样性结果如表4所示,COI基因序列Hd在0.436±0.133~0.709±0.083之间,π在0.000 7±0.000 2~0.003 0±0.000 6之间。Cytb基因Hd在0.318±0.164~0.709±0.083之间,π在0.001 6±0.000 5~0.005 0±0.001 0之间。所有品系COI和Cytb的Tajima’s D中性检验结果为-1.370 7~1.448 8、-1.704 6~1.905 7,中性检验结果均不显著(P>0.05),符合中性突变。

表2 COI基因单倍型及在6个品系的分布Tab.2 Haplotypes of COI gene and its distribution in 6 varieties

表4 6个品系基于线粒体COI和Cytb基因序列的遗传多样性指数Tab.4 Genetic diversity index base on COI and Cytb sequence in 6 varieties
2.2 品系间的遗传距离及遗传分化
利用线粒体COI和Cytb基因序列比较6个品系的遗传分化系数,根据软件AMOVA结果显示,品系内遗传差异高于品系间的差异(表5)。 表6所示,基于COI基因的6个养殖品系群体间遗传分化系数FST在-0.029 1~0.623 8之间,SS和QB之间的遗传差异最大,为0.623 8,HL和QH间遗传差异最小,为0.059 9;HJ和QB之间的遗传距离最近,为0.001 6,SS和QH之间的遗传距离最远,为0.003 6。并且QB品系内遗传距离最小,为0.000 7,HL的种内遗传距离最大,为0.003 0,经比对,遗传距离与FST分析结果基本一致。
基于Cytb基因的6个养殖品系FST在-0.041 5~0.690 2之间,SS和QH间遗传差异最大,为0.690 2,HJ和QH间遗传差异最小为0.108 0;QH和QB之间的遗传距离最近,为0.003 0,SS和QH之间的遗传距离最远,为0.007 2。此外,QB品系内遗传距离最小,为0.001 6,HL的种内遗传距离最大,为0.005 0,经比对,遗传距离与FST分析结果基本一致(表7)。
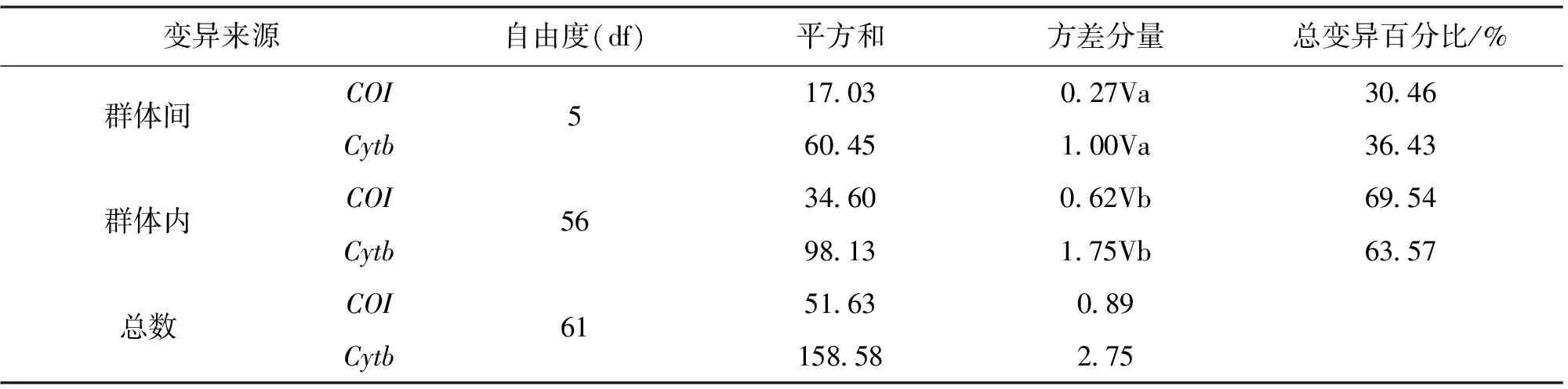
表5 6个品系线粒体COI和Cytb序列的AMOVA结果Tab.5 The result of AMOVA based on COI and Cytb gene of mtDNA in 6 varieties

表6 基于COI基因的6个品系间平均遗传距离、FST值及各个品系内平均遗传距离Tab.6 average genetic distance between and within 6 varieties and FST
注:对角线以上为群体间的遗传距离,对角线以下为群体间的FST,*表示差异显著(P<0.05)。表7同。
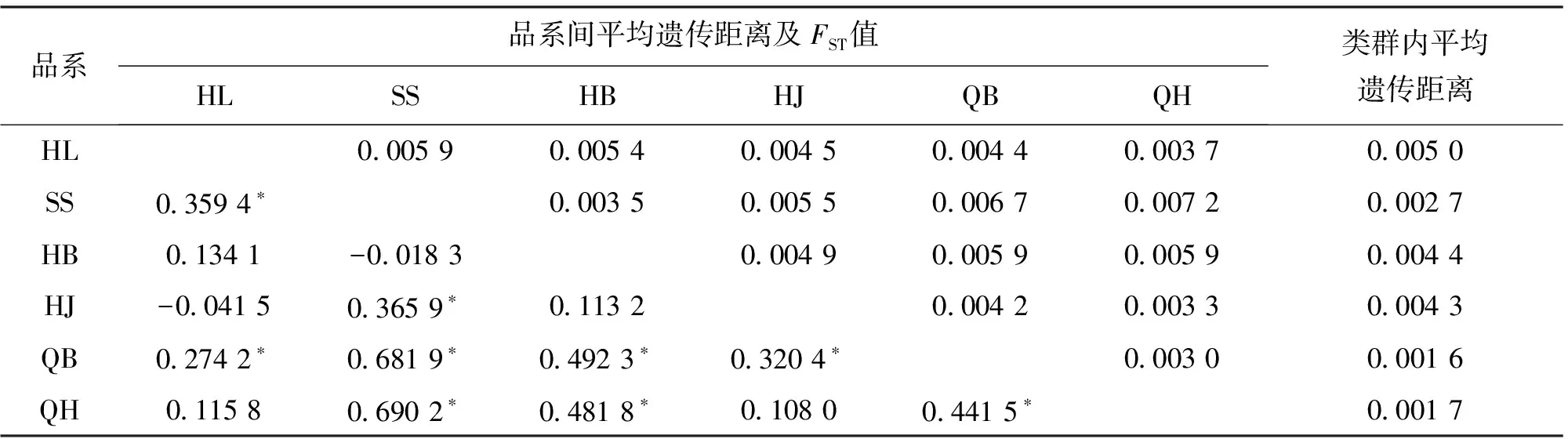
表7 基于Cytb基因的6个品系间平均遗传距离、FST值及各个品系内平均遗传距离Tab.7 average genetic distance between and within 6 varieties and FST
2.3 系统进化树
根据COI基因和Cytb基因单倍型构建品系之间的NJ系统进化树(图1、2)。从图1、图2中得到,6个品系可分为三支, HL、QH聚为一支;SS、HB、HJ聚为一支,QB单独聚为一支。因此,HL和QH亲缘关系较近,SS、HB和HJ亲缘关系较近,QB与其他品系的亲缘关系均较远。
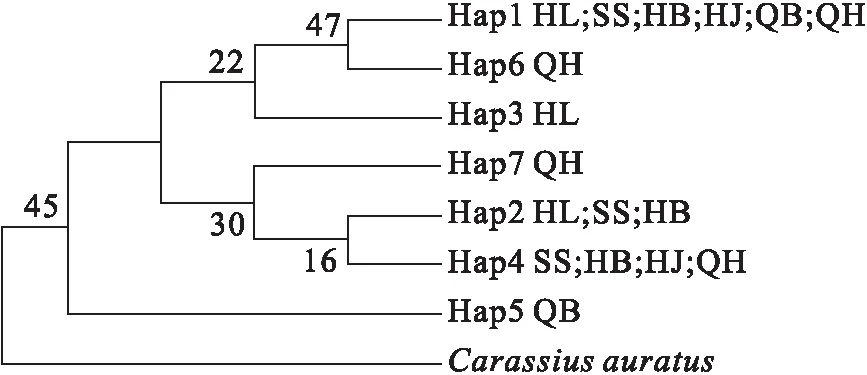
图1 基于邻接法构建的COI基因单倍型系统发育树Fig.1 Neighbor-joining tree of COI gene haplotypes

图2 基于邻接法构建的Cytb基因单倍型系统发育树Fig.2 Neighbor-joining tree of Cytb gene haplotypes
3 讨论
3.1 序列及单倍型
本研究分析并比较了6个锦鲤养殖品系线粒体COI和Cytb基因部分序列的碱基差异。结果显示锦鲤各品系COI和Cytb基因序列中G含量最低(18.5%/13.9%),且AT含量(57%/56%)明显高于GC含量(43%/44%),这与鱼类线粒体基因碱基组成中存在的反G偏倚现象相一致,大部分生物基因组中出现的碱基偏向性现象十分广泛,且不同种属的碱基不均衡程度也不尽相同[17]。产生这一现象的原因有:基因长度、基因的表达水平、碱基组分以及密码子反密码子间的结合能力等[18]。
7个COI基因单倍型中单倍型H1、H2和H4为群体所共有,且这3种单倍型的个体数为51个,占总数的82.26%, 6个Cytb基因单倍型中H1、H2和H4单倍型为群体所共有,且具有这3种单倍型的个体数为52个,占总数的83.87%,推测单倍型H1、H2和H4很可能是较原始的单倍型类型。基于COI和Cytb基因研究的6个品系中红白锦鲤均具有最高的Hd值,黑锦鲤具有最高的π值,这可能与锦鲤的选育历史有一定的关系,Kock等[19]研究证实:黑锦鲤和红白锦鲤处于较原始的位置,通常以黑锦鲤和红白锦鲤为亲本选育其他品系类型。
3.2 群体间的亲缘关系分析
单倍型结果显示,COI基因和Cytb基因都能够区分其中一些品系(黑锦鲤、全白锦鲤、全红锦鲤),但多数品系不具有独特的单倍型(所有的品系共享单倍型H1;黑锦鲤、三色锦鲤、红白锦鲤共享单倍型H2;三色锦鲤、红白锦鲤、黄金锦鲤、全红锦鲤共享单倍型H4),遗传距离结果与单倍型结果一致,SS、HB、HJ遗传距离较近,SS和QH之间的遗传距离最远。NJ系统进化树结果同样显示,黑锦鲤和全红锦鲤亲缘关系较近,三色锦鲤、红白锦鲤和黄金锦鲤亲缘关系较近,全白锦鲤单独聚为一支。锦鲤杂交遗传图谱、Pietsch等[20]和Kock等[19]的研究显示,黑锦鲤和全红锦鲤由铁真鲤(C.carpioTetsu Magoi)选育而来,因此它们的亲缘关系较近,聚为一支。红白锦鲤和黄金锦鲤由浅黄真鲤(C.carpioAsagi Magoi)选育产生,三色锦鲤由红白锦鲤选育而来,因此它们的亲缘关系较近,聚为一支。全白锦鲤虽然也由浅黄真鲤选育产生,但选育过程冗长,经历了多代杂交筛选,与其他品系的亲缘关系相对较远,但不排除个别个体与其他品系的亲缘关系较近。除全白锦鲤外,黑锦鲤、全红锦鲤和三色锦鲤、红白锦鲤、黄金锦鲤存在一定的交集,产生这种结果的原因可能是与锦鲤选育历史和市场流行趋势相关,现今品系选育大都以观赏性状为目标,通过种间杂交达到培育优质锦鲤的目的,也导致锦鲤基因杂合度高,遗传背景复杂。
3.3 单倍型分析的可行性
相较于其他分子标记,DNA序列分析[21]可更准确直接地反映物种的遗传多样性。鱼类线粒体基因中,COI基因和Cytb基因具有进化速率适中、易扩增、易排序[22]及富含系统发育信息[23]等优点,被广泛应用于种群遗传多样性研究、鱼类种质资源状况调查、物种鉴定及分子系统发育探究[7,24-27]。
本实验利用线粒体COI和Cytb基因对6个锦鲤养殖品系进行遗传多样性分析,明确品系间亲缘关系,为培育优质锦鲤品系提供研究基础,为锦鲤的遗传选育和种质保护提供一定的理论数据。
参考文献:
[1]陈湘粦,乐佩琦,林人端.鲤科的科下类群及其宗系发生关系[J].动物分类学报,1984(4):91-107.
[2]Kelsh R N.Genetics and evolution of pigment patterns in fish[J].Pigm Cell Res,2004,17(4):326-336.
[3]Hoekstra H E.Genetics,development and evolution of adaptive pigmentation in vertebrates[J].Heredity,2006,97(3):222.
[4]苏建通.锦鲤的养殖与鉴赏[M].北京:中国农业出版社,2011.
[5]刘静霞,周 莉,赵振山,等.锦鲤4个人工雌核发育家系的微卫星标记研究[J].动物学研究,2002,23(2):97-105.
[6]王安利,刘金海,王维娜.锦鲤总色素及色素组分的比较研究[J].水生生物学报,2005,29(6):694-698.
[7]孙 莉.长鳍鲤、锦鲤和龙凤鲤的遗传多样性研究[D].江苏扬州:扬州大学,2009.
[8]刘静霞,周 莉,魏丽华,等.红白锦鲤人工雌核发育纯系的微卫星标记分析[J].水生生物学报,2003,27(6):557-562.
[9]陈万光,王 慧.2个锦鲤人工养殖群体遗传多样性的微卫星标记分析[J].水生态学杂志,2009,2(1):47-50.
[10]龚 理,时 伟,司李真,等.鱼类线粒体DNA重排研究进展[J].动物学研究,2013,34(6):666-673.
[11]郭新红,刘少军,刘 巧,等.鱼类线粒体DNA研究新进展[J].遗传学报,2004,31(9):983-1000.
[12]Birky C W.The Inheritance of genes in mitochondria and chloroplasts[J].BioScience,1976,26(1):26-33.
[13]Tamura K,Dudley J,Nei M,et al.MEGA4:Molecular evolutionary genetics analysis (MEGA) software version 4.0[J].Mol Biol Evol,2007,24(24):1596-1599.
[14]Librado P,Rozas J.DnaSP v5:a software for comprehensive analysis of DNA polymorphism data[J].Bioinformatics,2009,25(11):1451-1452.
[15]Excoffier L,Laval G,Schneider S.Arlequin (version 3.0):An integrated software package for population genetics data analysis[J].Evol Bioinf Online,2005,1(4A):47-50
[16]Saitou N,Nei M.The neighbor-joining method:a new method for reconstructing phylogenetic trees[J].Mol Biol Evol,1987,4(4):406.
[17]童金苟,吴清江.三个鲤品种线粒体基因片段序列保守性[J].水生生物学报,2001,25(1):1-7.
[18]Fedorov A,Saxonov S,Gilbert W.Regularities of context-dependent codon bias in eukaryotic genes[J].Nucleic Acids Res,2002,30(5):1192.
[19]Kock S D,Gomelsky B.Japanese ornamental koi carp:origin,variation and genetics[M].Florida:CRC Press,Boca Raton,2015:27-53.
[20]Pietsch C,Hirsch P,Pietsch C,et al.Biology and ecology of carp[J].J Fish Biol,2015,88(2):825-826.
[21]Buonaccorsi V P,Mcdowell J R,Graves J E.Reconciling patterns of inter-ocean molecular variance from four classes of molecular markers in blue marlin (Makaira nigricans)[J].Mol Ecol,2001,10(5):1179-1196.
[22]俞建中.黄海鲽形目鱼类系统发生与分子进化的初步研究[D].山东青岛:中国海洋大学,2004.
[23]张 迪,雷光春,龚 成,等.基于COI基因序列的太湖新银鱼遗传多样性[J].湖泊科学,2012,24(2):299-306.
[24]Miya M,Takeshima H,Endo H,et al.Major patterns of higher teleostean phylogenies:a new perspective based on 100 complete mitochondrial DNA sequences[J].Mol Phylogen Evol,2003,26(1):121-138.
[25]刘连为,许强华,陈新军.基于线粒体COI和Cytb基因序列的北太平洋柔鱼种群遗传结构研究[J].水产学报,2012,36(11):1675-1684.
[26]单云晶,鲁翠云,李 超,等.基于线粒体COI基因序列的5种鲤养殖品种遗传多样性研究[J].中国水产科学,2013,30(5):931-938.
[27]于 涛,吴 彪,杨爱国,等.栉孔扇贝、虾夷扇贝及其杂交子代线粒体COI和Cytb基因遗传多样性分析[J].海洋科学,2016,40(3):1-9.

