碳酸盐碱胁迫下尼罗罗非鱼氨代谢两种途径时序研究
涂翰卿,赵金良,赵 岩,曹晓颖
(上海海洋大学,农业部淡水水产种质资源重点实验室,上海 201306)
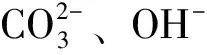
尼罗罗非鱼(Oreochromisniloticus)是我国重要的淡水水产养殖品种,生长速度快,抗逆性好,对盐、碱具有较强的耐受性,具备一定的盐碱水养殖潜能[11-14]。前期研究表明,碱胁迫下尼罗罗非鱼血氨浓度升高,相关组织内的谷氨酰胺合成酶、氨甲酰磷酸合成酶等氨代谢基因表达水平均与胁迫过程呈相应变化,推测即两种氨代谢途径共同参与调节血氨水平调节[15-16]。在此基础上,通过检测两种代谢途径主要产物尿素与谷氨酰胺的浓度的变化,关键酶的活性与基因表达量的变化,确认两种氨代谢途径的存在以及启动时序,为罗非鱼碱性水环境适应的研究提供基础资料。
1 材料与方法
1.1 实验材料
实验所用尼罗罗非鱼取自于上海海洋大学罗非鱼种质资源试验站,平均规格100 g,在室内淡水水族箱(0.6 m×0.5 m×0.4 m)内暂养2周,暂养期间正常喂食,定期换水,清理粪便,实验前3 d停食,排空粪便,挑选具有良好体征活力强的个体进行急性碱胁迫实验。
实验用水为经过曝气过夜处理的自来水与NaHCO3(分析纯)按比例配制,配制完成后放置1 d使用。使用便携式HI83200多参数水质分析仪测量修正碱度。
血氨测定试剂盒、尿素氮(BUN)测试盒(脲酶法)、谷氨酰胺测试盒购自南京建成生物公司;鱼氨甲酰磷酸合成酶(CPS)酶联免疫分析试剂盒、鱼谷氨酰胺合成酶(GS)酶联免疫分析试剂盒购自上海酶联生物科技有限公司;Trizol购自Invitrogen公司;PrimeScript RT reagent Kit With gDNA Eraser、SYBR Premix ExTaq购自TaKaRa公司。荧光定量所用引物来自上海生工生物工程有限公司。
1.2 实验方法
1.2.1 急性胁迫实验
先对尼罗罗非鱼进行碱度耐受性的预实验,6 g/L碱以下尼罗罗非鱼全部存活,所以设置了3个碱度组(2、4、6 g/L),每个组放置20尾,设置3个重复。实验期间对水体pH进行调控维持在8.5左右,并保持溶氧在3 g/L以上。
1.2.2 样品采集
分别于胁迫0、2、4、6、12、24、48、72 h,从3个碱度组各取3条鱼,并采集水箱中的水样4 ℃保存。通过挤压鱼腹部的方式收集尿液4 ℃保存。使用注射器从尾端静脉抽血4 ℃静置12 h后离心(3 000 r/min,4 ℃,10 min)取血清保存在-20 ℃冰箱。对鱼进行解剖,取出脑、鳃、肝、肾等组织后放置在-80 ℃冰箱内保存。
1.2.3 血氨、尿素、谷氨酰胺浓度测定
使用试剂盒分别检测血液中的氨浓度,肝、脑、鳃谷氨酰胺浓度,肝、肾、鳃组织及血液、尿液、水体中尿素浓度进行测定,使用Synergy H1酶标仪(Bio-tek,USA)检测其吸光值。
1.2.4 GS、CPS酶活性测定
分别取脑、肝,称重(0.5~1 g),按质量(g)︰体积(mL)= 1︰9 比例加入生理盐水,低温匀浆,4 ℃条件下离心(3 000 r/min,15 min),吸取上清液。使用试剂盒测定,用Synergy H1酶标仪读取吸光值,换算其含量。
1.2.5 GS、GLS2、CPS1基因mRNA表达
GS、GLS2、CPS1基因的特异扩增引物参照文献[16],由上海生工生物工程有限公司合成(表1)。鳃、肝、肾、脑组织在液氮中研磨碎,用Trizol提取总RNA,用RNase free ddH2O溶解,用OD-1000+分光光度计(Onedrop,国产)检测RNA浓度和A260/A280值,ABS值在1.8-2.1之间的样本保留。以总RNA为模板,按PrimeScript RT reagent Kit With gDNA Eraser 说明书操作反转录合成第一链cDNA。实时荧光定量PCR扩增参照SYBR Premix ExTaq说明书进行,扩增程序为:95 ℃ 预变性30 s;95 ℃ 变性5 s,58~62 ℃ 退火延伸30 s,40个循环;95 ℃ 熔解10 s,65 ℃ 退火5 s。根据结果调整扩增体系,使目的基因和内参基因扩增效率都接近100 %。扩增程序与标准曲线的扩增程序相同。最后采用2-ΔΔCt法对不同基因的表达量进行比较分析。

表1 引物信息Tab.1 The information of the primers
1.2.6 数据分析
实验数据使用SPSS 22统计软件分析,统计实验数据的平均值和标准差,单因素方差分析进行显著性检验,Duncan多重比较检测各测量指标的差异,以P<0.05为差异显著。
2 结果与分析
2.1 碱胁迫下血氨浓度的变化
胁迫开始后,实验鱼出现短时间不适反应现象,后逐渐消失,实验过程中实验鱼均保持存活。血氨浓度随着碱度、胁迫时间变化而升高,12 h到达峰值,24 h后维持高于初始水平(图1)。
2.2 碱胁迫下尿素浓度变化
碱胁迫下,血液尿素浓度0~6 h快速升高,于6 h达到峰值,12 h后维持高于初始水平(图2-a)。肝尿素浓度0~6 h快速升高,于6 h达到峰值,12 h后维持高于初始水平(图2-b)。鳃尿素浓度在0~2 h快速升高, 6~12 h再次升高,于12 h到达峰值,24 h后维持高于初始水平(图2-c)。肾尿素浓度在0~6 h快速升高,在6 h到达峰值,12 h后维持略高于初始水平(图2-d)。尿液尿素浓度在0~6 h升高,在6 h到达峰值,12 h后恢复初始水平,水体尿素浓度未发生明显波动(图3)。

图1 碱胁迫对尼罗罗非鱼血氨浓度的影响Fig.1 Effect of alkalinity stress on ammonia concentration in serum of O.niloticus
2.3 碱胁迫下谷氨酰胺浓度变化
碱胁迫下,肝谷氨酰胺浓度0~6 h快速升高,于6 h到达峰值,24 h后维持高于初始水平(图4-a)。脑谷氨酰胺浓度,在0~6 h快速升高后回落,12~72 h维持上升趋势(图4-b)。鳃谷氨酰胺浓度在0~2 h快速升高后回落, 6~24 h再次升高,于24 h到达峰值,48 h后维持高于初始水平(图4-c)。
2.4 碱胁迫下CPS、GS活性变化
碱胁迫下,肝GS活性0~6 h快速升高,12 h后再次升高于24 h到达峰值(图5-a)。鳃GS活性0~4 h快速升高,6 h后再次升高于24 h出现峰值(图5-b)。肝CPS活性在0~2 h迅速升高,2 h到达峰值后回落,12 h后维持高于初始水平(图5-c)。

图2 碱胁迫对尼罗罗非鱼血液(a)、肝(b)、鳃(c)和肾(d)中尿素浓度的影响Fig.2 Effect of alkalinity stress on urea concentration in blood(a),liver(b),gill(c)and kidney(d)of O.niloticus

图3 碱胁迫对尼罗罗非鱼尿液中尿素与水体中尿素浓度的影响Fig.3 Effect of alkalinity stress on urea concentration in urinary of O.niloticus and urea in water
2.5 碱胁迫对尼罗罗非鱼各基因在不同组织中的表达变化的影响
2.5.1 GS mRNA的相对表达变化
碱胁迫下,肝、脑GS基因的相对表达量随时间的变化而升高,于24 h到达峰值,且不同碱度组间随碱度提高而升高,其中6 g/L碱度组显著高于其它碱度组(图6)。
2.5.2 GLS2 mRNA的相对表达变化
碱胁迫下,鳃GLS2基因的相对表达量随时间的变化而升高,于24 h达到峰值。不同碱度组间, 2~6 h差异不显著,在12~24 h,6 g/L碱度组显著高于其它组(图7)。
2.5.3 CPS1 mRNA的相对表达变化
碱胁迫下,肝CPS1基因的相对表达量随时间的变化而升高,于24 h到达峰值。在6 h、24 h,6 g/L碱度组显著高于其它组,而其它时间点差异不显著(图8)。
3 讨论
3.1 碱胁迫对血氨浓度变化的影响


图4 碱胁迫对尼罗罗非鱼肝(a)、脑(b)和鳃(c)中谷氨酰胺浓度的影响Fig.4 Effect of alkalinity stress on glutamine concentration in liver(a),brain(b)and gill(c)of O.niloticus

图5 碱胁迫对尼罗罗非鱼肝(a)、脑(b)中GS和肝中CPS(c)活性的影响Fig.5 Effect of alkalinity stress on GS activity in liver(a),brain(b)and CPS activity in brain(c)of O.niloticus
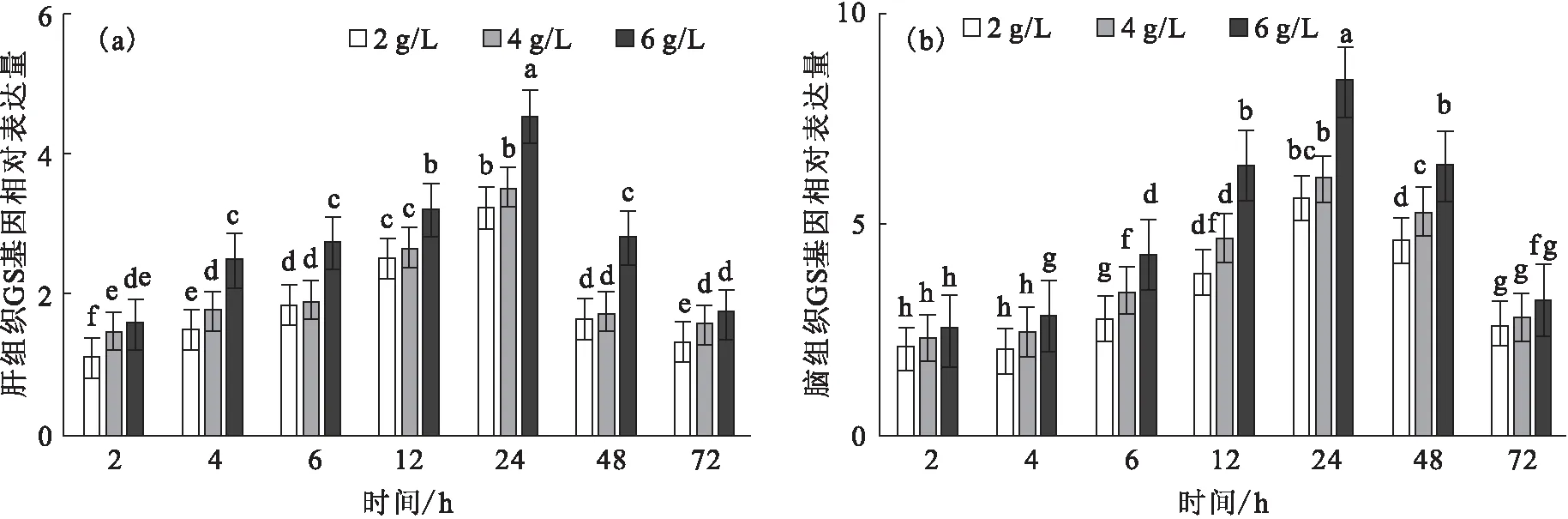
图6 碱胁迫对尼罗罗非鱼肝(a)和脑(b)GS基因的相对表达水平的影响Fig.6 Effect of carbonate alkalinity stress on relative expression of GS gene in liver(a)and brain(b)of O.niloticus注:标字母相同者表示差异不显著(P>0.05),不同字母者表示差异显著(P<0.05)。
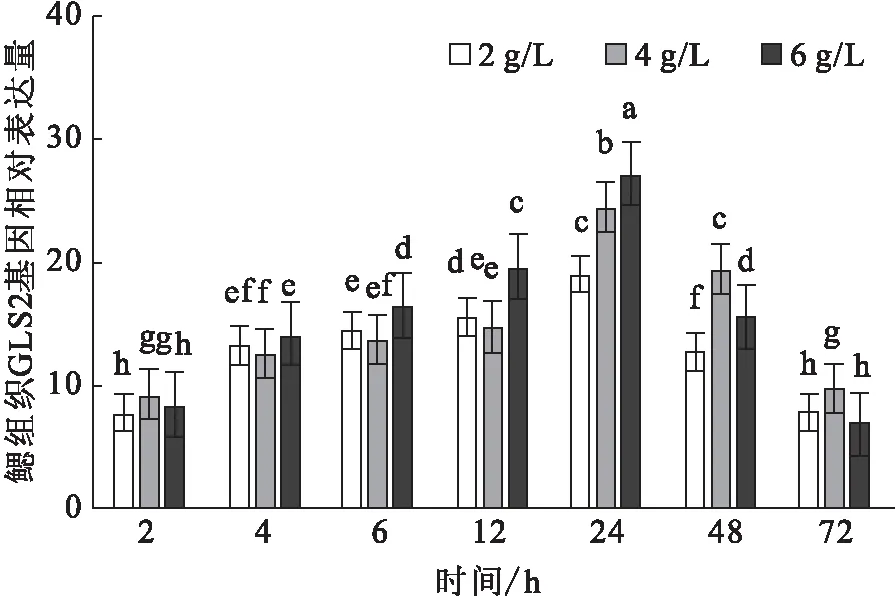
图7 碱胁迫对尼罗罗非鱼鳃中GLS2基因的相对表达水平的影响Fig.7 Effect of carbonate alkalinity stress on relative expression of GLS2 gene in gill of O.niloticus
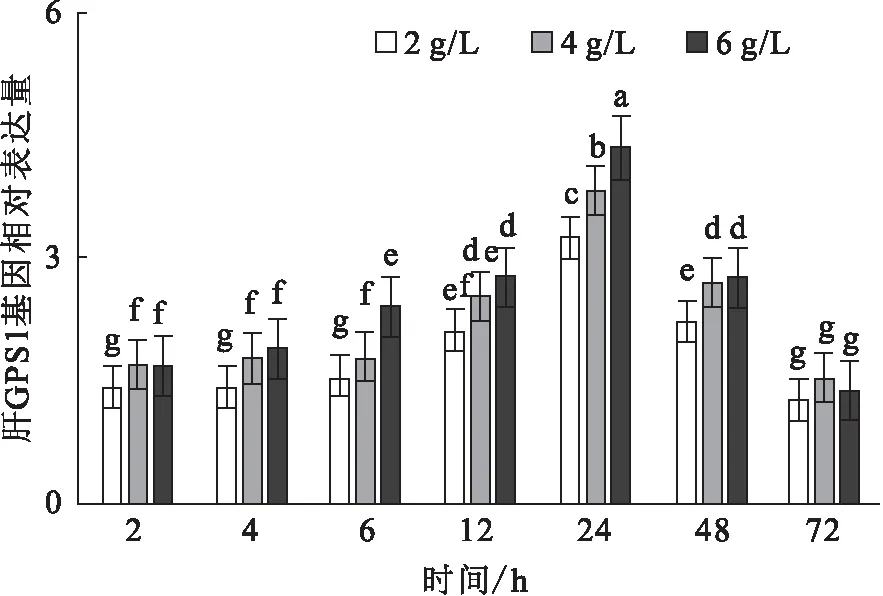
图8 碱度胁迫对尼罗罗非鱼CPS1基因的相对表达水平的影响Fig.8 Effect of carbonate alkalinity stress on relative expression of CPS1 gene in liver of O.niloticus
3.2 碱胁迫下氨的尿素代谢途径的启动
鱼体内的氨经CPS催化产生氨甲酰磷酸等一系列生化反应,最终产生尿素[10],经血液循环到达肾脏后排出体外,此外鳃也是重要的排泄尿素的器官,存在专门处理尿素转运的蛋白[22],如太平洋盲鳗的尿素主要依靠尿素转运蛋白Ut从鳃中排出[23]。本研究中,胁迫开始后随着血氨浓度的升高,尼罗罗非鱼血液、肝、肾和鳃中尿素水平在0~6 h内即出现明显升高,在生化水平上验证了尼罗罗非鱼体内氨的尿素代谢途径开始发挥了作用。肝中CPS酶活在0~2 h活性明显提升,及肝中CPS1基因的表达量也出现升高,在24 h出现最大值,这也从另一个侧面印证了尼罗罗非鱼氨的尿素代谢途径能在0~6 h内迅速启动。
已有研究表明大部分硬骨鱼在盐碱性水中以氨氮形式排泄60%~95%的含氮废物,其余基本以尿素氮形式排出[24],如土耳其境内凡湖中的塔氏卡拉白鱼(Chalcalburnustarichi)[25]、美国金字塔湖中的美洲鲑(Oncorhynchusclarkihenshawi)[26]。本研究中,水体中尿素浓度未发现明显的变化,且不同碱度胁迫的情况下,肝脏中尿素水平也非常接近,表明尿素途径可能并非是尼罗罗非鱼降氨的主要途径,而是原先正常的排氨途径受到抑制情况下的一种快速且有限的补救手段,在青海湖裸鲤上也有类似发现[27]。
3.3 碱胁迫下氨的谷氨酰胺代谢途径的启动
本研究胁迫开始后,随血氨的升高,肝谷氨酰胺浓度0~6 h快速升高,肝GS酶活性0~6 h快速升高,肝GS基因表达量也随胁迫开始升高,且均随碱度的提高而明显升高,表明将氨转化为谷氨酰胺的降氨机制开始启动,并应对碱胁迫降氨作用中发挥了不同的效能。而盐碱胁迫下GS基因表达量升高现象在青海湖裸鲤中也有发现[4]。谷氨酰胺对细胞膜具有很好的通透性,动物体内的氨即主要以谷氨酰胺的形式被运送到排泄部位[28],而鱼体中谷氨酰胺会被运送到鳃,经由GLS重新分解成氨,沿血液-水的扩散梯度从鳃上皮排出[22,29],或借助转运蛋白等载体排出[8]。在本研究中鳃GLS2基因的表达量随时间的变化而升高,在24 h到达峰值,变化趋势与肝中GS基因基本相似,则表明鳃将谷氨酰胺重新分解为氨排出体外的排氨机制也在迅速发挥作用。胁迫开始后脑GS基因的相对表达量的升高,脑GS酶活性的升高符合鱼脑中具有高水平的GS活性,以保护其免受氨毒性的观点[30]。马加迪湖的罗非鱼(Oreochromisalkalicusgrahami)在高氨氮环境中,能将体内过多的氨合成为谷氨酰胺储存起来或用于其他代谢活动[31]在本研究脑谷氨酰胺浓度的持续升高的现象中得到印证。有的研究表明谷氨酰胺不仅是细胞外液中氨基酸的主要来源[32],还具有改进免疫细胞功能,提高应激反应能力等多种生理功能[33],同时近来的研究表明,鱼类氨中毒死亡与星状胶质细胞肿胀诱发的氧化损伤和免疫抑制有关[34],所以尼罗罗非鱼在碱胁迫0~6 h内合成谷氨酰胺,可能并不只是为了降低体内氨的毒性效应,产生的谷氨酰胺还能够参与调节尼罗罗非鱼对胁迫的适应能力,保证机体存活。
4 结论
本研究表明在6 g/L以下碱胁迫的环境中,尼罗罗非鱼能够通过自身体内调节降低氨的浓度保证机体存活。在高碱胁迫下,原先通过鳃直接排氨途径受到抑制,尿素代谢能力在0~6 h内快速提升,在12 h时到达最大效能后很快回落,因为碱度的提升而表现出明显的增长,表明提高尿素合成只是其中一种补偿机制。谷氨酰胺代谢能力在0~6 h内快速提升,在24 h到达最大效能,回落后依然持续在较高水平较长时间,且表现出随碱度提升而增长,所以谷氨酰胺途径应是尼罗罗非鱼在碱胁迫下主要的降氨途径。
参考文献:
[1]中国农业部渔业管理局.2016中国渔业统计年鉴[M].北京:中国农业出版社,2016:1-2.
[2]王苏民,窦鸿身.中国湖泊志[M].北京:科学出版社,1998:3-8,84-85.
[3]梁利群,任 波,常玉梅,等.中国内陆咸(盐碱)水资源及渔业综合开发利用[J].中国渔业经济,2013,31(4):138-145.
[4]郭雯翡,么宗利,来琦芳,等.盐碱胁迫下青海湖裸鲤鳃基因表达差异[J].海洋渔业,2012,34(2):137-144.
[5]Ip Y K,Chew S F,Randall D J.Ammonia toxicity,tolerance and excretion[J].Fish Physiol,2001,20(1):109-148.
[6]Tsui T K,Randall D J,Chew S,et al.Accumulation of ammonia in the body and NH3volatilization from alkaline regions of the body surface during ammonia loading and exposure to air in the weather loachMisgurnusanguillicaudatus[J].J Exp Biol ,2002,205(5):651-659.
[7]Benli A C K,Köksal G,zkul A.Sublethal ammonia Exposure of Nile tilapia(OreochromisniloticusL.):Effects on gill,liver and kidney histology[J].Chemosphere,2008,72(9):1355-1358.
[8]Bolner K,Baldisserotto B.Water pH and urinary excretion in silver catfishRhamdiaquelen[J].J Fish Biol,2007,70(1):50-64.
[9]许友卿,李伟峰,丁兆坤.谷氨酰胺对水生动物免疫的影响及机理[J].动物营养学报,2012,24(3):406-410.
[10]Wood C M.Toxic response of the gill//Schlenk D,Benson W H.Target organ toxicity in marine and freshwater teleosts[M].London:Taylor & Francis,2001:1-89.
[11]Al-Amoudi M M.Acclimation of commercially cultured Oreochromis species to sea water-an experimental study[J].Aquaculture,1987 ,65(3-4):333-342.
[12]Lemarie G,Baroiller J F,Clota F,et al.A simple test to estimate the salinity resistance of fish with specific application toO.niloticusandS.melanotheron[J].Aquaculture,2004,240(1-4):575-587.
[13]么宗利,李思发,李学军,等.尼罗罗非鱼和以色列红罗非鱼耐盐驯化初步报告[J].上海水产大学学报,2003,(2):97-101.
[14]邢宪利.盐碱地池塘养殖罗非鱼试验[J].河北渔业,2010,(6):19-20.
[15]赵 岩,吴俊伟,孟 森,等.碳酸盐碱度胁迫对尼罗罗非鱼血清pH、游离氨浓度及相关基因表达的影响[J].南方农业学报,2016,47(6):1032-1038.
[16]吴俊伟,赵金良,赵 岩,等.高碳酸盐碱胁迫对尼罗罗非鱼氨代谢基因表达变化的影响[J].中国水产科学,2016 ,23(6):1290-1299.
[17]Wilkie M P,Wood C M.The adaptations of fish to extremely alkaline environments[J].Comp Biochem Physiol,1996,113(4):665-673.
[18]Parra J E G,Baldisserotto B.Effect of water pH and hardness on survival and growth of freshwater teleosts[M].USA:Science Publishers,2007 :135-150
[19]Binstock L,Lecar H.Ammonium ion currents in the squid giant axon[J].J Gen Physiol,1969,53(3):342-361.
[20]Cooper J L,Plum F.Biochemistry and physiology of brain ammonia[J].Physiol Rev,1987,67:440-519
[21]Wright P A,Wood C M.Muscle ammonia stores are not determined by pH gradients[J].Fish Physiol Biochem,1988,5(3):159-162.
[22]Wilkie M P.Ammonia excretion and urea handling by fish gills:present understanding and future research challenges[J].J Exp Zool,2002,293(3):284-301.
[23]Braun M H,Perry S F.Ammonia and urea excretion in the Pacific hagfish Eptatretus stoutii:evidence for the involvement of Rh and UT proteins[J].Com Biochem Phys A,2010,157(4):405-415.
[24]Wood C M.Ammonia and Urea Metabolism and Excretion[M].Boca Raton:CRC Press.1993:1-20.
[25]Danulat E,Kempe S.Nitrogenous waste excretion and accumulation of urea and ammonia inChalcalburnustarichi(Cyprinidae),endemic to the extremely alkaline Lake Van(Eastern Turkey)[J].Fish Physiol Biochem,1992,9(5-6):377-386.
[26]Wilkie M P,Wright P A,Iwama G K,et al.The physiological responses of the Lahontan cutthroattrout(Oncorhynchusclarkihenshawi),a resident of highly alkaline Pyramid Lake(pH 9.4),to challenge at pH 10[J].Exp Biol,1993,175(1):173-194
[27]衣晓飞,来琦芳,史建全,等.高碱环境下青海湖裸鲤氮废物排泄及相关基因的表达规律[J].中国水产科学,2017,24(4):681-689.
[28]李少飞.中国对虾氨氮代谢酶基因的cDNA克隆及其在氨氮解毒代谢过程中的作用[D].辽宁大连:大连海洋大学,2014.
[29]Evans D H,Piermarini P M,Choe K P.The multifunctional fish gill:dominant site of gas exchange,osmoregulation,acid-base regulation,and excretion of nitrogenous waste[J].Physiol Rev,2005,85(1):97-177.
[30]Wright P A,Steele S L,Hvitema A,et al.Induction of four glutamine synthetase genes in brain of rainbow trout in response to elevated environmental ammonia[J].J Exp Biol,2007,210(16):2905-2911.
[31]Jow L Y,Chew S F,Lim C B,et al.The marble gobyOxyeleotrismarmoratusactivates hepatic glutamine synthetase and detoxifies ammonia to glutamine during air exposure[J].J Exp Biol,1999,202(3):237-245.
[32]Kim M,Wischmeyer P E.Glutamine[J].World Rev Nutr Diet,2013,105 :90-96.
[33]Yin F G,Jiang W M,Guan S,et al.Glutamine and animal immune function[J].Food Agric Environ,2010,8(1):135-141.
[34]Ip Y K,Tay A S,Lee K H,et al.Strategies for surviving high concentrations of environmental ammonia in the swamp eelMonopterusalbus[J].Physiol Biochem Zool ,2004,77(3):390-405.

