KK-42对日本沼虾表皮蛋白基因MnCP-1表达的上调效应
苗泽龙,黄亚龙,吕艳杰,宁黔冀
(河南师范大学生命科学学院,河南新乡 453007)
日本沼虾(Macrobrachiumnipponense)隶属于软甲亚纲(Subclass Malacostraca)十足目(Order Decapoda)长臂虾科(Palaemonidae)沼虾属(Macrobrachium),是我国十分重要的淡水食用虾,其坚硬的表皮可以预防外界有害机体的物质进入,防止机体内部水和离子的丢失,表皮中的有机物主要是几丁质和表皮蛋白(cuticle proteins,CPs)[1],大多数的CPs都能结合几丁质构成网状结构。根据其氨基酸序列的不同将CPs划分为不同的家族,其中CPR (Cuticular Protein with Rebers Riddiford Consensus)家族是CPs中最大的家族,包含有保守的RR基序(Rebers-Riddiford consensus sequence)[2,3],即Gx8Gx6YxAxExGYx7Px2P(其中x代表的是任意一种氨基酸残基),该基序现在被公认为是结合几丁质的保守域,能够促进几丁质纤维和蛋白质基质间的相互作用[4,5]。在昆虫中对CPs的研究较为广泛,根据RR序列的变异程度进一步划分为三个亚族:RR-1,RR-2和RR-3[6]。而对甲壳动物CPs的研究报道相对较少,目前,通常以是否含有几丁质结合-4(chitin_bind_4,又叫pfam00379)结构域作为判断CPs的主要依据[4],该结构域其实是RR-1和RR-2亚族CPs的复合物[2]。
理论上,CPs的表达应该与甲壳动物的蜕皮周期有关。采用直接分离纯化方法,先后从日本对虾(Penaeusjaponicus)尾扇[7,8]、蓝蟹(Callinectessapidus)背部表皮[9,10]、克氏原螯虾(Procambarusclarkii)尾扇[11-14]等发现了数目不等的CPs,根据氨基酸序列推定编码蛋白的核苷酸序列,进而在转录水平上研究相关基因的表达在蜕皮周期中的变化,分析CPs在新旧表皮更替中的作用。随着生物信息学的发展,通过足够的已知序列信息进行基因功能的预测也已经成为一种有效的研究手段,比如Kuballa等[15]利用转录组测序,比较远海梭子蟹(Portunuspelagicus)在蜕皮周期不同阶段差异性表达基因的模式,探讨其可能的功能。
实验室前期研究发现,咪唑类物质KK-42可以显著缩短日本沼虾的蜕皮周期[16], 推测KK-42的作用机理可能与CPs表达的改变有关。由于CPs在不同物种间的相似性较低,有关日本沼虾CPs基因及其功能的研究目前尚未见报道。因此,本试验结合转录组测序和RACE技术,从头胸甲中克隆了一个编码日本沼虾CPs的全长cDNA序列,命名为MnCP-1,采用Real-time PCR分析了不同蜕皮时期MnCP-1在头胸甲中的表达,以及KK-42处理之后不同时间点MnCP-1的表达变化,为阐明KK-42的作用机理积累资料。
1 材料与方法
1.1 实验材料和KK-42处理
日本沼虾于2017年5-8月捕捞于河南卫辉顺城关公园,选取健康幼虾(体长3.0~4.0 cm)200尾随机分为对照组和实验组饲养于水族箱中,水温(22±1)℃,每天早上晚上各投喂一次,一周后用于实验。处理组使用浓度为1.95 ×10-4mol/L的KK-42浸泡1 min后迅速放入原水族箱内,按原方式喂养,同时以不含KK-42的溶液作为对照组做相同处理[17]。
1.2 RNA的提取
分别选取C期(蜕皮间期)、D0-2期(蜕皮前期早期)、D3-4期(蜕皮前期晚期)和A期(蜕皮后期)各4~5只幼虾,快速分离头胸甲组织,KK-42浸泡后的0、3、6、12、24和48 h的实验组和对照组分别取C期和D0-2期的头胸甲组织,利用Mini BEST Universal RNA Extraction Kit(TAKARA)试剂盒,按照说明书的操作步骤提取上述表皮组织的RNA。实验重复三次。蜕皮周期的鉴定依据Cesar等[18]的方法。
1.3 RNA反转录为cDNA
利用反转录试剂盒5X All-In-One RT Master Mix(abm),按照说明书的反转录条件将提取出的RNA反转录为cDNA模板。
1.4 MnCP-1 cDNA全长获得
利用软件Prime primer 5设计RACE外引物GSP-5′-outer和GSP-3′-outer以及RACE内引物GSP-5′-inner和GSP-3′-inner(表1),同时分别制备5′ RACE cDNA和3′ RACE cDNA。按照SMARTer RACE 5′/3′Kit(Clontech)说明书的操作步骤送生物工程股份有限公司测序拼接后得到MnCP-1 cDNA全长序列。
1.5 生物信息学分析
利用Conserved Domain (http://www.ncbi. nlm.nih.gov/Structure/cdd/wrpsb.cgi)确定MnCP-1的几丁质结合保守域,利用Open Reading Frame (ORF)Finder (http://www.ncbi.nlm.nih. gov/gorf/gorf.html)分析预测开放阅读框,并推导其编码的氨基酸序列。使用 DNAMAN 软件对这些基因进行多序列比对分析。相对分子质量和等电点应用在线工具ExPASy(http://web.expasy.org/protparam/)计算,使用MEGA6.06软件,采用邻接法(Neighbor-joining)构建MnCP-1系统进化树。
1.6 MnCP-1的表达分析
根据引物设计原则,利用软件Prime primer 5设计上、下游引物(表1)。按照AceQTM qPCR SYBR®Green Master Mix (Vazyme)试剂盒说明书步骤操作,β-actin为内参基因,实验均设3个重复,采用比较Ct值(2-ΔΔCt法)计算相对表达量,使用SPSS13.0进行显著性分析,P<0.01表示差异极显著。

表1 实时荧光定量PCR和RACE相关引物Tab.1 Primer sequences used for Real-time PCR and RACE
2 结果
2.1 MnCP-1的序列分析
MnCP-1 GenBank登录号为 KY065119,基因的cDNA序列全长为604 bp,包含69 bp的5′-非编码区(Untranslated region,UTR)和166 bp的3′-UTR以及369 bp的开放阅读框(Open reading frame,ORF),编码122个氨基酸,在其3′-UTR包含多聚腺苷酸加尾信号AATAAA。几丁质结合-4结构域位于126~281 bp(图1),预测的MnCP-1蛋白相对分子质量为13.394 kD,分子式为C598H909N161O186S2,理论等电点为4.41。MnCP-1与普通黄道蟹(Cancerpagurus,P81576.1)有61%的相似性(图2)。系统进化树显示,MnCP-1和地中海实蝇(Ceratitiscapitata)亲缘关系最近,聚为一支(图3)。

图1 MnCP-1全长cDNA序列和推导的氨基酸序列Fig.1 Full length sequence of MnCP-1 cDNA and deduced amino acid sequence灰色表示chitin_bind_4结构域,细线方框加粗字母表示RR基序保守位点,*表示终止密码子

图2 MnCP-1的保守区域氨基酸序列与其它物种的序列比对Fig.2 The alignment of amino acid sequences of putative catalytic region of MnCP-1 with those from other species黑色代表相同水平为100%,灰色代表相同水平≥50%

图3 使用MEGA 6.06采用邻接法构建MnCP-1的系统进化树Fig.3 Phylogenetic tree of selected MnCP-1 constructed using the neighbor-joining method in MEGA 6.06
蚤状溞(Daphnia pulex)EFX73274.1;大型溞(D.magna)KZR99743.1;黑脉金斑蝶(Danaus plexippus plexippus)OWR47245.1;棉铃虫(Helicoverpa armigera)XP 021200909.1;长角长虫兆(Orchesella cincta)ODM98266.1;地中海实蝇(Ceratitiscapitata)XP 020712733.1;蓝蟹(Callinectessapidus)AAV28476.1;家蚕(Bombyxmori)NP 001166710.1;白符跳(Folsomia candida)XP 021957998.1;日本囊对虾(Marsupenaeus japonicus)BAA90876.1;埃及伊蚊(Aedes aegypti)XP 001659105.1;柑橘凤蝶(Papilio xuthus)KPI97902.1;金凤蝶(P.machaon)KPJ11380.1;普通黄道蟹(Cancer pagurus)P81576.1;美洲螯龙虾(Homarus americanus)P81386.1;果蝇(Drosophila mojavensis)XP 002007519.2;日本沼虾(Macrobrachiumnipponense)AQT18916.1 用黑三角标定
2.2 MnCP-1的表达与蜕皮周期的关系
在蜕皮周期的不同阶段,头胸甲中MnCP-1的表达量变化显著,D3-4和A 期的表达量较高,分别是C期的27和183倍(图4)。
2.3 MnCP-1在KK-42处理后的表达变化
KK-42对头胸甲MnCP-1的表达有显著的上调效应,尤其是C期和D0-2期。与对照组在各个时间点相对稳定的表达不同,C期的处理组在6、12、24和48 h分别较对照组提高6、4、34和24倍以上(图5)。D0-2期的表达量在3 h急剧升高达到峰值,6 、24和48 h分别比对照增高了10、26和3倍以上(图6)。
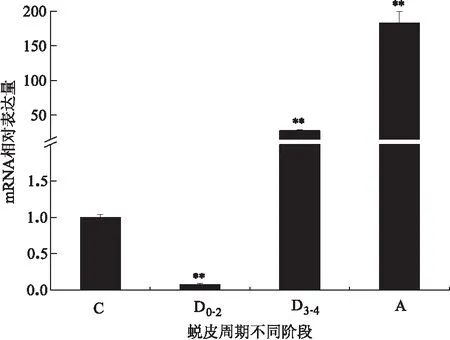
图4 头胸甲内MnCP-1在蜕皮周期不同阶段的表达变化Fig.4 The expression variation of MnCP-1 in carapace at different molt stagesC.蜕皮间期;D0-2.蜕皮前期早期;D3-4.蜕皮前期晚期;A.蜕皮后期;n=5/蜕皮阶段;“**”表示与C期相比有极显著差异(P<0.01)
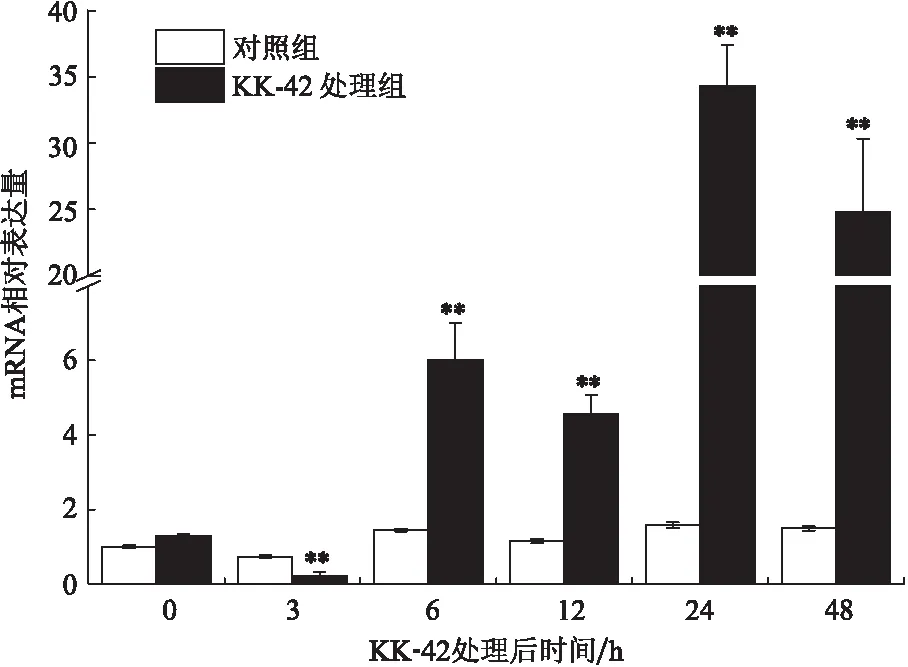
图5 KK-42对C期头胸甲MnCP-1 mRNA表达的影响Fig.5 The effect of KK-42 on the expression of MnCP-1 in carapace at stage C n=5/组/时间点;“**”表示与相应对照组相比有极差异显著(P<0.01),下同
3 讨论
CPs是构成甲壳动物表皮的基本成分,它是由上皮细胞按照一定的周期和步骤表达和合成的重要的结构性蛋白。本研究首次从日本沼虾的头胸甲中克隆出了含有几丁质结合-4结构域的MnCP-1 cDNA全长(图1),经多序列比对,MnCP-1与甲壳动物的多种CPs的相似性在40 %~61 %之间(图2)。系统进化树构建表明,甲壳动物与昆虫的CPs有着共同的祖先,随着时间的推移,动物进化分化出了不同的CPs,其中MnCP-1与地中海实蝇的亲缘关系最近(图3)。
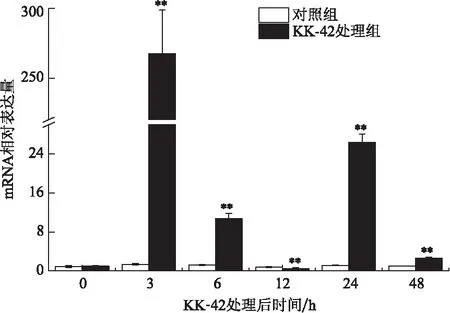
图6 KK-42对D0-2期日本沼虾头胸甲MnCP-1 mRNA表达的影响Fig.6 The effect of KK-42 on the expression of MnCP-1 in carapace at stage D0-2
研究表明,在蜕皮前期的晚期(D3-4期)新上表皮层下出现了越来越厚的新外表皮,在蜕皮后不久(A期),上皮细胞层会继续在新外表皮下合成新的内表皮[19]。甲壳动物中,多数CPs的表达与蜕皮周期密切相关。克氏原螯虾尾扇中的一种基质蛋白(被命名为Casp2)[13]和蓝蟹关节膜中的两种蛋白(被命名为CsAMP8.1和CsAMP13.4)[9,10]在蜕皮周期的D3-4期和A期表达最高,被认为参与外表皮与内表皮的形成。本研究结果与之类似,MnCP-1在D3-4和A期有高表达(图4),推测MnCP-1既参与了新外表皮的形成,又参与了蜕皮后新内表皮的形成。当然,在今后的研究中蛋白水平的验证是必要的。
合成和分泌CPs的表皮上皮细胞是蜕皮激素作用的靶细胞之一,实验室前期研究发现,KK-42能诱导日本沼虾蜕皮激素浓度峰值提前出现[20],与处理组MnCP-1在C和D0-2期的高表达结果一致(图5,6),提示KK-42可能通过提高蜕皮激素的浓度间接调节MnCP-1的表达,具体的分子机制还需进一步探究。MnCP-1在C和D0-2期转录水平的升高可能加快了日本沼虾新表皮的形成,促进了蜕皮进程,从而缩短蜕皮周期。
参考文献:
[1]Chang E S,Mykles D L.Regulation of crustacean molting:a review and our perspectives[J].Gen Comp Endocrinol,2011,172(3):323-330.
[2]Ioannidou Z S,Theodoropoulou M C,Papandreou N C,et al.CutProtFam-Pred:detection and classification of putative structural cuticular proteins from sequence alone,based on profile hidden Markov models[J].Insect Biochem Mol Biol,2014,52(1):51-59.
[3]Willis J H.Structural cuticular proteins from arthropods:annotation,nomenclature,and sequence characteristics in the genomics era[J].Insect Biochem Mol Biol,2010,40(3):189-204.
[4]Rebers J E,Willis J H.A conserved domain in arthropod cuticular proteins binds chitin[J].Insect Biochem Mol Biol,2001,31(11):1083-1093.
[5]Togawa T,Nakato H,Izumi S.Analysis of the chitin recognition mechanism of cuticle proteins from the soft cuticle of the silkworm,Bombyxmori[J].Insect Biochem Mol Biol,2004,34(10):1059-1067.
[6]Andersen S O.Studies on proteins in post-ecdysial nymphal cuticle of locust,Locustamigratoria,and cockroach,Blaberuscraniifer[J].Insect Biochem Mol Biol,2000,30(7):569-577.
[7]Watanabe T,Persson P,Endo H,et al.Molecular analysis of two genes,DD9A,and B,which are expressed during the postmolt stage in the decapod crustaceanPenaeusjaponicus[J].Comp Biochem Physiol Part B Biochem Mol Biol,2000,125(1):127-136.
[8]Ikeya T,Persson P,Kono M,et al.The DD5,gene of the decapod crustaceanPenaeusjaponicus,encodes a putative exoskeletal protein with a novel tandem repeat structure[J].Comp Biochem Physiol Part B Biochem Mol Biol,2001,128(3):379-388.
[9]Wynn A,Shafer T H.Four differentially expressed cDNAs inCallinectessapiduscontaining the Rebers-Riddiford consensus sequence[J].Comp Biochem Physiol Part B Biochem Mol Biol,2005,141(3):294-306.
[10]Faircloth L M,Shafer T H.Differential expression of eight transcripts and their roles in the cuticle of the blue crab,Callinectessapidus[J].Comp Biochem Physiol Part B Biochem Mol Biol,2007,146(3):370-383.
[11]Inoue H,Ohira T,Ozaki N,et al.Cloning and expression of a cDNA encoding a matrix peptide associated with calcification in the exoskeleton of the crayfish[J].Comp Biochem Physiol Part B Biochem Mol Biol,2003,136(4):755-765.
[12]Inoue H,Ohira T,Ozaki N,et al.A novel calcium-binding peptide from the cuticle of the crayfish,Procambarusclarkii[J].Biochem Biophys Res Commun,2004,318(3):649-654.
[13]Inoue H,Yuasahashimoto N,Suzuki M,et al.Structural determination and functional analysis of a soluble matrix protein associated with calcification of the exoskeleton of the crayfish,Procambarusclarkii[J].Biosci,Biotechnol,Biochem,2008,72(10):2697-2707.
[14]Suzuki M,Sugisakanobayashi A,Kogure T,et al.Structural and functional analyses of a strong chitin-binding protein-1 (SCBP-1)from the exoskeleton of the crayfishProcambarusclarkii[J].Biosci Biotechnol Biochem,2013,77(2):361-368.
[15]Kuballa A V,Holton T A,Paterson B,et al.Moult cycle specific differential gene expression profiling of the crabPortunuspelagicus[J].BMC Genom,2011,12(1):147.
[16]Guan J Y,Lv Y J,Zhang Y,et al.A shortening effect of KK-42 on the moult cycle of juvenileMacrobrachiumnipponense(De Haan,1849)(Decapoda,Palaemonidae)[J].Crustaceana,2016,89(1):85-95.
[17]Ning Q J,Fu S G,Xu X J,et al.A new and practical application of JH antagonist KK-42 to promoting growth of shrimpPenaeusschmitti[J].Aquaculture,2007,270(1):422-426.
[18]Cesar J R D O,Zhao B,Malecha S,et al.Morphological and biochemical changes in the muscle of the marine shrimpLitopenaeusvannameiduring the molt cycle[J].Aquaculture,2006,261(2):688-694.
[19]Kuballa A V,Merritt D J,Elizur A.Gene expression profiling of cuticular proteins across the moult cycle of the crabPortunuspelagicus[J].BMC Biology,2007,5(1):1-26.
[20]刘 方,陈香丽,郭爱莲,等.KK-42对日本沼虾蜕皮激素及其受体表达的影响[J].河南师范大学学报(自然科学版),2013,41(4):124-127.

