腔隙性脑梗死合并脑微出血的危险因素及影像学特征
康健捷 黎春镛 杨红军 邓兵梅 崔 静 项 薇 熊铁根 邓文婷 齐自娟 王伟民
(广州军区广州总医院神经内科,广东 广州 510010)
脑微出血(CMBs) 是指由脑内微小血管病变所致的脑微量出血,是一种脑部小血管病的标志,以往常常被认为是脑实质亚临床损害;而且,由于CMBs在头颅CT或常规磁共振成像(MRI)序列检查中难以被发现,一般又无症状或体征,故往往不被临床医生关注。近些年,随着神经影像学的发展,一种新的磁共振对比成像技术磁敏感加权成像(SWI)被引入临床,使CMBs的检出率不断增加而逐渐成为研究热点。近年来,病理和影像对照研究证实CMBs病理改变为陈旧出血和含铁血黄素沉积,其病变与多种神经系统病变存在一定的关联,如高血压血管病变、阿尔茨海默病、脑淀粉样血管病等〔1〕,有可能成为脑梗死发生或复发、溶栓治疗或抗血小板治疗后出血转化、血管性认知功能障碍和痴呆的预测因素〔2,3〕。然而,国内外大样本的研究较多采用梯度回波T2加权像(GRE-T2WI)的检测方法〔3,4〕,SWI是近年才发展起来的,较GRE-T2WI可检出的CMBs多近2/3。因此,本研究采用前瞻性研究方法,选取腔隙性脑梗死患者通过SWI甄别CMBs,分析腔隙性脑梗死合并CMBs患者的临床特征、CMBs的发生率、影像特点及其发生的危险因素,以期为临床医师诊治和预防CMBs提供线索。
1 对象与方法
1.1研究对象 采用前瞻性研究方法,连续收集2015年4月至2017年10月在广州军区广州总医院神经内科住院的腔隙性脑梗死患者127例,其中男73例,女54例,纳入标准:(1)符合中国脑血管病防治指南(2010)的缺血性脑卒中诊断标准;(2)头部MRI检查示腔隙性脑梗死,病灶直径3~20 mm,单发或多发;(3)美国国立卫生研究院卒中量表(NIHSS)评分≤3分;(4)年龄大于45岁;(5)签署知情同意书。排除标准:(1)头颅MRI检查显示出血性脑血管病;(2)头颅MRI检查显示大面积脑梗死或皮层梗死;(3)NIHSS评分>3分;(4)其他颅脑外伤、恶性肿瘤、感染性疾病等非血管性原因造成的脑运动功能、语言功能、认知功能障碍;(5)伴严重内脏疾病或血液系统疾病;(6)服用免疫抑制剂或抗凝药物;(7)存在幽闭恐惧症等心理疾病,不能行MRI检查者。
1.2基本资料收集 收集所有入选患者的性别、年龄、吸烟史、饮酒史、高血压史、糖尿病史、有无口服抗血小板聚集治疗、入院时收缩压(SBP)、舒张压(DBP)。吸烟定义为平均≥1支/d,时间≥1年;饮酒定义为饮酒≥3次/w,平均≥50 g/d,时间≥1年;口服抗血小板聚集治疗定义为阿司匹林100 mg/d或氯吡格雷75 mg/d,连续3个月以上。
1.3生化指标检测 患者入院后次日清晨空腹采集外周静脉血,检测总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、三酰甘油(TG)、血清肌酐(SCR)、尿酸(UA)、同型半胱氨酸(HCY)、纤维蛋白原(FIB)、糖化血红蛋白(HbA1c)、血清白蛋白(ALB)。
1.4影像检查及评估
1.4.1MRI和CT检查 采用美国GE公司3.0T超导核磁共振进行颅脑MRI检查和脑血管成像(MRA)检查,主要技术参数:8通道头颅线圈,FSE序列T2WI(TR 3 400 ms,TE 110 ms),T1flair(TR 1 750 ms,TE 24 ms),T2flair序列(TR 9 000 ms,TE 150 ms),DWI(TR 5 300 ms,TE minimum,b值为 1 000);SWAN 3D容积扫描,参数为:TR minimum,TE 30 ms,翻转角15°,层厚2 mm,层距-1.5 mm,矩阵320×224,总扫描时间约5 min,采集所得图像在工作站进行最小密度投影,重建成层厚为5 mm、层距为2 mm的SWAN图像。对所有入组患者进行长期门诊随诊,若患者发生急性脑血管意外,则立即行颅脑CT扫描,根据CT图像确定是否有出血转化。按照美国国家神经系统疾病和脑卒中研究所(NINDS)标准:脑实质内均质高密度病变,可伴有水肿或占位效应,为脑实质血肿〔5〕。所有的图像均由两位以上经验丰富的副高级以上职称的神经影像医生独立判断,参加读片的医师对研究对象的病史均不知情,当结果不一致时协商决定。
1.4.2CMBs诊断标准及结果评定 CMBs定义为SWI上脑实质内直径2~10 mm的圆形或卵圆形的均匀低信号影,边界清楚,且周围无水肿。除外其他具有相似影像学表现的情况如小血管流空影(SWI图像血管连续性可以区分)、钙化、海绵状血管瘤等。按照微出血解剖量表(MARS)的标准图谱〔6〕进行CMBs的部位及数量记录。CMBs的部位分为三种,皮层-皮层下包括大脑半球皮质和皮质下区域,深部包括基底节、丘脑、内囊、外囊、胼胝体和脑室周围10 mm区域的脑白质,幕下包括脑干和小脑。根据CMBs数量进行严重程度分级:0级(无)、1级(1~5个)、2级( 6~15个)和3级(≥15个)〔7〕。根据有无微出血灶将腔隙性脑梗死患者分为CMBs组和无CMBs组。
1.4.3腔隙性脑梗死和脑白质疏松脑白质病变(WMLs) 腔隙性脑梗死影像学表现为皮质下直径在3~15 mm边界清楚的缺血性病灶,T1序列表现为低信号或等信号影像,T2序列表现为高信号影像〔8〕。测量采用Fazekas评分〔9〕分别对深部脑白质高信号(DWMH)及脑室旁白质高信号(PVH)进行测量。脑室旁评分:0分为无病变;1分为帽状或铅笔样薄层病变;2分为病变呈光滑的晕圈;3分为不规则的脑室旁高信号;深部白质评分为:0分为无病变;1分为点状病变;2分为病变开始融合;3分为病变大面积融合。
1.4.4脑动脉硬化和颅内动脉血管狭窄 采用磁共振脑血管成像(MRA)检查,记录是否有脑动脉硬化、狭窄动脉的名称和数量。
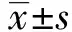
2 结 果
2.1CMBs与无CMBs组临床资料比较 127例腔隙性脑梗死患者中CMBs发生率为33.1%(42例)。CMBs组的年龄、高血压史比例及收缩压水平显著高于无CMBs组(P<0.05),前者的HDL-C显著低于后者(P<0.05)。两组患者性别、糖尿病史、吸烟史及饮酒史的比例、TC、LDL-C、TG、SCR、UA、HCY、FIB、HbA1c、ALB水平比较差异无统计学意义(P>0.05)。见表1 。
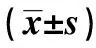
表1 CMBs组和无CMBs组临床资料比较
2.2CMBs组与无CMBs组的颅脑影像学比较 CMBs组CMBs病灶数目1~59个,CMBs总数为233个,其中单个CMBs者18例(42.8%),1级25例(59.5%),2级13例(31.0%)和3级4例(9.5%),其中3级4例患者均表现为深部CMBs。CMBs的发生部位依次为基底节(30.0%),丘脑(13.3%),额叶或额叶白质(13.3%),小脑(12.5%),颞叶或颞叶白质(9.9%),顶叶或顶叶白质(8.2%),枕叶(6.4%)及脑干(5.6%)。根据MARS的部位,皮层-皮层下CMBs出现率占CMBs总数量的38.6%(90/233),深部为43.4%(101/233),幕下为18.0%(42/233)。
CMBs组腔隙性脑梗死的数量显著多于无CMBs组(P<0.001)。CMBs组的PVH及DWMH的中重度比例显著高于无CMBs组(均P<0.001)。两组脑动脉硬化发生率差异无统计学意义(P>0.05)。CMBs组的颅内动脉血管狭窄有2例(4.8%),无CMBs组19例(23.2%),两组比较差异有统计学意义(P=0.01)。见表2。
2.3多元Logistic回归分析 根据单因素比较结果,以是否出现CMBs为因变量,以年龄、高血压史、入院时SBP、HDL水平、中重度DWMH为自变量,进行多因素Logistic回归分析;中重度PVH及腔隙性脑梗死数目因与中重度DWMH存在共线性(r>0.5),未纳入Logistic 回归分析。结果显示年龄、高血压史、入院时SBP、中重度DWMH是发生CMBs的独立危险因素(P<0.05)。见表3。

表2 CMBs组和无CMBs组影像学的比较〔n(%)〕
2.4伴CMBs的危险因素与CMBs部位及数量的关系 校正年龄及性别后,偏相关分析显示,高血压史与深部CMBs的数量显著相关(r=0.731,P=0.025),而与皮层-皮层下CMBs及幕下CMBs数量无显著相关(r=0.151,P=0.451;r=0.127,P=0.103)。中重度DWMH与皮层-皮层下CMBs及深部CMBs数量存在显著相关(r=0.281,P=0.001;r=0.364,P=0.001),而与幕下CMBs数量无显著相关(r=0.163,P=0.065)。

表3 腔隙性脑梗死合并脑微出血的危险因素的Logistic多元回归分析
2.5CMBs与出血转化的关系 所有入组患者入院后均给予抗血小板聚集等治疗,长期门诊随诊,随访时间为1~30个月。无CMBs组、CMBs组1级和3级患者均未发现出血转化,2级CMBs患者中有2例发生丘脑出血(在入组时CMBs部位主要在深部,CMBs灶数目分别为10个和12个)。
3 讨 论
脑小血管疾病(CSVD)包括小的皮质下梗死、腔隙性脑梗死、脑白质疏松、扩大的血管周围间隙、CMBs、皮质萎缩〔10〕。其中,腔隙性脑梗死属于轻微神经功能缺损的脑卒中,颅内微小血管病变是其病理学基础〔11〕。腔隙性脑梗死后再发脑卒中和出血转化的风险较高〔12〕。而CMBs是具有出血倾向的脑小血管病,是由微小血管病变引起的脑小血管周围少量出血,这些含铁血黄素沉着灶在SWI上表现为直径<10 mm的圆形信号丢失。研究显示,随着CMBs进展,再发脑卒中风险会明显增加〔13,14〕。
研究发现〔15,16〕,在健康人群中CMBs发生率约4%~6%,而缺血性脑卒中患者CMBs患病率为31%~36%,腔隙性脑梗死及非致残性皮层脑梗死患者CMBs发生率为15%,随着年龄的增长CMBs检出率增加,年龄80岁以上老年人群CMBs发生率高达38%。本研究发现腔隙性脑梗死患者CMBs发生率偏高,可能原因为SWI的CMBs检出率比GRE-T2WI更高、入组患者年龄偏大及与纳入研究的患者种族不同和检测水准不同有关。目前已有许多研究探讨了CMBs的危险因素,包括性别、高龄、高血压、既往脑卒中史、脑白质病变、高UA血症、高HCY血症、肾小球滤过率等〔17〕。
在众多CMBs危险因素中,年龄是否为CMBs危险因素许多学者观点不一〔18,19〕。本研究提示增龄是CMBs的危险因素。推测随着年龄增长,血管硬化和血管淀粉样变程度加重从而导致CMBs增多。与既往研究结果一致,本研究结果显示在腔隙性脑梗死人群中,高血压是CMBs的强危险因素。此外,高动态血压水平也被认为是预测CMBs出现的重要因素,本研究也显示较高水平的SBP是CMBs的独立危险因素,支持高血压动脉硬化参与了CMBs的发生,可能因为长期慢性高血压引起脑内微小血管的平滑肌被纤维组织或坏死组织代替,血管管壁增厚硬化、脂质透明样变、管壁弹性减弱,从而微小动脉瘤形成和微小血管破裂,血液外渗形成微出血。这同时也提示严格控制SBP是预防CMBs的重要措施之一。
既往关于血清学标记与CMBs关系的研究结果并不一致。有研究者认为高UA血症、高HCY血症是CMBs的独立危险因素〔17〕,本组研究显示CMBs和非CMBs组UA和HCY水平并无显著性差异。近年来有一些研究发现CMBs与微量蛋白尿、肾小球滤过率相关,可作为肾小血管损害的标志〔17,20〕,其与慢性肾功能不全的关系值得进一步研究。
作为一种脑微小血管病变的类型,脑白质疏松在MRI表现为白质部分边缘模糊的斑片状低密度影,分为临床意义并不完全相同的PVH及DWMH两种类型。一般认为,DWMH与CSVD关系密切〔3〕。脑白质疏松属于CSVD中的缺血性改变,而CMBs为微血管的出血性改变,二者的严重程度在一定程度上可以反映微血管损伤的情况,可作为CSVD严重程度的预测因子之一。
目前较少有研究探讨CMBs的危险因素对CMBs部位与数量的影响。本研究探讨了DWMH与CMBs分布与数量的关系,在校正年龄及性别后,偏相关分析显示,高血压史与深部CMBs的数量显著相关,与皮层-皮层下及幕下CMBs数量无密切关系,这与高血压性脑出血最常见于基底节区与丘脑等大脑深部是一致的,提示了深部CMBs的病因是高血压性小动脉病变。既往研究〔20〕证实脑叶型CMBs与载脂蛋白(APO)Eε4等位基因及他汀类药物使用相关,而高血压尤其SBP水平与深部及幕下型CMBs相关。本研究未发现高血压史及SBP与幕下型CMBs的数量相关,推测可能是因为样本量偏小所致。作为自发性脑出血的常见病因,高血压性脑血管病及淀粉样脑血管病同时也是CMBs主要病因,那么,CMBs能否作为脑出血的预测因子呢?目前研究观点不一〔13,14〕。本研究提示单个CMBs可能并不增加未来脑出血的风险,而CMBs数量>5个可能显著增加脑出血风险。3级CMBs患者均未发现出血转化,考虑与3级患者样本量少(共4例)和随访时间有限有关。所以,尚需扩大样本量及延长随访时间进一步证实。
在本研究中,不论有无CMBs,腔隙性脑梗死患者的脑动脉硬化发生率都很高,推测是因为颅内微小血管病变与大血管病变在发病机制上存在差异所致,有CMBs的腔隙性脑梗死患者以颅内微小血管病变为主,而无CMBs的腔隙性脑梗死患者有相当比例除CSVD外,同时伴有颅内大血管病变。
综上所述,腔隙性脑梗死患者CMBs发生率较高,SWI序列有利于检测CMBs的数量和部位,可以反映颅内微血管损伤的部位和程度。故临床上应重视CMBs的早期诊断与预防,推荐脑血管病患者常规进行磁共振SWI序列检查,用于脑卒中的治疗、病情判断、预后分析及评估出血转化的风险。
4 参考文献
1Werring DJ,Gregoire SM,Cipolotti L.Cerebral microbleeds and vascular cognitive impairment〔J〕.J Neurol Sci,2010;299(2):131-5.
2Steven M,Greenberg MD.Cerebral microbleeds:a guide to detection and interpretation〔J〕.Lancet Neurol,2009;8(2):165-74.
3Poels MM,Vernooij MW,Ikram MA,etal.Prevalence and risk factors of cerebral microbleeds:an update of the Rotterdam Scan Study〔J〕.Stroke,2010;41(10):103-6.
4Fluri F,Jax F,Amort M,etal.Significance of microbleeds in patients with transient ischaemic attack〔J〕.Eur J Neurol,2012;19(3):522-4.
5Lindley RI,Wardlaw JM,Sandercock PA,etal.Frequency and risk factors for spontaneous hemorrhagic transformation of cerebral infarction〔J〕.J Stroke Cerebrovasc Dis,2007;13(6):235-46.
6Gregoire SM,Chaudhary UJ,Brown MM,etal.The Microbleed Anatomical Rating Scale (MARS):reliability of a tool to map brain microbleeds〔J〕.Neurology,2009;73(21):1759-66.
7Lee SH,Bae HJ,Kwon SJ,etal.Cerebral microbleeds are regionally associated with intracerebral hemorrhage〔J〕.Neurology,2004;62(1):72-6.
8Lee SH,Bae HJ,Ko SB,etal.Comparative analysis of the spatial distribution and severity of cerebral microbleeds and old lacunes〔J〕.J Neurol Neurosurg Psychiatry,2004;75(3):423-7.
9Fazekas F,Schmidt R,Scheltens P.Pathophysiologic mechanisms in the development of age-related white matter changes of the brain〔J〕.Dement Geriatr Cogn Disord,1998;9(Suppl1):2-5.
10Wardlaw JM,Smith C,Dichgans M.Mechanisms of sporadic cerebral small vessel disease:insights from neuroimaging〔J〕.Lancet Neurol,2013;12:483.
11Wardlaw JM,Doubal F,Armitage P,etal.Lacunar stroke is associated with diffuse blood-brain barrier disfunction〔J〕.Ann Neurol,2009;65(2):194-202.
12Lovelock CE,Redgrave JN,Briley D,etal.Reliable estimation of the proportion of minor stroke due to intracerebral haemorrhage〔J〕.Int J Stroke,2009;4(1):6-10.
13Charidimou A,Werring DJ.Cerebral microbleeds as a predictor of macrobleeds:what is the evidence〔J〕.Int J Stroke,2014;9(4):457-9.
14Kwa VI,Algra A,Brundel M,etal.Microbleeds as a predictor of intracerebral haemorrhage and ischaemic stroke after a TIA or minor ischaemic stroke:A Cohort Study〔J〕.BMJ Open,2013;3(5):1-6.
15Cordonnier C,AL-Shahi Salman R,Wardlaw J.Spontaneous brain microbleeds:systematic review subgroup analyses and standards for study design and reporting〔J〕.Brain,2007;130(8):1988-2003.
16Staals J,Makin SD,Doubal FN,etal.Stroke subtype,vascular risk factors,and total MRI brain small-vessel disease burden〔J〕.Neurology,2014;83(14):1228-34.
17Kim BJ,Lee SH.Cerebral microbleeds:their associated factors,radiologic findings,and clinical implications〔J〕.J Stroke,2013;15(3):153-63.
18Charidimou A,Kakar P,Fox Z,etal.Cerebral microbleeds and the risk of intracerebral haemorrhage after thrombolysis for acute ischaemic stroke:systematic review and meta-analysis〔J〕.J Neurol Neurosurg Psychiatry,2013;84(3):277-80.
19Poels MM,Ikram MA,Van Der Lugt A,etal.Incidence of cerebral microbleeds in the general population:the Rotterdam Scan Study〔J〕.Stroke,2011;42(3):656-61.
20Oksala NK,Salonen T,Strandberg T,etal.Cerebral small vessel disease and kidney function predict long-term survival in patients with acute stroke〔J〕.Stroke,2010;41(9):1914-20.

