银杏叶多糖对高脂饮食诱导的糖尿病视网膜病变保护作用及机制
齐 若 周利晓 顾志敏 霍银平
(郑州大学第五附属医院眼科,河南 郑州 450052)
糖尿病视网膜病变(DR)是糖尿病严重的并发症之一〔1〕。然而,到目前为止,对DR还没有高效无害的治疗措施。 本研究拟观察银杏叶多糖(PGBL)对糖尿病动物模型视网膜神经节细胞及其对基质金属蛋白酶(MMP)-9、诱导型一氧化氮合酶(iNOS)表达的影响。
1 材料与方法
1.1仪器与试剂 PGBL(西安天瑞有限公司);Trizol (生工生物技术有限公司);MMP-9、iNOS 引物 (生工生物科技有限公司);血糖试剂盒,南京建成生物工程研究所。UV-1100紫外-可见分光光度计,北京瑞利分析仪器公司。PCR仪(Thermo赛默飞世尔科技公司,美国),BH-Nxe-B 型倒置显微镜(日本 Olympus Optical 公司)。
1.2动物 购于广东省实验动物中心,SPF级SD大鼠,雄性,30只,体重220~280 g。造模方法:将SD大鼠适应性喂养10 d后,随机挑选20只喂养高脂饲料,其余大鼠喂养正常饲料,为正常组(N)。高脂饲料造模45 w后,通过眼静脉丛取血,前三滴血弃去,检测其血糖值,空腹血糖>16.7 mmol/L,则模型成立。随后将糖尿病大鼠随机分为模型组(DM)与PGBL组各10只。各组大鼠均饲养在SPF级动物房中,自由饮纯净水。给药方法:PGBL组中,每只大鼠按150 mg·kg-1·d-1灌胃PGBL溶液。DM组和N组均灌服等体积生理盐水,连续12 w。
1.3取材 将每组大鼠处死后取出的右侧眼球,立即放入-80℃超低温冰箱内保存。在解剖显微镜下沿角膜缘后2 mm切开,眼科剪环形剪开,去除掉眼前节,利用重力与惯性将玻璃体缓慢去除,视网膜会随之脱出,将两者分开即可得到视网膜组织。
1.4葡萄糖耐量实验(OGTT) 大鼠禁食12 h,尾静脉取血一滴,血糖仪测其空腹血糖值(0 min),然后以2.5 g/kg剂量灌胃大鼠葡萄糖溶液,分别于灌胃后30、60、120、180 min取血测定各组大鼠相应时间点血糖值。根据各时间点的血糖值,绘制血糖时间曲线图。
1.5视网膜神经节细胞存活计数 于缺血再灌注损伤前1 d利用荧光金逆行追踪剂标记视网膜神经节细胞。用10%水合氯醛麻醉大鼠,固定头部,将头皮沿着头骨中线旁,约上丘的位置制备2个孔洞,注入荧光金。手术完成后缝合伤口。于实验后处死大鼠,将眼球小心取出,将眼球避光固定于多聚甲酸1 h后,将视网膜取出,铺于载玻片上,在显微镜下计数神经节细胞。
1.6实时定量聚合酸链反应 将眼视网膜组织加入Trizol中匀浆,每1 ml Trizol 加入 0.2 ml三氯甲烷;剧烈混合30 s后,4℃ 12 000 r/min离心10 min,将水相层液体小心转移至新的离心管中;然后加入0.5 ml异丙醇,混合均匀,室温静置10 min;随后4℃,12 000 r/min离心10 min,可见少量RNA沉淀;吸弃上清溶液,用75%乙醇洗涤沉淀两次;4℃ 7 500 r/min离心沉淀5 min,弃上清,空气中干燥RNA沉淀,用DEPC水溶解RNA沉淀;取2 μl溶解后的RNA,用紫外分光光度法测定RNA纯度及浓度;计算总RNA浓度。将溶解后的RNA按说明试剂盒说明书进行逆转录及扩增。引物iNOS:前向:5′-GCAACATCAGGTCGGCCATTACT-3′,反向:5′-AGCCCAGGTCGATGCACAAC-3′;MMP-9:前向:5′-TGCGCTGGGCTTAGATCATT-3′,反向:5′-TGGATGCCTTTTATGTCGTCTTC-3′;actin:前向:5′-CTGAACCCTAAGGCCAACCGTGAAA-3′,反向:5′-TGAAGCTGTAGCCACGCTCGGTC-3′,扩增条件为95℃,2 min;95℃,5 s,60℃,32 s,共40个循环。
1.7统计学处理 采用SPSS10.0软件行单因素方差分析(ANOVA)。
2 结 果
2.1PGBL对各组大鼠一般状态体重、空腹血糖水平的影响 给药12 w后,与N组大鼠比较,DM组大鼠活动减少,毛发枯黄易脱落、脾性暴躁,给予PGBL干预后,大鼠精神状况明显改善,活动较活跃,毛发光滑不易脱落,进食量稍增加,饮水量及尿量均少于DM组。与N组〔(338.6±41.8)g,(6.1±0.7)mmol/L〕相比,DM组大鼠体重〔(217.4±25.2)g〕显著下降、空腹血糖〔(17.8±2.2)mmol/L〕明显增高(P<0.01)。PGBL组大鼠与DM组比较,体重〔(256.9±30.1)g〕上升(P<0.05)、空腹血糖〔(14.3±1.6)mmol/L〕明显下降(P<0.05)。
2.2PGBL对各组大鼠葡萄糖耐量的影响 各组大鼠灌胃葡萄糖后,血糖水平均出现不同程度上升,然后慢慢下降,至180 min血糖值趋于平稳。在这一过程中,DM组大鼠各时间点血糖值均高于N组(P<0.01),在30 min内达到峰值,随后N组大鼠血糖恢复到正常状态,DM组大鼠在180 min后血糖值仍维持在较高水平;与DM组相比,PGBL组大鼠在给药的30 min内出现血糖峰值,后血糖值逐渐下降,在180 min,PGBL组血糖值均低于DM组,但差异无统计学意义(P>0.05)。见图1。说明DM组大鼠的糖耐量受损,对血糖的调节能力降低,PGBL可以改善这一受损状况,但不显著。
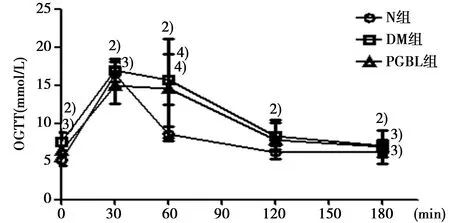
与N组相比:1)P<0.05,2)P<0.01;与DM组相比:3)P<0.05,4)P<0.01图1 各组大鼠OGTT实验中各测定点的血糖值
2.3PGBL对视网膜神经节细胞存活数目的影响 DM组大鼠神经节细胞存活数目(768.2±84.9)较N组(1 428.1±159.7)明显下降(P<0.01),PGBL干预后,大鼠神经节细胞存活数目(1 103.5±123.6)显著增加(P<0.05)。表明DM组大鼠视网膜神经节细胞数减少可能是糖尿病所致,而PGBL可以增加损伤后存活的神经节细胞数目。
2.4PGBL对于视网膜MMP-9及iNOS RNA表达水平的调节 DM组大鼠视网膜MMP-9及iNOS RNA表达水平(0.41±0.11,0.39±0.08)较N组(1.63±0.34,1.42±0.21)明显下降(P<0.01),PGBL给药干预后,能显著上调MMP-9及iNOS RNA表达(0.82±0.20,0.73±0.15;P<0.05)。说明银杏叶多糖可以上调糖尿病大鼠视网膜MMP-9及iNOS的RNA表达。
3 讨 论
糖尿病最严重的眼部并发症就是DR,但其发病机制还没有得到公认的解释。以前科学界普遍认为糖尿病微循环障碍是引起视网膜缺血缺氧的关键因素〔2〕。目前认为DR的发生大多与各类细胞因子的异常导致的氧化应激有关,还有学者提出,醇-肌代谢异常、蛋白激酶C的激活是引发DR的关键因素〔3〕。近年来,大量研究也表明:糖尿病患者的视功能障碍大多发生在DR微血管病变发生以前,因此推断DR的主要发病机制可能由视网膜神经元被影响开始,进而导致体内血液平衡失调,最终导致糖尿病代谢紊乱〔4〕。DR晚期对视力损害非常严重,甚至可能会致盲,遗憾的是,目前医学界对此还没有全面的认识及科学有效的治疗。视网膜神经节细胞的轴突主要是将视觉信号沿视路传递到中枢形成视觉,是视网膜对视觉信息处理及传递三级神经元的重要组成成分。糖尿病患者的视功能状况与视网膜神经节细胞的数量和功能有关〔5~8〕。在DR初期,视网膜神经节细胞数量出现明显下降,因此有人提出DR可能是神经退行性的病变。本实验中,PGBL能显著上调糖尿病大鼠的视网膜神经节细胞的数目,刺激其活性,说明PGBL对RGCs有抗凋亡作用。MMPs是一种内源性肽酶。神经元细胞的死亡正是由于MMP-9将细胞与基质的连接打破,进而导致脑血流屏障被破坏所导致〔6〕。有研究发现,MMP-9水平的升高会导致神经节细胞的损伤〔9~12〕。在多种眼部炎症疾病或者神经病变性疾病中发现iNOS有明显的细胞毒性,同时,由高眼压导致的急性视网膜缺血会升高COX-2及iNOS的水平〔13〕。
银杏叶是近年来国内外药物研究开发的热点之一。近年来已发现PGBL具有很多生物活性。多糖是一种公认的无细胞毒性免疫促进剂,有研究发现,PGBL可显著激活腹腔吞噬细胞,有较强的激活非特异性免疫的功能。PGBL能有效清除自由基,有较强的抗氧化作用〔14,15〕。本研究中发现,PGBL能降低糖尿病大鼠血糖,有效上调糖尿病大鼠的视网膜神经节细胞的数目,对DR具有一定的保护作用,且可能是通过下调糖尿病大鼠视网膜MMP-9及iNOS RNA表达来实现的。
4 参考文献
1Coronado AC,Zaric GS,Martin J,etal.Diabetic retinopathy screening with pharmacy-based teleophthalmology in a semiurban setting:a cost-effectiveness analysis〔J〕.CMAJ Open,2016;4(1):E95-102.
2Kim TK,Won YJ,Shin J,etal.The association of metabolic syndrome with diabetic retinopathy:the Korean National Health and Nutrition Examination Survey 2008-2012〔J〕.PLoS One,2016;11(6):e0157006.
3Tangjai P,Chingchana P,Taweerutchana R.Glycated haemoglobin and diabetic retinopathy in type 2 diabetic patients in hrh princess maha chakri sirindhorn medical center〔J〕.J Med Assoc Thai,2015;98 Suppl 10:S135-42.
4Adamiec-Mroczek J,Zajac-Pytrus H,Misiuk-Hojlo M.Caspase-dependent apoptosis of retinal ganglion cells during the development of diabetic retinopathy〔J〕.Adv Clin Exp Med,2015;24(3):531-5.
5Meyer-Rusenberg B,Pavlidis M,Stupp T,etal.Pathological changes in human retinal ganglion cells associated with diabetic and hypertensive retinopathy〔J〕.Graefes Arch Clin Exp Ophthalmol,2007;245(7):1009-18.
6Kowluru RA,Mohammad G,dos Santos JM,etal.Abrogation of MMP-9 gene protects against the development of retinopathy in diabetic mice by preventing mitochondrial damage〔J〕.Diabetes,2011;60(11):3023-33.
7Chen J,Luo M,Wang W,etal.Altered proteolytic activity and expression of MMPs and aggrecanases and their inhibitors in Kashin-Beck disease〔J〕.J Orthop Res,2015;33(1):47-55.
8Chopra K,Baveja A,Kuhad A,etal.MMPs:a novel drug target for schizophrenia〔J〕.Exp Opin Ther Targets,2015;19(1):77-85.
9Abu El-Asrar AM,Siddiquei MM,Nawaz MI,etal.Coexpression of heparanase activity,cathepsin L,tissue factor,tissue factor pathway inhibitor,and MMP-9 in proliferative diabetic retinopathy〔J〕.Mol Vis,2016;22:424-35.
10Sarkar J,Nandy SK,Chowdhury A,etal.Inhibition of MMP-9 by green tea catechins and prediction of their interaction by molecular docking analysis〔J〕.Biomed Pharmacother,2016;84:340-7.
11Strzelecki D,Kaluzyńska O,Szyburska J,etal.MMP-9 serum levels in schizophrenic patients during treatment augmentation with sarcosine (Results of the PULSAR Study)〔J〕.Int J Mol Sci,2016;242(7):54-60.
12Luca F,Rossella S,Salvatore T,etal.MMP-9 overexpression is associated with intragenic hypermethylation of MMP9 gene in melanoma〔J〕.Aging (Albany NY),2016;8(5):933-44.
13Uthra S,Raman R,Mukesh BN,etal.Diabetic retinopathy:validation study of ALR2,RAGE,iNOS and TNFB gene variants in a south Indian cohort〔J〕.Ophthalmic Genet,2010;31(4):244-51.
14Yan Z,Fan R,Yin S,etal.Protective effects of Ginkgo biloba leaf polysaccharide on nonalcoholic fatty liver disease and its mechanisms〔J〕.Int J Biol Macromol,2015;80:573-80.
15Yang Y,Liu P,Chen L,etal.Therapeutic effect of Ginkgo biloba polysaccharide in rats with focal cerebral ischemia/reperfusion (I/R) injury〔J〕.Carbohydr Polym,2013;98(2):1383-8.

