沉默MMP-13对皮肤基底细胞癌细胞侵袭、迁移及Wnt信号通路的影响
周忠志 黄新灵 杨双喜 兰宏伟
(湖南中医药大学第一附属医院烧伤整形科,湖南 长沙 410007)
皮肤基底细胞癌(BCC)是常见的皮肤恶性肿瘤之一,占所有皮肤恶性肿瘤的65%~75%,早期表现为细小的半透明样局部隆起病变,后期症状多样化,容易漏诊和误诊〔1,2〕。BCC肿瘤细胞侵袭能力强,严重破坏深部组织〔3〕。基质金属蛋白酶(MMP)-13参与降解细胞外基质和多种肿瘤细胞的迁移、侵袭等过程〔4〕。MMP-13在非小细胞肺癌〔4〕、乳腺癌〔5〕、肝癌〔6〕等多种肿瘤组织中表达量升高,提示MMP-13升高与肿瘤的发生、发展有重要联系。本研究探讨RNA干扰抑制MMP-13的表达对BCC癌细胞侵袭、迁移能力的影响及作用机制。
1 材料与方法
1.1实验材料 人BCC A431细胞系由湖南中医药大学实验室保存,胎牛血清、DMEM培养基、Lipofectamine2000转染试剂盒购自美国Invitrogen公司,Transwell试剂盒购自BD Bioscience公司,蛋白提取试剂盒购自上海碧云天公司,MMP-13抗体购自Calbiochem公司,上皮细胞钙黏蛋白(E-cadherin)抗体、细胞周期蛋白(Cyclin)D1抗体、β-链蛋白(catenin)抗体、β-actin等抗体、羊抗鼠二抗购自美国abcam公司。
1.2细胞培养 A431细胞培养于含有10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM高糖培养基中,培养条件为37℃、5% CO2,每天观察细胞生长状态,0.25%胰酶消化收集细胞进行传代,及时更换新鲜培养基,生长状态良好的对数期细胞用于后期实验。
1.3细胞转染 取对数期细胞,胰酶消化成单细胞悬液,以1×106/孔接种至6孔板中,置于37℃、5% CO2恒温培养箱中培养24 h,与转染前1 h更换为不含抗生素的新鲜培养基。待细胞融合度约为80%时按照转染试剂说明书进行转染,转染后每天观察细胞状态。实验分为3组,对照组:不做任何处理的细胞,加入等量的Lipofectamine2000;MMP-13组:加入Lipofectamine2000和pLightSwith-MMP13-NC;MMP13-siRNA组:Lipofectamine2000和pLightSwith-MMP13-siRNA。各组细胞置于37℃、5% CO2的培养箱中培养6 h后更换含10%胎牛血清和青霉素、链霉素的培养基培养48 h,Western印迹检测转染效果。
1.4Transwell实验检测细胞的侵袭、迁移能力 实验前将提前配置好的Matrigel胶包被在Transwell小室基底膜上室,置于24孔板上,37℃孵育2 h。将转染后48 h的各组细胞用不含血清的培养基重悬,以1×103/孔接种于小室上室,下室中加入600 μl 10%胎牛血清的培养基作为趋化因子,待细胞侵袭24 h后,取出小室,弃去培养液,95%乙醇固定15 min,5%结晶紫染色15 min,磷酸盐缓冲液(PBS)清洗3次,用棉签轻轻拭去Matrigel胶和上室中未穿出的细胞,在倒置显微镜下取上、下、左、右、中5个视野计数,取平均数表示细胞侵袭、迁移力,每组3个复孔。迁移实验上室不包被Matrigel胶,其余步骤与侵袭实验相同。
1.5Western印迹检测转染细胞中β-catenin、CyclinD1、E-cadherin蛋白表达量 取各组转染后48 h的细胞,PBS洗涤,加入RIPA裂解液,10 000 r/min,4℃离心10 min,保留上清液,利用二喹啉甲酸(BCA)法测定蛋白的浓度,取30 μg蛋白煮沸变性5 min,使用8%~15%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)胶进行电泳,待溴酚蓝到达胶的底部,终止电泳。将凝胶转入聚偏氟乙烯(PVDF)膜上,Tris缓冲盐水-吐温(TBST)缓冲液清洗后,5%的脱脂奶粉室温封闭2 h,加入牛奶封闭液稀释的一抗,室温下孵育2 h,TBST清洗3次,每次10 min,加入二抗,室温避光孵育1 h,TBST清洗3次,每次10 min。通过电化学发光(ECL)蛋白印迹检测系统进行检测,以目的条带灰度值与内参β-actin灰度值的比值为各目的蛋白的相对表达量。
1.6统计学方法 使用SPSS22.0软件进行单因素方差分析、t检验。
2 结 果
2.1各组MMP-13蛋白表达量、细胞迁移、侵袭数比较 与对照组比较,MMP-13组MMP-13蛋白表达量、细胞迁移、侵袭数差异均无统计学意义(P>0.05);MMP-13-siRNA组MMP-13蛋白表达量、细胞迁移、侵袭数均显著低于对照组及MMP-13组(均P<0.05)。见图1、表1。
2.2各组β-catenin、CyclinD1、E-cadherin蛋白表达量比较 与对照组相比,MMP-13组β-catenin、CyclinD1、E-cadherin蛋白表达量差异均无统计学意义(P>0.05);MMP-13-siRNA组β-catenin、CyclinD1蛋白表达量显著低于对照组及MMP-13组(P<0.05),E-cadherin蛋白表达量显著高于对照组及MMP-13组(P<0.05)。见表2、图2。
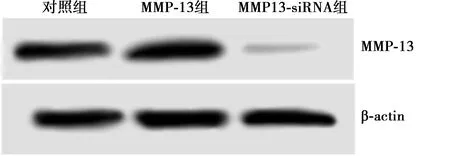
图1 各组MMP-13的表达量
表1 各组MMP-13蛋白表达量、细胞迁移、侵袭数比较
与MMP-13-siRNA组比较:1)P<0.05;下表同
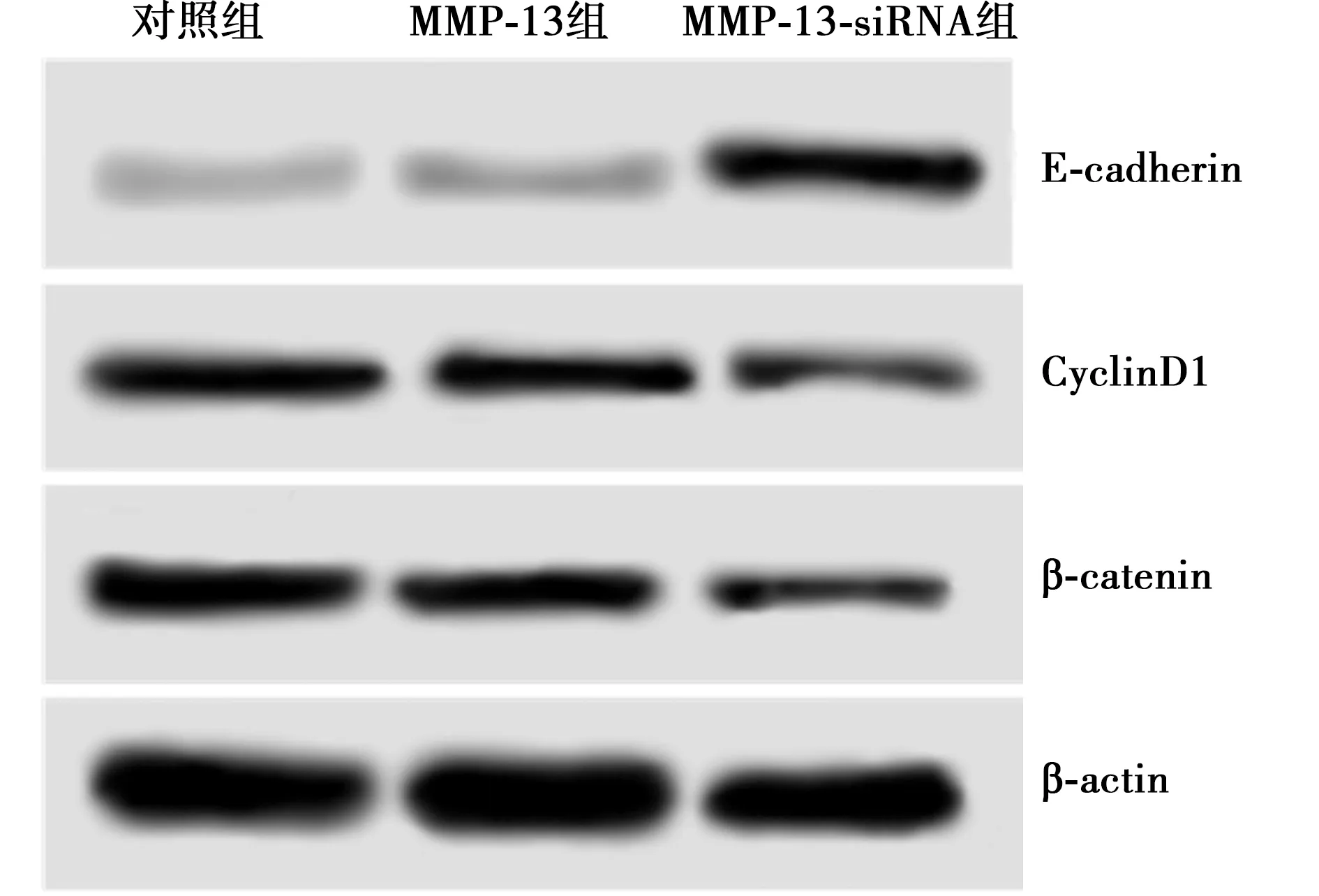
图2 各组β-catenin、CyclinD1、E-cadherin蛋白表达情况
表2 各组β-catenin、CyclinD1、E-cadherin蛋白表达量比较
3 讨 论
BCC常发生于面部、颈部、四肢的皮肤表层或附属器,少见于躯干。研究认为,BCC由太阳辐射、电离辐射、放疗、局部慢性炎症等高危因素引起〔7〕,但发生发展机制尚不清楚,治疗目前多采用手术切除、放疗、局部用药或光动力疗法,但手术和放疗治疗复发率较高〔8〕。肿瘤恶化和复发多是因为局部肿瘤细胞发生浸润和远端转移。MMPs在降解细胞外基质和血管基底膜的过程中发挥重要作用,同时调节多种肿瘤细胞侵袭、迁移过程〔9〕。研究证明,S100A4可通过调节下游信号通路的靶基因MMPs增强肿瘤细胞侵袭、迁移能力〔10~12〕。MMP-13属于MMPs家族成员之一,对肿瘤细胞的转移浸润过程起重要调节作用。研究结果显示,MMP-13的表达量下降可抑制肿瘤细胞侵袭、转移〔13,14〕。为阐明MMP-13对皮肤基底细胞癌细胞侵袭、迁移的影响,本研究结果提示MMP-13参与了基底细胞癌细胞的侵袭、迁移过程。原癌基因int1与果蝇无翅基因wingless具有同源性,合称为Wnt。研究发现,Wnt信号通路调节某些正常的生理过程和诱导多种肿瘤的发生、发展〔15〕。Wnt/β-catenin通路是Wnt信号通路的经典途径。β-catenin是Wnt/β-catenin通路的核心作用因子,其在细胞质的含量升高并逐渐向核内转移是该通路的标志。Wnt蛋白可降低β-catenin复合物的稳定性,妨碍β-catenin磷酸化降解,从而引起β-catenin在细胞质中积累,转入细胞核中激活Wnt/β-catenin信号通路,增强下游靶基因的表达〔16〕。E-cadherin是Wnt信号通路的重要调节因子,主要影响β-catenin的活化。在细胞质中,β-catenin可与E-cadherin结合形成黏附性连接,若阻碍β-catenin与E-cadherin形成黏附连接,能够影响细胞质中β-catenin的磷酸化水平,从而影响Wnt信号通路发挥作用〔17〕。研究表明,当E-cadherin的表达量下降会降低细胞间的黏附力,导致肿瘤细胞侵袭、转移能力增强〔18〕。CyclinD1是Wnt信号通路的下游靶基因,调控细胞周期和肿瘤的发生、发展。当胞质内β-catenin积累量较多时,细胞膜的通透性增强,β-catenin进入细胞核,激活靶基因CyclinD1的表达,诱导肿瘤的发生、发展〔19〕。研究显示,CyclinD1表达量升高可调节乳腺癌细胞侵袭、迁移能力〔20〕。本研究提示MMP-13可能通过抑制Wnt信号通路的激活从而降低细胞侵袭、迁移能力,抑制肿瘤恶化。
综上,RNA干扰基底细胞癌细胞中的MMP-13的表达可抑制细胞的迁移、侵袭能力,其作用机制可能是通过影响Wnt信号通路的活性发挥作用。
4 参考文献
1严 丹,李 灵.P16,CyclinD1,PTEN 在皮肤基底细胞癌中的表达及意义〔J〕.实用医院临床杂志,2016;13(3):16-20.
2郑 瑞,桑洁玉,董志珊,等.皮肤基底细胞癌 79 例的临床与病理特征分析〔J〕.山西医科大学学报,2014;45(6):487-8.
3刘秀英,钱 芳.5-氨基酮戊酸光动力治疗表浅基底细胞癌患者的疗效研究〔J〕.实用癌症杂志,2015;30(4):500-2.
4黄佳滨,李 爽,王凤玲.ILK 和 MMP-13 在非小细胞肺癌中的临床意义及表达〔J〕.黑龙江医药科学,2017;40(1):13-4.
5王炳高,袁新颜,邢志博,等.三阴性乳腺癌组织STAT3、AR、MMP-13表达与预后状况的关系研究〔J〕.癌症进展,2016;14(6):594-6.
6刘春萍,李海龙,张 艳,等.当归贝母苦参丸加味方对荷瘤小鼠 H22 肝癌肿瘤组织 MMP13 和 bFGF 表达的影响〔J〕.国际检验医学杂志,2017;38(2):153-6.
7唐 政.皮肤基底细胞癌发生的危险因素及其病理特征分析〔J〕.实用癌症杂志,2016;31(6):921-3.
8史春艳,王 舒,李福秋.CXCR4在皮肤基底细胞癌中的表达及意义〔J〕.中国老年学,2016;36(20):4980-1.
9Méndez E.Biomarkers of HPV Infection in oropharyngeal carcinomas:can we find simplicity in the puzzle of complexity〔J〕?Cancer Res,2012;72(19):4896-8.
10李 波,阙祥勇,李新志.Cdc2 激酶与肿瘤的相关性研究进展〔J〕.广东医学,2012;33(4):566-8.
11Mahyous Saeyd SA,Ewert-Krzemieniewska K,Liu B,etal.Hyperactive Cdc2 kinase interferes with the response to broken replication forks by trapping S.pombe Crb2 in its mitotic T215 phosphorylated state〔J〕.Nucleic Acids Res,2014;42(12):7734-47.
12Yang JQ,Liu HX,Liang Z,etal.Over-expression of p53,p21 and Cdc2 in histologically negative surgical margins is correlated with local recurrence of laryngeal squamous cell carcinoma〔J〕.Int J Clin Exp Path,2014;7(7):4295-302.
13Deng Z,Uehara T,Maeda H,etal.Epstein-barr virus and human papillomavirus infections and genotype distribution in head and neck cancers〔J〕.PLoS One,2014;9(11):e113702.
14曲 媛,高 黎,易俊林,等.口咽鳞癌 HPV 感染与 p16 表达及放疗预后相关性研究〔J〕.中华放射肿瘤学杂志,2014;23(2):135-9.
15Berndt JD,Moon RT.Making a point with Wnt signals〔J〕.Science,2013;339(6126):1388-9.
16张世蘋,张 旭.Wnt信号通路在肿瘤调控方面的研究进展〔J〕.中国药理学通报,2017;33(1):14-8.
17常琳琳,朱 虹,郑 琳,等.E-cadherin 在肿瘤治疗中的研究进展〔J〕.药学进展,2015;39(10):754-60.
18Teng L,Peng S,Guo H,etal.Conditioned media from human ovarian cancer endothelial progenitor cells induces ovarian cancer cell migration by activating epithelial-to-mesenchymal transition〔J〕.Cancer Gene Ther,2015;22(11):518-23.
19邹 娜,金 波,王红龙,等.乳腺癌中 Wnt 信号通路成分 NKD1,β-catenin 和 Cyclin D1 蛋白的表达及意义〔J〕.大连医科大学学报,2017;39(1):19-22.
20Lee SS,Ahn JS,Jung SH,etal.Treatment of BK virus-associated hemorrhagic cystitis with low-dose intravenous cidofovir in patients undergoing allogeneic hematopoietic cell transplantation〔J〕.Korean J Int Med,2015;30(2):212.

