Kruppel样因子8通过转化生长因子-β1介导的上皮间质转化促进胃癌细胞的侵袭转移
李天梁 徐 亮 李蜀华 冷 尉
(西南医科大学附属医院普外科,四川 泸州 646000)
转化生长因子(TGF)-β1是一类多功能细胞因子,参与了细胞分化、增殖、凋亡等生理过程,TGF-β1在多种病理过程中都大量表达,如慢性炎症疾病〔1〕和癌症〔2〕等。大量研究证实,在肿瘤微环境中,TGF-β1能够促进血管生成、细胞外基质沉积、增加蛋白水解酶合成等〔3~5〕。此外,TGF-β1还能够促进上皮间质转化(EMT),EMT是促进肿瘤恶性进展的主要机制之一。肿瘤细胞发生EMT的典型特点是其上皮标志蛋白钙黏附蛋白E(E-cadherin)的表达降低和间质标志蛋白波形蛋白(Vimentin)表达增加。Kruppel样因子(KLF)8属于Kruppel样C2H2锌指转录因子家族成员之一,多种KLF家族成员被证实在肿瘤细胞中发挥着癌基因或者抑癌基因的功能,如KLF4、KLF5和KLF6。近来研究表明,KLF8在胃癌细胞中过量表达,并且在调节胃癌细胞增殖和侵袭中发挥着重要作用〔3〕,但是具体的机制并不清楚。已有研究证实KLF8与EMT之间存在联系〔4〕,并且KLF8是TGF-β1的下游转录因子之一,参与肿瘤的形成、进展和EMT等过程〔5〕。然而,关于KLF8在胃癌中的研究相对较少。本研究旨在探讨TGF-β1是否能够促进胃癌细胞发生EMT,并且KLF8是否参与了TGF-β1介导的EMT,从而促进细胞侵袭转移。
1 材料与方法
1.1细胞培养 人胃癌细胞株SGC7901和MKN45(中国上海科学院细胞库),培养于RPMI1640培养基中(含10% 胎牛血清,10×104U/L青霉素,100 mg/L链霉素),37℃,5%CO2条件下培养。TGF-β1处理组,即10 ng/ml TGF-β1,预处理胃癌细胞24 h,再进行后续实验。
1.2脂质体转染KLF8 siRNA 取4×105个处于对数生长期的MKN45细胞,接种于3.5 cm培养皿中,24 h后,采用脂质体Lipofectamine®3000(美国Invitrogen公司)将siKLF8(5′-CCGGCCCAGCACTGTTTAATGACATCTCGAGATGTCATTAAACAGTGCTGGGTTTTTG-3′)及siRNA无关序列(阴性对照组)(上海生工生物工程技术服务有限公司)转染至MKN45细胞中,操作步骤参照试剂说明书。实验分为空白对照(NC)组,siKLF8干扰组及阴性对照组
1.3荧光实时定量PCR(qRT-PCR) 收集各试验组细胞约1×105个,各细胞样品中加入1.0 ml Trizol(美国Thermo公司),抽提细胞总RNA,按照RNA提取试剂盒(美国Invitrogen公司)的说明书操作。紫外分光光度计(美国Thermo公司)检测总RNA浓度及纯度(A260/A280),逆转录试剂盒(大连宝生物工程有限公司)进行逆转录。KLF8、E-cadherin、Vimentin及内参甘油醛-3-磷酸脱氢酶(GAPDH)的qRT-PCR引物序列(上海生工生物工程股份有限公司):KLF8正向5′-3′CTGCCTAATCTACCCAATCAGTTCA,反向5′-3′CTGGACAGTTGCTTATGGCATC;E-cadherin正向5′-3′GAGTGCCAACTGGACCATTCAGTA,反向5′-3′AGTCACCCACCTCTAAGGCCATC;Vimentin正向5′-3′CACCTCTAAGGCCATCACCAGCTAACCAACGA,反向5′-3′TCAAGGTCAAGACGTGCCAGA;GAPDH正向5′-3′TGGTGAAGACGCCAGTGGA,反向5′-3′CTGAGAACGCACCGTCAAGG。定量PCR扩增仪(ABI 7500,美国ABI公司)检测KLF8、E-cadherin、Vimentin表达水平。qRT-PCR扩增体系为10 μl,反应条件:50℃,2 min;95℃,10 min;95℃,15 s;60℃,1 min,进行35个循环。采用2-ΔΔCt方法表示各基因mRNA相对表达量,重复3次独立实验后进行统计分析。
1.4Western印迹试验 收集各试验组细胞(2~5)×105个,加入RIPA蛋白裂解液(上海碧云天生物技术有限公司),抽提细胞全蛋白,二喹啉甲酸(BCA)蛋白定量试剂盒(美国Thermo公司)检测蛋白浓度。10%十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白后,湿转法将蛋白转到聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉室温振荡封闭1 h,Tris盐酸缓冲液(TBS-T)洗膜,鼠抗人KLF8单克隆抗体(sc-134375,美国Santa公司,1∶1 000稀释),鼠抗人E-cadherin单克隆抗体(ab1416,美国Abcam公司,1∶1 000稀释),鼠抗人Vimentin单克隆抗体(ab8978,美国Abcam公司,1∶1 000稀释),兔抗人GAPDH单克隆抗体(sc-367714,美国Santa公司,1∶2 000稀释),4℃孵育过夜。TBS-T洗膜后,加入辣根过氧化物酶(HRP)标记的羊抗鼠二抗(上海英基生物科技有限公司,1∶10 000稀释),室温孵育1 h,加电化学发光法(ECL)发光液(美国Millipore公司)进行化学发光显影,凝胶成像仪(GelDoc-It,美国UVP公司)对蛋白条带进行观察,获取图像,并对图像进行灰度分析(Image Lab软件),记录灰度值,计算目的蛋白与内参蛋白的灰度比值。重复3次独立试验后,进行统计分析。
1.5细胞划痕试验 取对数生长期细胞(5~7)×105个,接种于6孔板中,24 h后,细胞汇合度达90%以上;使用移液器枪头,垂直于6孔板底部,均匀划线,每孔3条平行线;磷酸盐缓冲液(PBS)洗涤3次,去除漂浮的细胞,加入无血清RPMI1640培养基,37℃、5%CO2培养箱中正常培养,分别于0、24 h后显微镜(BX61,日本Olympus公司)下拍照,并计算细胞间距离。细胞间距离越大,说明迁移能力越低,重复3次独立试验后,进行统计分析。
1.6细胞侵袭试验 24孔板中放置Transwell小室,在小室上层加入4.0 μg/μl Matrigel基质胶50 μl,37℃,5%CO2培养箱中过夜,使Matrigel基质胶凝固;在24孔板下室中加入500 μl的含10%胎牛血清(FBS)的RPMI1640培养液,Transwell小室中加入100 μl的各试验组MKN45细胞悬液(细胞总数约1×105个);48 h后,去除24孔板下室中的培养液,棉签擦去Transwell小室内室膜上的细胞,0.1%结晶紫溶液染色,室温5 min,显微镜(BX61,日本Olympus公司)下观察,每孔随机选取3个视野拍照,并记录每个视野的细胞数目。重复3次独立试验后,进行统计分析。
1.7高内涵细胞分析试验 处于对数生长期的MKN45细胞,接种于96孔板中,每孔5 000个细胞;24 h后弃去旧培养液,预冷PBS洗涤细胞2次,Heochst 33342对细胞进行荧光染色,15 min,预冷PBS洗涤2次,根据试验分组,对细胞进行不同处理后,采用高内涵药物筛选平台(Cellomics Array Scan VTI 1700 plus,美国Thermo公司)检测细胞72 h内的运动能力。重复3次独立试验后,进行统计分析。
1.8统计学方法 应用SPSS13.0软件,计量资料采用t检验;多组间比较采用单因素方差分析,两组间比较采用LSD-t检验。
2 结 果
2.1TGF-β1促进胃癌细胞EMT Western印迹试验结果显示,在胃癌细胞SGC7901和MKN45中,与NC组〔E-cadherin:(1.00±0.01),(1.20±0.02);Uimentin:(0.99±0.03),(0.71±0.03)〕细胞相比,TGF-β1处理组细胞内的E-cadherin表达量(0.25±0.02,0.21±0.02)显著降低(t=44.126,52.679;均P=0.000),而Vimentin的表达量(4.24±0.11,3.86±0.05)则显著增加(t=48.668,83.527;均P=0.000),见图1A。本研究中,选择MKN45细胞进行后续试验。qRT-PCR结果显示,TGF-β1处理组MKN45细胞中,E-cadherin mRNA表达水平(0.22±0.01)显著低于NC组(1.01±0.01),Vimentin mRNA表达水平(2.91±0.05)显著高于NC对照组(0.99±0.03)(t=73.314,50.325;均P=0.000)。经TGF-β1处理后,MKN45细胞形态发生了显著变化,见图1B。以上实验结果表明,TGF-β1能有效地减少上皮标志蛋白的表达,促进间质标志蛋白的表达,从而促进胃癌细胞EMT。
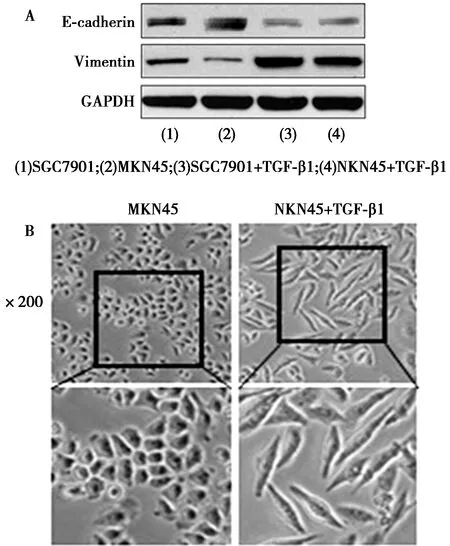
图1 胃癌细胞中E-cadherin和Vimentin的表达
2.2TGF-β1诱导KLF8表达 qRT-PCR和WB试验结果显示,与NC组(1.01±0.03,1.00±0.02)相比,TGF-β1处理组MKN45细胞内KLF8 mRNA(2.14±0.15)和蛋白(2.43±0.07)表达水平分别增加了2.1倍和2.4倍。以上试验结果表明,在胃癌细胞中,TGF-β1能够诱导KLF8的表达。
2.3TGF-β1通过KLF8信号通路调节E-cadherin和Vimentin表达 脂质体转染siKLF8,可降低MKN45细胞内KLF8的表达水平(NC组:1.02±0.02,阴性对照组:0.95±0.11,siKLF8干扰组:0.29±0.02;t=39.154,9.638,均P=0.000)。见图2A。在此基础上,检测siKLF8处理组MKN45细胞内的E-cadherin和Vimentin表达量,结果显示,siKLF8能够部分逆转TGF-β1的功能,导致E-cadherin表达上升,Vimentin表达下降,见图2B,表1。以上试验结果表明,TGF-β1能够通过KLF8信号通路调节E-cadherin和Vimentin表达。
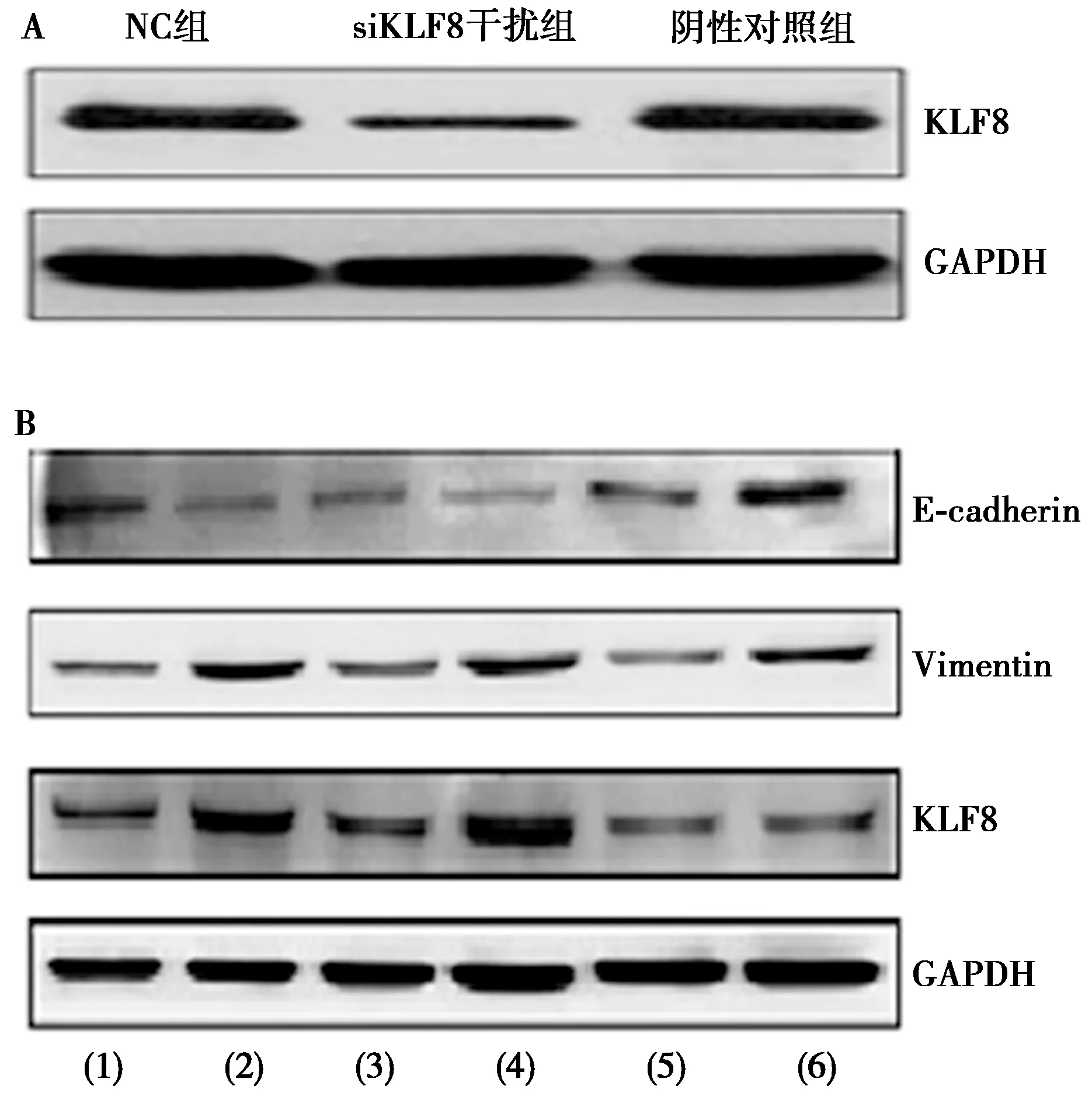
(1)MKN45;(2)MKN45+TGF-β1;(3)NC;(4)NC+TGF-β1;(5)siKLF8;(6)siKLF8+TGF-β1图2 TGF-β1对各试验组MKN45细胞中E-cadherin和Vimentin表达的影响
表1 siKLF8对TGF-β1功能的逆转作用
2.4siKLF8逆转TGF-β1介导的促迁移和侵袭能力 细胞划痕试验显示,siKLF8处理组MKN45细胞的迁移能力比NC组和siKLF8阴性对照组明显降低,且TGF-β1处理后,能够显著促进NC组和siKLF8阴性对照组MKN45细胞的迁移能力,然而,TGF-β1(10 ng/ml,预处理24 h)对siKLF8处理组MKN45细胞的迁移能力,则无明显影响(P>0.05)。见图3A,表2。
Transwell侵袭试验结果显示,与NC组和siKLF8阴性对照组相比,siKLF8处理组MKN45细胞的侵袭能力显著降低;TGF-β1能够显著提高NC组和siKLF8阴性对照组的侵袭能力,但是TGF-β1对siKLF8处理组MKN45细胞的侵袭能力则无明显影响(P>0.05)。见图3B,表2。以上试验结果表明,KLF8在TGF-β1介导的胃癌细胞侵袭和转移中,发挥重要作用。
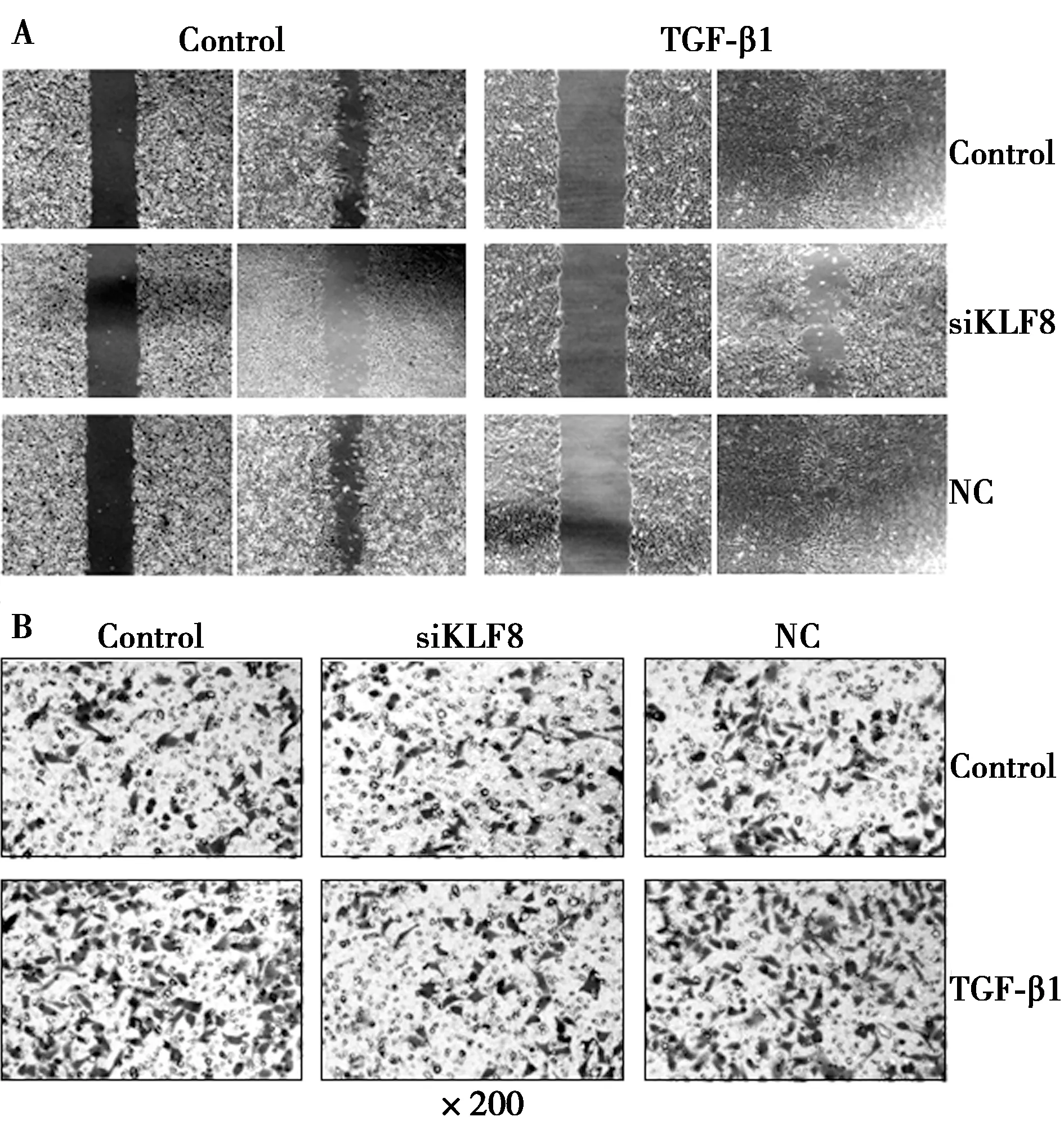
图3 siKLF8对TGF-β1诱导的迁移和侵袭能力的影响
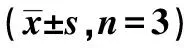
表2 siKLF8对TGF-β1诱导的迁移、侵袭能力的影响
2.5TGF-β1通过KLF8促进细胞的运动能力 高内涵细胞分析试验结果显示,48 h及72 h时,siKLF8处理组MKN45细胞的运动速度比NC组和siKLF8阴性对照组明显下降;TGF-β1处理后,能够显著增加NC组和siKLF8阴性对照组运动速度,然而,TGF-β1对siKLF8处理组MKN45细胞的运动速度则无明显影响(P>0.05)。见表3。

表3 各试验组MKN45细胞的相对运动速度
与对应组的NC组和siKLF8阴性对照组比较:1)P<0.05;与对应的TGF-β1未处理组相比:2)P<0.05
3 讨 论
胃癌是全球最常见的恶性肿瘤之一,具有高侵袭性,易远处转移等特点,这也是导致胃癌患者治疗失败,不良预后甚至死亡的重要原因〔6,7〕。因此,寻找与肿瘤迁移侵袭相关的靶蛋白,阐明他们促进迁移侵袭的机制,是临床亟待解决的问题之一。胃癌细胞起源于腺上皮,具有上皮细胞的特征,但在某些因素的诱导下,胃癌细胞的上皮源性标志物E-cadherin表达下降,而间质性标志物Vimentin表达增加,使细胞从上皮细胞向间质细胞转化,即EMT〔8〕。研究证实,EMT能够促进肿瘤细胞的恶性进展〔9,10〕。TGF-β生长因子主要包括TGF-β1,TGF-2和TGF-β3,而TGF-β1在胃癌EMT过程中研究最为广泛,TGF-β1除了参与调控细胞增殖和免疫应答以外,在肿瘤的发生和发展过程中也发挥着双重作用,既能够诱导细胞凋亡、阻滞细胞周期,发挥抑制肿瘤的作用,又能够促进肿瘤细胞发生侵袭转移〔11,12〕。近年来的研究证实,KLF8是TGF-β1的下游因子,并且参与了细胞周期的调节,在肿瘤的形成和恶性进展中发挥着重要的作用。在多种肿瘤细胞中存在着KLF8的异常表达,如膀胱癌〔13〕、胰腺癌〔14〕、乳腺癌〔15,16〕等。
本研究表明TGF-β1刺激后,胃癌细胞中上皮标志蛋白的表达水平下降,而间质标志蛋白的表达水平增加,进而促进了胃癌细胞发生EMT。本研究也提示KLF8在TGF-β1诱导的一系列细胞变化中可能发挥作用。采用siKLF8干扰MKN45细胞内KLF8的表达后,能够部分逆转TGF-β1介导的降低E-cadherin、增加Vimentin表达,促进EMT的功能。本研究结果表明,TGF-β1能够增加细胞的迁移和侵袭能力,而在siKLF8组MKN45细胞中,TGF-β1并不能够促进细胞迁移和侵袭,即在胃癌细胞中,KLF8作为TGF-β1下游的效应分子,参与了TGF-β1介导的增强细胞迁移和侵袭的过程。
综上所述,TGF-β1能够诱导胃癌细胞发生EMT,并且TGF-β1能够诱导细胞内KLF8的表达;在胃癌细胞中,TGF-β1/KLF8信号通路激活后,细胞的迁移和侵袭能力显著增强;KLF8作为TGF-β1诱导EMT过程中的关键下游效应分子,在胃癌细胞的迁移和侵袭中发挥着极其重要的作用,TGF-β1/KLF8信号通路有可能作为逆转胃癌细胞EMT的作用靶标。
4 参考文献
1Hadaschik EN,Enk AH.TGF-β1-induced regulatory T cells〔J〕.Hum Immunol,2015;76(8):561-4.
2黄 慧,廖文军,粟钰淇,等.TGF-β1、HIF-1α、VEGF在胃癌组织及癌旁组织中的表达及临床意义〔J〕.现代生物医学进展,2014;14(18):3524-7.
3杨 雪,王亚芳,张 慧,等.KLF8在缺氧诱导胃癌细胞多药耐药中的作用〔J〕.现代肿瘤医学,2016;24(5):693-8.
4郭云霞,王郁杰,王瑞勤,等.胃癌病变过程中Krfippel样因子8及生存蛋白的表达与幽门螺杆菌感染关系〔J〕.中华医院感染学杂志,2015;25(7):1462-4.
5Yan Q,Zhang W,Wu Y,etal.KLF8 promotes tumorigenesis,invasion and metastasis of colorectal cancer cells by transcriptional activation of FHL2〔J〕.Oncotarget,2015;6(28):25402-17.
6Dong W,Li B,Wang J,etal.Exploration of the radiotherapeutic clinical target volume delineation for gastric cancer from lymph node metastases〔J〕.Anticancer Res,2017;37(8):4629-34.
7Mimatsu K,Fukino N,Ogasawara Y,etal.Utility of inflammatory marker-and nutritional status-based prognostic factors for predicting the prognosis of stage Ⅳ gastric cancer patients undergoing non-curative surgery〔J〕.Anticancer Res,2017;37(8):4215-22.
8Guo J,Wang B,Fu Z,etal.Hypoxic microenvironment induces EMT and upgrades stem-like properties of gastric cancer cells〔J〕.Technol Cancer Res Treat,2016;15(1):60-8.
9Qin G,Luo M,Chen J,etal.Reciprocal activation between MMP-8 and TGF-β1 stimulates EMT and malignant progression of hepatocellular carcinoma〔J〕.Cancer Lett,2016;374(1):85-95.
10陈 平,王唯一,周郁芬,等.PIAS1调控炎症微环境诱导的胃癌上皮-间质转化的实验研究〔J〕.胃肠病学,2017;22(1):15-9.
11张德利,马 艳,周 姝.胃癌组织中TGFβ1,Smad3,Smad7与ki-67 mRNA表达及其相关性〔J〕.中国老年学杂志,2015;35(18):5095-7.
12张艳青,马礼丹,孙 芮,等.TGF-β1通过调节miR-155表达影响胃癌相关巨噬细胞表型的研究〔J〕.胃肠病学和肝病学杂志,2016;25(11):1217-20.
13Liang K,Liu T,Chu N,etal.KLF8 is required for bladder cancer cell proliferation and migration〔J〕.Biotechnol Appl Biochem,2015;62(5):628-33.
14Yi X,Li Y,Zai H,etal.KLF8 knockdown triggered growth inhibition and induced cell phase arrest in human pancreatic cancer cells〔J〕.Gene,2016;585(1):22-7.
15Mukherjee D,Lu H,Yu L,etal.Krüppel-like factor 8 activates the transcription of C-X-C cytokine receptor type 4 to promote breast cancer cell invasion,transendothelial migration and metastasis〔J〕.Oncotarget,2016;7(17):23552-68.
16胡文兵,王钢胜,陈 曦,等.siRNA干扰KLF8表达对鼻咽癌细胞上皮间质转化的作用〔J〕.肿瘤防治研究,2016;43(12):1055-8.

