血管紧张素转化酶基因转染协同厄贝沙坦下调血管紧张素1型受体的表达
卢卓强 龚晶婧 蔡 翰 晋学庆
(福建医科大学附属第一医院,福建 福州 350005)
肾素-血管紧张素系统(RAS)由肾素、血管紧张素原、血管紧张素转化酶(ACE)、血管紧张素(Ang)及其相应的受体等构成。它与高血压、动脉粥样硬化等老年人易患心脑血管疾病的发生密切相关〔1〕。AngⅡ作为RAS的重要成员,大多由血管紧张素原先后经肾素及ACE转化生成,主要通过AngⅡ1型受体(AT1R)介导血管平滑肌细胞(VSMC)增殖、迁移,进而导致血管壁增厚,高血压及动脉粥样硬化等心血管疾病的发生〔2,3〕。因此,目前临床上ACE抑制剂(ACEI)及高选择性血AT1R特异性阻断剂(ARB)已经成为临床上高血压及心血管疾病治疗的关键药物。ACE2、Ang作为RAS系统中一个新成员,主要通过降解AngⅡ生成Ang-(1~7),后者作用于Mas受体,发挥扩张血管、抑制VSMC增殖、抗氧化应激等与AngⅡ相拮抗的作用,从而调节心血管、肾脏功能,降低血压和心血管事件,已成为心血管疾病治疗的新靶点〔4,5〕。因此,RAS中存在ACE-AngⅡ-AT1受体轴与ACE2-Ang-(1~7)-Mas轴这2条存在相抗衡作用的生理学分支〔6,7〕,其作用相互拮抗并维持心血管系统的平衡。Koka等〔8〕在研究人体心脏时发现AngⅡ通过AT1R及其下游信号分子EPK1/2和p38MAP上调ACE并下调ACE2的表达。Xia等〔9〕发现在高血压大鼠中枢中AT1R抑制ACE2的表达及活性升高,从而损害血管压力反射功能导致血压升高。本课题组早期研究提示ACE2基因转染能有效抑制AngⅡ诱导的VSMC异常增殖〔10〕,但ACE2是通过何种途径发挥上述作用尚不明确。虽然人们对ACE2及AT1R间的信号转导进行不断研究,但是并未发现ACE2能够直接作用于AT1R的证据,更多是间接参与AT1R的信号转导机制。鉴于现有RAS成员互相作用的大量证据及AT1R在AngⅡ致异常增殖中的关键作用,本课题组假设ACE2基因转染有可能直接对AT1R表达产生影响从而抑制VSMC异常增殖。本研究拟通过ACE2基因转染大鼠胸主动脉平滑肌细胞,研究在AngⅡ、ATR1拮抗剂厄贝沙坦干预等不同情况下ACE2对AT1R mRNA及蛋白表达的影响,以阐明ACE2拮抗AngⅡ的生物学作用的可能机制。
1 材料与方法
1.1主要试剂、试剂盒和仪器 细胞培养液DMEM和胎牛血清、Trizol试剂、高保真DNA聚合酶、Lipofectamine2000(Invitrogen公司)。SP超敏试剂盒(兔)、二氨基联苯胺(DAB)显色试剂盒(福州迈新生物技术开发有限公司),兔抗大鼠α-平滑肌肌动蛋白单克隆抗体(上海前尘生物科技有限公司),厄贝沙坦(江苏扬子江药业公司),AngⅡ(Sigma公司),逆转录试剂盒(Stratagen公司),AT1R兔抗大鼠一抗(Abcam公司),β-actin小鼠抗大鼠一抗(Santa Cruz公司),山羊抗兔二抗、山羊抗小鼠二抗(Santa Cruz公司)。PE-4800型PCR扩增仪(Perkin Elmer公司)。FR-250电泳仪(上海复日科技有限公司)。凝胶成像系统Biosens 810(上海山富科学仪器有限公司)。Biomate 5核酸蛋白定量测定仪(Thermo公司)。
1.2实验动物及质粒 体重为120~130 g普通SD成年大鼠,雌雄不限(福建医科大学实验动物中心),质粒pcDNA3.1/Hygro(+)(福建医科大学分子医学研究中心惠赠)及质粒pm-ACE2(本课题组早期实验构建)〔11〕。
1.3SD大鼠胸主动脉VSMC的培养和鉴定 采用组织贴块法进行VSMC培养〔12〕。首先应用倒置相差显微镜观察细胞大小、形态、生长特点及排列方式初步鉴定。再通过免疫细胞化学法鉴定VSMC:将第3代对数生长期的细胞5×104/孔接种到(预先放置盖玻片)6孔板中,37℃,5%CO2的培养箱中培养48 h。取出盖玻片,漂洗,4%多聚甲醛固定,加内源性过氧化酶阻断溶液后加正常动物非免疫血清(羊),室温下孵育10 min。加兔抗大鼠平滑肌肌动蛋白单克隆抗体(α-actin 1∶200),4℃孵育过夜,加生物素标记的羊抗兔IgG,室温下孵育10 min,爬片加链霉素抗生物素-过氧化酶,室温下孵育10 min,加新鲜配制DAB溶液,显微镜下观察3~10 min。苏木素染色,自来水冲洗,梯度酒精脱水干燥,中性树胶封固,显微镜下观察。
1.4ACE2基因转染、AngⅡ及厄贝沙坦等不同方法干预VSMC 取第5代VSMC以5×105/孔种植于6孔板中,每孔加入2 ml含10%胎牛血清DMEM培养基,37℃,5%CO2的细胞培养箱中至细胞长满培养板70%~80%。随机将细胞分组为:对照组、pcDNA3.1/Hygro(+)组、AngⅡ组、pm-ACE2组、厄贝沙坦组、AngⅡ+pm-ACE2组,AngⅡ+厄贝沙坦组、pm-ACE2+厄贝沙坦组和AngⅡ+pm-ACE2+厄贝沙坦组。根据实验分组及Lipofetamine2000脂质体试剂转染操作要求分别将4 μg DNA〔pcDNA3.1/Hygro(+)或pm-ACE2〕转染至pcDNA3.1/Hygro(+)组、pm-ACE2组、AngⅡ+pm-ACE2组、pm-ACE2+厄贝沙坦组和AngⅡ+pm-ACE2组+厄贝沙坦组,其余各组在上述组别转染时亦使用相同剂量Lipofetamine2000同时处理以减小脂质体毒性对实验结果产生的影响。转染后将细胞置于37℃,5%CO2的细胞培养箱中培养。6 h后更换为完全培养基,37℃,5%CO2培养40 h后在厄贝沙坦组、AngⅡ+厄贝沙坦组、pm-ACE2+厄贝沙坦组和AngⅡ+pm-ACE2组+厄贝沙坦组分别加入厄贝沙坦(终浓度10-7mol/L),而48 h后加AngⅡ(终浓度10-7mol/L)至AngⅡ组、AngⅡ+pm-ACE2组,AngⅡ+厄贝沙坦组、AngⅡ+pm-ACE2组+厄贝沙坦组,待AngⅡ干预12 h后用0.1%胰蛋白酶、0.1%EDTA消化,收集细胞。
1.5逆转录-聚合酶链式反应(RT-PCR)测定各组AT1R mRNA的表达 将收集的VSMC按照Trizol试剂盒说明书按步骤常规提取总RNA。根据逆转录试剂盒说明,在20 μl反应体系中加入1.5 μg总RNA逆转录生成cDNA。根据NCBI网上SD大鼠AT1R基因及β-actin全长编码序列(NC_005116.4和NC_005111.4),用Oligo6.0设计SD大鼠AT1R基因及β-actin的引物序列送Invitrogen公司合成。AT1R扩增长度为142 bp,上游引物:5′-CCATCGTCCACCCAATGAAG-3′,下游引物:5′-TTGGTGTTCTCGATGAAGTATAC-3,β-actin扩增长度为227 bp,上游引物:5′-GAAATCGTGCGTGACATTA-3′,下游引物:5′-TAGGAGCCAGGGCAGTAA-3′。通过所获得的cDNA及引物进行PCR,PCR的反应条件:94℃逆转录5 min后,94℃变性30 s、55℃退火30 s、68℃延伸5 min循环30次,最后68℃延伸10 min。PCR产物琼脂糖凝胶电泳成像,在White/Ultraviolet Transilluminator凝胶成像分析系统下进行观察并拍摄电泳图像。测定各条带IOD值,以β-actin表达量为基准,计算AT1R/β-actin表示各基因的相对表达量。
1.6Western印迹测定各组AT1R蛋白表达 取第5代平滑肌细胞按1×105/孔种植于6孔板中,实验分组及各组干预方法同前,待AngⅡ干预12 h后用0.1%胰蛋白酶、0.1%EDTA消化。在各孔中加入RIPA细胞裂解液,提取总蛋白。取各组蛋白样本进样于制好的8%的SDS丙烯酰胺中,电泳、转膜。5%的脱脂奶粉室温下封闭1 h,加入兔抗大鼠ATIR(1∶1 000),4℃过夜,用含(1∶1 000)吐温的Tris缓冲液(TBST,pH=7.4)洗膜3次,每次10 min。加入山羊抗兔二抗(1∶2 000),室温培育1 h,TBST洗3次,每次10 min。显色、曝光,经Quantity one软件分析吸光度值(A值),并将其与内参照的比值进行半定量分析。
1.7统计学方法 采用SPSS17.0软件行单因素方差分析及LSD检验。
2 结 果
2.1VMSC体外培养及鉴定结果 细胞形态学:原代培养第5~7天可见细胞从组织块边缘游出,进而形成细胞簇,此时细胞形态多样(梭形、不规则形)。细胞形态多呈宽大的长梭形,至培养2~3 w局部成束的细胞平行排列,部分区域细胞多层重叠,部分区域高低起伏呈“峰、谷”状生长(图1)。免疫细胞化学鉴定:培养第3代的细胞经特异的兔抗大鼠α-actin抗体免疫组织化学染色胞质着色为棕黄色,呈阳性反应(图2),该结果提示细胞为典型的VSMC。

图1 体外培养的VMSC(×100)
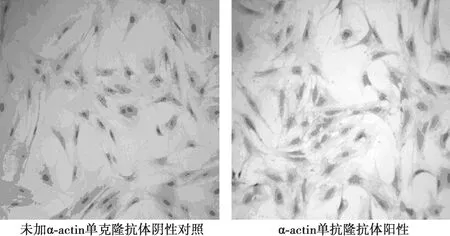
图2 体外培养的VMSC鉴定(×200)
2.2AngⅡ、厄贝沙坦和ACE2基因转染干预VSMC后对AT1R mRNA表达的影响 RT-PCR分析结果显示(表1,图3):与对照组相比,AngⅡ干预VSMC后AT1R mRNA的表达明显增加(P<0.05),而ACE2转染及厄贝沙坦干预VSMC后AT1R mRNA的表达均明显减少(P<0.05),ACE2转染和厄贝沙坦同时干预VSMC能进一步抑制AT1R mRNA表达。ACE2转染VSMC后能明显抑制AngⅡ所诱导AT1R mRNA的表达(P<0.05)。厄贝沙坦干预VSMC后亦能明显抑制AngⅡ所诱导AT1R mRNA的表达(P<0.05)。ACE2和厄贝沙坦共同干预后能协同抑制AngⅡ所诱导AT1R mRNA的表达(P<0.01)。
2.3AngⅡ、厄贝沙坦和ACE2基因转染干预VSMC后对AT1R蛋白表达的影响 Western印迹结果显示(图4,表1):AngⅡ干预后AT1R蛋白的表达较对照组明显增加(P<0.05),ACE2转染及厄贝沙坦干预则使VSMC AT1R蛋白的表达较对照组明显减少(P<0.05),ACE2转染VSMC后能抑制AngⅡ诱导AT1R蛋白表达的作用。厄贝沙坦干预VSMC后亦能明显抑制AngⅡ诱导AT1R蛋白表达的作用(P<0.05)。另外,还发现不论有否AngⅡ干预情况下,ACE2基因转染后均能明显增强厄贝沙坦对AT1R蛋白表达的抑制作用,说明ACE2对厄贝沙坦的抑制AT1R蛋白表达作用具有协同或增强作用(P<0.05)。
表1 RT-PCR及Western印迹法检测不同方法干预VSMC后AT1R mRNA及蛋白的表达
与对照组比较:1)P<0.05;2)P<0.01;与厄贝沙坦组比较:3)P<0.05,与AngⅡ组比较:4)P<0.05,5)P<0.01;与AngⅡ+厄贝沙坦组比较:6)P<0.05

M:Marker;A:对照组;B:pcDNA3.1/Hygro(+)组;C:AngⅡ组;D:pm-ACE2组;E:厄贝沙坦组;F:AngⅡ+pm-ACE2组;G:AngⅡ+厄贝沙坦组;H:pm-ACE2+厄贝沙坦组;I:AngⅡ+pm-ACE2+厄贝沙坦组,下图同图3 RT-PCR检测不同方法干预VSMC后AT1R mRNA表达情况

图4 Western印迹法检测不同方法干预VSMC后AT1R蛋白表达
3 讨 论
ACE2作为该RAS系统的重要成员,主要通过ACE2-Ang(1~7)-Mas受体途径发挥与AngⅡ相拮抗的作用,从而调节心血管、肾脏功能,降低血压和心血管事件。动物实验〔13,14〕发现,ACE2基因敲除使动物血浆及局部组织AngⅡ水平升高,并易于发生严重心力衰竭。Zhao等〔15〕利用携带ACE2基因慢病毒载体感染明显改善心肌梗死大鼠的心脏重构。
目前观点认为,AngⅡ主要是通过AT1R及其下游信号分子介导VMSC的异常增殖〔2,3〕,AT1R是调控VMSC增殖的关键环节。本实验的结果提示ACE2基因转染除了将AngⅡ水解生成Ang-(1~7)以外,可能还通过直接下调AT1R的表达发挥抑制VMSC异常增殖的作用。Xiao等〔16〕研究也证明脑部ACE2选择性高表达在抑制心力衰竭中所致交感神经兴奋,增强其压力敏感性的同时也抑制了延髓孤束核和腹外侧核的AT1R蛋白表达。ACE2作为一个羧肽酶,其主要作用是水解AngⅡ生成Ang-(1~7),那么本研究上述实验结果是否由于ACE2基因转染后ACE2活性增加,Ang-(1~7)生成增多,后者进而对AT1R的表达产生抑制作用呢?因为目前关于Ang-(1~7)与AT1R表达相关性的研究还比较少,Huang等〔17〕发现Ang-(1~7)对HSC-T6细胞AT1R的表达并没有明显影响,这在一定程度上支持本研究关于ACE2直接下调AT1R表达的结论,后期实验可通过使用Mas受体拮抗剂A779来阻断Ang(1~7)作用以进一步确定ACE2对AT1R的直接调控作用。
不仅如此,本研究发现ACE2基因转染在调控AT1R表达方面与AT1R拮抗剂厄贝沙坦有协同作用,两者单独干预均能下调AT1R表达,两者联合干预时对AT1R表达的下调程度明显较单独干预时强。Igase等〔18〕发现,奥美沙坦可使大鼠颈动脉球囊损伤后新生内膜处ACE2表达明显增加。有研究发现〔19〕AngⅡ能够同过MAPK信号通路抑制ACE2 mRNA表达,ACEI或ARB减少AngⅡ的合成能够阻止这种负反馈,这可能是ACE2和厄贝沙坦对AT1R具有协同抑制作用的发生机制。
虽然本研究尚未明确ACE2与AT1R作用的确切机制,但可以明确ACE2与AT1R存在相互作用,ACE2基因转染及AT1R受体拮抗剂在实验中均能有效抑制AT1R的表达,并且该作用具有协同性。
4 参考文献
1Fleming I,Kohlstedt K,Busse R,etal.The tissue renin-angiotensin system and intracellular signalling〔J〕.Curr Opin Nephrol Hypertens,2006;15(1):8-13.
2Suzuki H,Motley ED,Frank GD,etal.Recent progress in signal transduction research of the angiotensin Ⅱ type-1 receptor:protein kinases,vascular dysfunction and structural requirement〔J〕.Curr Med Chem Cardiovasc Hematol Agents,2005;3:305-22.
3Mifune M,Ohtsu H,Suzuki H,etal.G protein coupling and second messenger generation are indispensable for metalloprotease-dependent,heparin binding epidermal growth factor shedding through angiotensin Ⅱ type-1 receptor〔J〕.J Biol Chem,2005;280:26592-9.
4Mendoza-Torres E,Oyarzún A,Mondaca-Ruff D,etal.ACE2 and vasoactive peptides:novel players in cardiovascular/renal remodeling and hypertension〔J〕.Ther Adv Cardiovasc Dis,2015;9(4):217-37.
5Katvich MJ,Grobe JL,Huentelman M,etal.Angiotensin-converting enzyme 2 as a novel taget for gene therapy for hypertension〔J〕.Exp Physiol,2005;90:299-305.
6Danilczyk U,Eriksson U,Oudit GY,etal.Physiological roles of angiotensin-converting enzyme 2〔J〕.Cell Mol Life Sci,2004;61:2714-9.
7Der Sarkissian S,Huentelman MJ,Stewart J,etal.ACE2:a novel therapeutic target for cardiovascular disease〔J〕.Prog Biophys Mol Biol,2006;91:163-98.
8Koka V,Huang XR,Chung ACK,etal.Angiotensin Ⅱ up-regulates angiotensin converting enzyme(ACE),but down-regulates ACE2 via the AT1-ERK/p38 MAP kinase pathway〔J〕.Am J Pathol,2008;172(5):1174-83.
9Xia H,Feng Y,Obr TD,etal.AngⅡtype 1 receptor-mediated reduction of angiotensin-converting enzyme 2 activity in the brain impairs baroreflex fuction in hypertensive mice〔J〕.Hypertension,2009;53:210-6.
10晋学庆,卢卓强,林 旭.血管紧张素转换酶2基因转染抑制平滑肌细胞增殖〔J〕.中华医学杂志,2011;91(2):125-8.
11卢卓强,晋学庆.小鼠血管紧张素转化酶2基因表达型载体的构建及体外表达〔J〕.中国组织工程研究与临床康复,2010;14(46):8600-3.
12赵三妹,夏人仪,乇宗立,等.动脉平滑肌细胞的培养方法及其应用〔J〕.中华病理学杂志,1987;16(4):260-2.
13Tikellis C,Bernardi S,Burns WC.Angiotensin-converting enzyme 2 is a key modulator of the renin-angiotensin system in cardiovascular and renal disease〔J〕.Curr Opin Nephrol Hypertens,2011;20(1):62-8.
14Oudit GY,Kassiri Z,Patel MP,etal.Angiotensin Ⅱ-mediated oxidative stress and inflammation mediate the age-dependent cardiomyopathy in ACE2 null mice〔J〕.Cardiovasc Res,2007;75(1):29-39.
15Zhao YX,Yin HQ,Yu QT,etal.ACE2 overexpression ameliorates left ventricular remodeling and dysfunction in a rat model of myocardial infarction〔J〕.Hum Gene Ther,2010;21(11):1545-54.
16Xiao L,Gao L,Lazartigues E,etal.Brain-selective overexpression of angiotensin-converting enzyme 2 attenuates sympathetic nerve activity and enhances baroreflex function in chronic heart failure〔J〕.Hypertension,2011;58(6):1057-65.
17Huang H,Zhou J,Cui Z,etal.Angiotensin Ⅱ type 1 receptor-associated protein plays a role in regulating the local renin-angiotensin system in HSC-T6 cells〔J〕.Mol Med Rep,2015;12(3):3763-8.
18Igase M,Kohara K,Nagai T,etal.Increased expression of angiotensin converting enzyme 2 in conjunction with reduction of neointima by angiotensin Ⅱ type 1 receptor blockade〔J〕.Hypertens Res,2008;31(3):553-9.
19Gallagher PE,Ferrario CM,Tallant EA.MAP kinase/phosphatase pathway mediates the regulation of ACE2 by angiotensin peptides〔J〕.Am J Physiol Cell Physiol,2008;295:C1169-74.

