右美托咪啶对肾缺血再灌注损伤大鼠肾功能及肺组织Toll样受体4蛋白表达的影响
赵 亮 黄丽娟 宋丽莉 赵展琦 王鑫凯 王忠群 丛威亮
(齐齐哈尔医学院附属第三医院麻醉科,黑龙江 齐齐哈尔 161000)
缺血/再灌注损伤(IRI)为临床高发病理症状,肾移植手术或多种大型手术围术期所发生的肾缺血再灌注损伤(RIRI)非常典型且严重,受到医疗工作者的高度关注〔1〕。研究证实,RIRI与其他传统类型肾脏损伤相对比,损伤更加复杂,并且临床病死率较高,这可能与肾外器官发生功能障碍有关〔2〕。RIRI不但会影响肾功能情况,还会引发一定程度肺功能障碍,并且肾受损程度与肺功能障碍二者间存在一定相互促进关系〔3,4〕。虽然RIRI造成肾外器官肺发生功能障碍具体机制仍未明确,但是目前研究结果显示其和机体应激发生的炎症反应密切相关,Toll样受体(TLR)4蛋白可能是这个过程中的关键因子,TLR4可以和脂多糖结合蛋白结合,激活下游信号通路蛋白,导致炎症因子分泌增加〔5〕。右美托咪定(Dex)作为新型高选择性α2类型受体激动药物,可有效降低RIRI情况,但有关该药对于肾脏及对远隔器官等发挥保护作用的具体分子机制仍需要深入探讨〔6〕。本研究通过分析Dex对RIRI大鼠肾功能及肺组织TLR4蛋白的影响,旨在提供更加详实的数据支持。
1 资料和方法
1.1一般资料 选择2017年7月医院饲养的80只体重250~300 g的清洁级SD雄性大鼠,按照随机数字表法分成对照组、I/R组(缺血再灌注组)、预处理组(给予Dex预处理)及后处理组(给予Dex后处理),每组20只。对照组仅对大鼠实施右肾切除,I/R组行右肾切除后,使左肾缺血约45 min,而后灌注1 h制成RIRI模型。预处理组在对大鼠实施股静脉穿刺之后为其泵注剂量为1 μg/kg的Dex,在10 min后将剂量改成0.5 μg/kg,给予泵注30 min后到缺血即刻时停止。后处理组从大鼠的左肾再灌注开始经静脉泵注剂量为1 μg/kg的Dex,在10 min后将剂量改成0.5 μg/kg,在泵注30 min后停止。
1.2模型制作 大鼠术前禁食、水6 h,而后10%水合氯醛腹腹注射,剂量为3 mg/kg。行腹中线4~5 cm纵切口,暴露腹腔,使小肠、结肠、脾脏移到左侧,分离右肾,结扎肾蒂,将右肾取出。而后再将小肠、结肠及脾脏移到右侧,充分显露出左侧的肾脏及左肾蒂,通过无损伤血管夹夹闭肾蒂45 min后松开血管夹,恢复血液灌注,如肾脏由暗紫色变为红色则表示I/R模型复制成功,缝合并关闭腹腔。
1.3标本检测 在模型建立成功后的6 h对各组大鼠进行尾静脉取血3 ml,3 000 r/min离心15 min,提取上清液,将其加入1.5 ml离心管内,放在-80℃下保存待测。通过购自贝克曼库尔特公司的AU680型全自动生化分析仪及附带试剂测定大鼠血清尿素氮(BUN)和肌酐(Scr)水平,并应用购自深圳的晶美工程公司的酶联免疫(ELISA)法试剂盒测定血清白细胞介素(IL)-6及IL-1β水平,有关操作步骤均严格遵照说明书的描述进行。实验结束时,将大鼠处死,取肾组织及肺组织进行制片,显微镜下观察大鼠肾和肺的组织学变化。通过免疫组化的PV6001二步法及购自北京的中杉公司的试剂盒和购自武汉博士德公司的TLR4兔抗大鼠型多克隆抗体测定肺组织的TLR4蛋白表达水平,将每张切片置于10×40倍的光镜下,任选10个视野,通过Olympus BX14图像分析系统实施人工分析,统计时不计染色强度,针对每个高倍镜的视野依次实施阳性细胞的计数,算出平均值为阳性表达水平。
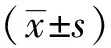
2 结 果
2.1各组大鼠肾功能指标的对比 与对照组相比,I/R组的肾脏损伤更为严重,且炎症明显,存在肾小管扩张、充血及水肿,肺组织呈炎性细胞的浸润,在肺泡四周可见毛细血管出血及肺间质型水肿。而Dex预处理组及后处理组的肾脏损伤和炎症均缓解,细胞异常形态较少,肺泡结构比较清晰,病理变化明显改善。各组大鼠Scr和BUN水平组间比较,差异均有统计学意义(均P<0.05)。I/R组、预处理组及后处理组的Scr和BUN水平均明显高于对照组,而预处理组及后处理组的Scr和BUN水平均明显低于I/R组,差异均有统计学意义(均P<0.05)。但预处理组及后处理组的Scr和BUN水平相比,差异均无统计学意义(均P>0.05),见表1。
2.2各组大鼠血清IL-6和IL-1β水平的对比 各组大鼠的血清IL-6和IL-1β水平相比,差异均有统计学意义(均P<0.05)。I/R组、预处理组及后处理组的IL-6和IL-1β水平均明显高于对照组,而预处理组及后处理组的IL-6和IL-1β水平均明显低于I/R组,差异均有统计学意义(均P<0.05)。但预处理组及后处理组的IL-6和IL-1β水平相比,差异均无统计学意义(均P>0.05),见表2。
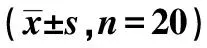
表1 各组大鼠肾功能指标对比
与对照组相比:1)P<0.05;与I/R组相比:2)P<0.05,下表同

表2 各组大鼠血清IL-6和IL-1β水平对比
2.3各组大鼠肺组织TLR4蛋白的表达对比 各组大鼠的肺组织TLR4蛋白的表达水平相比,差异均有统计学意义(均P<0.05)。I/R组(92.34±23.68)、预处理组(69.83±11.24)及后处理组(70.13±13.65)的TLR4蛋白表达明显高于对照组(1.01±0.32),而预处理组及后处理组的TLR4蛋白表达水平均明显低于I/R组,差异均有统计学意义(均P<0.05)。但预处理组及后处理组的TLR4蛋白表达水平相比,差异无统计学意义(P>0.05)。I/R组、预处理组及后处理组的TLR4蛋白表达水平相比,差异均无统计学意义(均P>0.05)。
2.4大鼠肺组织TLR4蛋白表达水平与肾功能及IL-6和IL-1β水平的相关性分析 大鼠肺组织TLR4蛋白表达水平与Scr、BUN、IL-6及IL-1β均呈正相关(r=0.688,0.710,0.696,0.724;均P=0.000)。
3 讨 论
目前有关RIRI具体发病机制尚不明确。研究表明,当肾组织内发生缺血情况时其血流量会下降,进而导致肾脏处于缺氧环境,发生再灌注之后虽然缺血组织得到血流恢复,但是因其能量代谢功能出现障碍、细胞通透性受到影响,而易诱发炎症反应、加重组织受损情况〔7,8〕。同时,再灌注阶段的氧化应激反应会产生大量活性氧簇(ROS),ROS能够刺激促炎细胞大量产生,进而引发中性粒细胞及巨噬细胞等向肾脏及其远隔器官趋化并发生浸润。并且机体在IRI之后会出现炎症反应,生成的炎症因子能够激活下游有关凋亡的信号通路,使得细胞最终受到损伤甚至发生凋亡。而极易受到影响的肺器官也可以表达有关促凋亡因子,并且通过胞吐形式分泌到机体内,加重肾功能损伤,以此形成恶性循环。研究发现,α2受体可分布在肾脏以及周身组织器官中,而Dex属于α2受体激动药,能够借助激活突触前内α2受体来发挥镇静以及抗炎等功效,可能有利于降低围术期RIRI发生率〔9,10〕。
本研究发现,Dex预处理组及后处理组对大鼠肾脏和肺损伤均具有改善作用,病理变化明显改善,提示Dex处理能够改善RIRI大鼠的肾功能,原因可能与Dex的作用机制有关。动物实验研究表明,应用Dex治疗RIRI,可有效抑制大鼠血管加压素大量分泌,从而帮助肾器官加大血流灌注,以提升肾小球滤过率,降低RIRI之后肾功能受损程度〔11〕。同时,Dex能够激活细胞抗凋亡信号通路,进而提升细胞存活率,使得从缺氧状态下恢复到供氧状态的肾脏细胞受到保护。因此,Dex既能够对肾脏RIRI之后所发生的血管痉挛情况进行调节,维护肾脏功能,又可以对肾小管中上皮细胞自身抗凋亡型信号通路进行激活,保护其细胞,进而起到降低肾损伤的疗效〔12〕。同时,本研究还发现,Dex处理能够减少RIRI大鼠机体的炎症因子水平。原因主要可能是因为Dex有抑制RIRI之后肺组织上炎症因子产生及释放的功效,进而起到保护肺器官作用。本研究中Dex处理能降低RIRI大鼠肺组织中TLR4蛋白的表达。TLRs属于先天免疫系统内细胞跨膜类受体及病原模式类型识别受体,通常在急性炎性反应自身调节以及细胞间信号传导或者细胞凋亡等过程中发挥作用。TLR4就是其中一种受体,其功能在于当其信号通路受到激活之后可以激发多类炎性因子转录及合成,因此,TLR4和炎性因子生成关系密切〔13〕。本文提示可通过监测TLR4蛋白的表达反馈出机体其他器官的状态及炎症,Karahan等〔14〕的报道中也得出了类似结论。综上所述,Dex对RIRI大鼠的肾功能和炎症水平均具有改善作用,并降低肺组织TLR4蛋白的表达,且肺组织TLR4蛋白的表达与肾功能及炎症指标具有紧密的联系,临床可考虑将其作为新型监测靶点。
4 参考文献
1卜 林,陈 艳.盐酸右美托咪啶对缺血再灌注肾损伤小鼠的肾小管保护作用〔J〕.中国现代医学杂志,2016;26(10):1-5.
2张志杰,钟亚楠,古妙宁,等.右美托咪啶对骨科止血带所致缺血-再灌注损伤的氧化应激和炎性因子的影响〔J〕.中华创伤骨科杂志,2014;16(6):499-503.
3Erbatur ME,SezenC,Bayraktar AC,etal.Effects of dexmedetomidine on renal tissue after lower limb ischemia reperfusion injury in streptozotocin induced diabetic rats〔J〕.Libyan J Med,2017;12(1):1270021.
4斯妍娜,张 媛,韩 流,等.SIRT3介导CypD去乙酰化在右美托咪定减轻肾缺血再灌注损伤中的作用〔J〕.中华麻醉学杂志,2016;36(2):239-41.
5Chen Q,Yi B,Ma J,etal.α2-adrenoreceptor modulated FAK pathway induced by dexmedetomidine attenuates pulmonary microvascular hyper-permeability following kidney injury〔J〕.Oncotarget,2016;7(35):55990-6001.
6赵京禹,费 翔,郭 徽,等.右美托咪定预处理对小鼠肠缺血再灌注损伤的作用研究〔J〕.现代生物医学进展,2014;14(35):6823-6.
7王庆亮,刘 萃,胡志向,等.右美托咪啶预先给药对大鼠肢体缺血再灌注致肾损伤的影响〔J〕.中华实验外科杂志,2016;33(6):1453.
8Liu YE,Tong CC,Zhang YB,etal.Effect of dexmedetomidine on rats with renal ischemia-reperfusion injury and the expression of tight junction protein in kidney〔J〕.Int J Clin Exp Med,2015;8(10):18751-7.
9鄢 娜,冯泽国,岳剑虹,等.右美托咪啶预处理对大鼠肾缺血再灌注后肝肾抗氧化能力的影响〔J〕.解放军医学院学报,2014;35(7):755-8.
10张捍平,毛玉林,李志刚,等.右美托咪啶对大鼠肾缺血再灌注损伤的保护作用〔J〕.武警医学,2014;25(3):272-4.
11蒋 鹏,黄祥君,赵 明,等.盐酸右美托咪定对缺血-再灌注损伤大鼠心肌Toll样受体4/核因子-κB信号通路的作用〔J〕.临床麻醉学杂志,2014;30(3):294-6.
12陈裕洁,龚楚链,谭 芳,等.右美托咪啶预处理对脓毒症肾损伤大鼠炎性因子和氧化应激的影响〔J〕.南方医科大学学报,2015;35(10):1472-5,1491.
13王 云,黄升海,吴 璇,等.呼吸道合胞病毒合并肺炎克雷伯菌感染所致肺炎与TLR4-NF-κB信号通路关系的初步研究〔J〕.安徽医科大学学报,2015;50(9):1252-8.
14Karahan MA,Yalcin S,Aydogan H,etal.Curcumin and dexmedetomidine prevents oxidative stress and renal injury in hind limb ischemia/reperfusion injury in a rat model〔J〕.Ren Fail,2016;38(5):693-8.

