自噬相关16样蛋白1、半乳凝集素9在炎症性肠病患者中的表达及相关性
吴娜,孙剑经,陈文婷,袁殿宝
(河北北方学院附属第一医院,河北张家口075000)
炎症性肠病是一种病因尚不明确的慢性非特异性肠道炎性病变,包括溃疡性结肠炎和克罗恩病,是胃肠道最为严重的疾病之一[1,2]。该病常突发起病,多数病程缓慢,易反复发作,少数病例呈急性暴发,病情较为凶险,病程较长者亦被认为结肠癌的癌前病变[3]。目前认为炎症性肠病的发病机制为环境因素作用于遗传易感者,在肠道菌丛的参与下,启动了肠道免疫及非免疫系统,最终导致免疫反应和炎症过程[4~6]。自噬相关16样蛋白1(ATG16L1)在先天免疫反应和抗细胞内病原体中,有针对性地参与自噬过程及破坏病原体的蛋白[7]。半乳凝集素9(Galectin-9)是一种半乳糖苷结合蛋白,有一个特异性的由大约130个氨基酸序列组成的保守的糖识别结构域。Galectin-9参与了许多生理和病理过程,包括细胞间黏附、细胞生长调节、炎症反应和免疫调节等[8]。本研究拟探讨ATG16L1、Galectin-9在炎症性肠病患者中的表达及相关性。
1 资料与方法
1.1 临床资料 选取2015年1月~2016年6月在本院进行治疗的炎症性肠病患者50例作为观察组,其中男24例、女26例,年龄34~67(46.8±3.4)岁,病变部位位于直肠者6例、左半结肠13例、右半结肠3例、全结肠者18例。另选取同期在我院因肠胃不适需进行体检者40例作为对照组,其中男19例、女21例,年龄32~65(47.1±3.2)岁。两组研究对象在年龄、性别等无统计学差异(P均>0.05)。纳入标准:入组患者临床资料完整且彼此无血源关系;观察组入组患者均符合2000年制定的炎症性肠病诊断标准;对照组入组患者均为因肠胃不适需进行肠道组织活检的体检人群。排除标准:合并其他自身免疫性疾病者。
1.2 观察指标及方法 ①血清中ATG16L1、Galectin-9表达水平检测:采集患者静脉血,静置30 min,1 500 r/min离心分离血清,采用酶联免疫吸附法测定血清中ATG16L1、Galectin-9表达水平。②肠上皮组织中ATG16L1、Galectin-9 mRNA表达检测:肠道内镜活检获取肠上皮组织标本,采用RT-PCR法,提取基因组DNA,用紫外分光光度计测定DNA含量,取DNA 50 μL实验用,设计引物,进行RT- PCR,检测肠道组织中两种基因mRNA水平。③肠上皮组织中ATG16L1、Galectin-9蛋白表达检测:肠道内镜活检获取肠上皮组织标本,采用Western blotting法,提取总蛋白后,以BCA法定量,之后参照试剂操作说明书操作步骤,检测两组研究对象肠上皮组织中ATG16L1、Galectin-9蛋白表达水平。
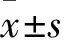
2 结果
2.1 两组血清ATG16L1、Galectin-9水平比较 观察组患者血清ATG16L1、Galectin-9水平均低于对照组,差异有统计学意义(P均<0.05)。见表1。

表1 两组血清ATG16L1、Galectin-9水平比较
2.2 两组肠上皮组织ATG16L1、Galectin-9 mRNA表达比较 观察组患者肠上皮组织ATG16L1、Galectin-9 mRNA表达均低于对照组,差异有统计学意义(P均<0.05)。见表2。
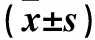
表2 两组肠上皮组织ATG16L1、Galectin-9 mRNA表达比较
2.3 两组肠上皮组织ATG16L1、Galectin-9蛋白表达比较 观察组患者肠上皮组织ATG16L1、Galectin-9蛋白表达均低于对照组,差异具有统计学意义(P均<0.05)。见表3。
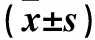
表3 两组肠上皮组织ATG16L1、Galectin-9蛋白表达比较
2.4 ATG16L1、Galectin-9与炎症性肠病及其相互之间的相关性 Sperman等级相关性分析表明ATG16L1、Galectin-9表达与炎症性肠病的发生均呈负相关(r分别为-0.381、-0.401,P均<0.05);ATG16L1与Galectin-9在炎症性肠病肠组织中表达呈正相关(r=0.411,P<0.05);ATG16L1与Galectin-9在血清中的表达呈正相关(r=0.281,P<0.05);血清中ATG16L1与组织中ATG16L1表达呈正相关(r=0.382,P<0.05);血清中Galectin-9与组织中Galectin-9表达呈正相关(r=0.403,P<0.05)。
3 讨论
炎症性肠病是一组病因未明的慢性非特异性肠道疾病,包括溃疡性结肠炎和克罗恩病。近年来对其发病机制的研究进行了大量研究,但仍无法确定其发病机制,根据目前已有的实验结果,多认为该病的发生受到遗传因素、环境因素以及自身免疫因素的共同影响。细胞自噬是近年来生物学领域的热点课题,是机体实现内环境稳态的一种重要的自我保护机制,其发生过程为在溶酶体介导下,细胞内发生损伤的蛋白质、细胞器被代谢,清除,有研究发现细胞自噬与炎症性肠病的发生及炎性反应存在密切关系[9,10]。ATG16L1是一种重要的自噬相关基因,对自噬小体的形成至关重要,此外,有学者认为Galectin-9参与了许多生理和病理过程,包括细胞间黏附、细胞生长调节、炎症反应和免疫调节等。为进一步明确与炎症性肠病发生相关的基因或生物标志物,阐明其发病机制,为临床诊断、治疗该类疾病提供参考。本研究以医院病例组织标本为研究对象,分析血清及肠上皮组织中ATG16L1、Galectin-9基因表达情况与炎症性肠病之间的关系, 为炎症性肠病的基因诊断与基因治疗探索一条可行之路。
本研究结果表明观察组患者血清ATG16L1、Galectin-9表达水平均低于对照组。根据上述结果可以看出在炎症性肠病患者血清中ATG16L1、Galectin-9的表达均较正常患者明显下调,这说明ATG16L1、Galectin-9表达水平的降低会增加炎症性肠病的发生风险。原因可能是ATG16L1基因在肠上皮细胞和潘氏细胞表达,研究表明当其发生突变时会导致机体不能对引起肠道感染的细菌的清除能力降低,进而造成肠粘膜炎症[11,12]。Galectin-9作为一种多糖连接蛋白,与细胞的生存和信号传导密切相关,其能够下调巨噬细胞炎性蛋白-2、巨噬细胞炎性蛋白-1等前炎症因子以及白介素-12、白介素-17和γ干扰素等炎性因子水平,从而能够促进Treg细胞反应[13,14],而且有研究指出若能在TNBS诱导的结肠炎模型中封闭白介素-17的作用,则能有效抑制结肠炎的发展[15]。
本研究同时以RT-PCR在mRNA水平测定肠上皮组织ATG16L1、Galectin-9 mRNA表达水平,结果表明观察组患者ATG16L1、Galectin-9 mRNA表达水平均低于对照组。此外,本研究还采用Western blotting方法在蛋白水平分析了炎症性肠病患者和正常人群的两种蛋白的表达水平,结果表明观察组患者ATG16L1、Galectin-9蛋白表达水平均低于对照组。上述结果在基因和蛋白水平均表明了炎症性肠病组织中Galectin-9和ATG16L1的表达会下调。
为进一步探讨以Galectin-9和ATG16L1作为炎症性肠病生物标志物的可行性,本研究采用Sperman等级相关性分析对ATG16L1、Galectin-9两种基因表达的相关性以及其在血清和炎症性肠病患者肠组织中的表达相关性进行了分析,结果表明ATG16L1、Galectin-9与炎症性肠病均呈负相关,两种基因之间以及ATG16L1、Galectin-9在血清中和肠上皮组织中的表达水平均呈正相关。根据上述结果,可以看出Galectin-9和ATG16L1基因表达水平下调会增加炎症性肠病的发生风险,ATG16L1表达水平下降会导致机体清除感染肠道的细菌的能力,进而造成肠粘膜炎症,而目前关于Galectin-9下降影响炎症性肠病病程的机理尚不明确。此外,根据血清与肠道组织ATG16L1、Galectin-9表达水平的相关性分析结果可以看出血清中Galectin-9和ATG16L1的表达与患者肠道组织中上述基因的表达水平具有较好的相关性,这提示在临床上通过采集患者血清,应用ELISA法测定患者血清中Galectin-9和ATG16L1的表达水平即可在一定程度上说明患者的病情,从而避免了检测肠道组织中Galectin-9和ATG16L1表达的取样困难,依从性差的弊端。此外,相对于RT-PCR和Western blotting,ELISA法操作更简便,成本更低。
综上所述,ATG16L1、Galectin-9在炎症性肠病患者血清及肠上皮组织中的表达均显著下调,ATG16L1、Galectin-9与炎症性肠病均呈负相关,两种基因之间以及在血清中和肠上皮组织中的表达水平均呈正相关,可作为潜在的炎症性肠病生物标志物。
参考文献:
[1] 钱家鸣,杨红.中国炎症性肠病研究的历史回顾现状和展望[J].中国实用内科杂志,2015,35(9):727-730.
[2] 涂梦莹,宋丽君.炎症性肠病的诊断和治疗进展[J].实用儿科临床杂志,2012,27(7):552-556.
[3] 何晓生,陈泽贤,兰平.炎症性肠病癌变研究进展[J].中国实用外科杂志,2013,33(7):604-606.
[4] 宋军民,杨超,常远,等.炎症性肠病患者肠道菌群变化与发病关系研究[J].中华医院感染学杂志,2015,25(15):3425-3427.
[5] 孙科明,孙华文,曾放,等.IL-33对克罗恩病小鼠肠组织细胞因子及转录因子的影响[J].山东医药, 2016, 56(40): 29-31, 114.
[6] 张婷,陈烨,王中秋,等.炎症性肠病患者肠道菌群结构的变化及其与炎性指标的关系[J].南方医科大学学报,2013,33(10):1474-1477,1498.
[7] Symington JW, Wang C, Twentyman J, et al. ATG16L1 deficiency in macrophages drives clearance of uropathogenic E. coli in an IL-1β-dependent manner[J]. Mucosal Immunol, 2015,8 (6): 1388-1399.
[8] 李育蓉,韩根成,黎燕.半乳凝素-9(galectin-9)的免疫调节作用研究进展[J].军事医学,2011,35(7):549-552
[9] 何贤辉,何健,欧阳东云.细胞自噬与炎症反应相互作用的研究进展[J].暨南大学学报(自然科学与医学版),2013,34(2):125-128.
[10] 张北平,赵喜颖,曹翠纳,等.“细胞自噬-细胞因子-伏毒-溃疡性结肠炎”相关性假说[J]. 医学争鸣,2017,8(2):15-19.

