三七皂苷通过PPARγ调控SIRT1介导的狼疮肾炎小鼠脾淋巴细胞激素耐药及脂代谢影响的研究
丁伟森徐峥吴人照童晔玲鲁盈
1.浙江中医药大学 杭州 310053 2.浙江省中医药研究院 3.浙江省立同德医院
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种自身免疫功能紊乱所导致的系统性疾病,其中狼疮肾炎(lupus nephritis,LN)是SLE最常见和最严重的脏器损害。LN作为慢性肾脏病(chronic kidney disease,CKD)的一种,具有疾病活动与缓解交替、病程长、病情易反复及并发症多等特点[1-2]。糖皮质激素是目前国内外公认的控制狼疮活动,改善病情的一线药物[3],它能快速缓解急性炎症状态、改善肾实质损伤,在LN缓解期治疗中发挥重要作用,极大地提高了患者的近期生存率[4]。但是,长期激素应用加之慢性炎症加剧了患者脂代谢紊乱[5-6],导致动脉粥样硬化发生的风险大幅升高,严重威胁着患者的远期生存,尤其是激素耐药的难治性LN患者。
LN的中医病机中“瘀血”占有十分重要地位[7],“瘀血”在动脉粥样硬化形成中同样占据着重要地位,如在冠心病常见中医证候要素中“瘀血”位居首位,血脂异常则是瘀血证相关危险因素之一[8-9]。活血化瘀中药可通过调节脂质代谢、稳定动脉粥样硬化斑块以及抗炎、抗血小板聚集等多种途径发挥抗动脉粥样硬化的作用,其中三七是最常被选用的药物[10-12]。研究证明,三七主要有效成分三七皂苷(Panax notoginseng saponin,PNS)能显著下调狼疮患者外周血淋巴细胞多药耐药基因编码蛋白P-糖蛋白(P-glycoprotein,P-gp)的表达,缓解激素耐药[13];进一步研究证实沉默信息调节因子相关酶1(silent information regulation factor related enzyme 1,SIRT1)是调控 P-gp 表达的关键因子[14-15]。因此,深入研究活血化瘀中药调控LN激素耐药和改善脂代谢紊乱的机制具有重要意义。
本研究拟在前期研究基础上,从脂代谢角度出发,选择脂代谢调控的关键靶点之一的过氧化物酶增殖体活化受体γ(peroxidase activated receptor gamma,PPARγ)为切入点,初步研究其与SIRT1的相关性,进一步探索PNS在调控LN小鼠激素耐药和脂代谢紊乱中的效应以及相关作用机制。
1 材料和方法
1.1 实验动物 NZB/WF1 LN小鼠,雌雄各半,体质量20~24g,委托南京大学-南京生物医药研究院从美国 Jackson Laboratory进口 [许可证号:SCXK(苏)2017-0008],饲养于浙江省中医药研究院动物中心[许可证号:SYXK(浙)2014-0003]。饲养条件:温度(21±1)℃,湿度 50%~60%,自由饮水,标准普通饲料喂养。实验动物饲养、使用、标本处置和操作均按照3R原则给予人道主义关怀。动物经适应性饲养7d后进行尿液代谢检测,测定24h尿蛋白含量。
1.2 主要试剂及仪器 小鼠红细胞裂解液购于碧云天生物技术有限公司(批号:20161015),注射用甲泼尼龙琥珀酸钠购于辉瑞制药有限公司(40mg/支,批号:20160904),PNS(血塞通注射液)购于广西梧州制药(集团)股份有限公司(批号:20160707),PPARγ siRNA和 PPARγ慢病毒质粒均委托吉玛制药技术有限公司(上海)合成和制备(批号:20161128、20170727),RNA提取试剂盒、Trizol试剂、RNA逆转录试剂盒、荧光定量RT-PCR反应试剂盒均购于TAKARA宝生物工程有限公司(批号:20170325、20170228、20170304、20170214),兔抗小鼠PPARγ及SIRT1抗体(一抗)、兔抗小鼠三磷酸腺苷结合盒转运体A1(adenosine triphosphate binding cassette transporter A1,ABCA1)流式检测抗体、FITC标记羊抗兔IgG多克隆二抗均购 于 Abcam 公 司 ( 批 号 :20170207、20170218、20170910、20170215),细胞胞质蛋白和核蛋白提取试剂盒为碧云天生物技术有限公司产品(批号:20170211),Cholesterol/Cholesteryl Ester Assay 试 剂盒购于Abcam公司(批号:20170618)。流式细胞仪购于Beckman Coulter公司,Roche 480Ⅱ型RT-PCR仪为Roche公司产品,Flour Chem E高灵敏化学发光凝胶成像分析系统为ProteinSimple公司产品,Biotek Epoch 2酶标仪购于美国伯腾公司,Nikon TS100倒置荧光显微镜为Nikon公司产品。
1.3 方法
1.3.1 细胞模型制备 在生物安全柜中,采用密度梯度法分离NZB/WF1小鼠脾淋巴细胞,将淋巴细胞悬液加入24孔细胞培养板中,每孔培养体系为1mL,细胞浓度106个/mL。除对照组外,各孔均加入终浓度2μg·mL-1的甲基强的松龙,在 37℃、5%CO2培养箱中培养,分别于0、24、72h观察细胞形态变化,72h后收集细胞,以流式细胞术检测P-gp蛋白表达,Western blot检测SIRT1蛋白表达。参考文献[14-16]的结果,本实验中以SIRT1蛋白表达增高表示NZB/WF1小鼠脾淋巴细胞激素耐药诱导成功。
1.3.2 siRNA和慢病毒质粒转染 根据产品试剂盒及说明书进行操作。PPARγ序列:上游:5'-GCAAGAGAUCACAGAGUAUTT-3', 下 游 :5'-AUACU-CUGUGAUCUCUUGCTT-3'。慢病毒滴度:5×108TU·mL-1。转染72h后检测,感染复数(multiplicity of infection,MOI)值=10时说明已达到良好的转染和表达效率。
1.3.3 分组及干预 将小剂量甲基强的松龙诱导产生激素耐药的淋巴细胞,分为模型组(LN小鼠脾淋巴细胞激素耐药组)、PPARγ siRNA+PNS组、PPARγ质粒转染组和PNS组,并将未诱导激素耐药的NZB/WF1小鼠脾淋巴细胞作为对照组,每组设3个复孔。siRNA终浓度2μg·mL-1。慢病毒质粒按照MOI=10,即病毒数:细胞数=10:1加入每孔。PNS终浓度根据前期研究确定为200μg·mL-1[14]。培养72h后,提取各组细胞进行后续检测。
1.3.4 检测方法
1.3.4.1 Real-time PCR法检测各组淋巴细胞PPARγ和SIRT1 mRNA表达 参照Trizol抽提试剂盒及说明书,提取干预72h后的脾淋巴细胞总RNA进行逆转录反应。引物扩增设计见表1。逆转录反应条件:37℃ 15min,85℃ 5s,4℃保存。PCR 反应条件:95℃30min,1 个循环;95℃ 5s,60℃ 30s,共 40 个循环;95℃ 15s,60℃ 1min,95℃ 15s,1 个循环。将各组逆转录产物应用Roche 480Ⅱ PCR仪进行反应后得出Mean CT值,采用2-△△Ct法进行数据分析。
1.3.4.2 Western blot检测各组淋巴细胞PPARγ和SIRT1蛋白表达 按照试剂盒说明书分别提取胞质蛋白和核蛋白。以牛血清白蛋白为标准,以BCA法进行蛋白定量。取适量蛋白样品,10%SDS-PAGE电泳(300V,40min),300mA 转膜 2h,放入 5%脱脂牛奶中室温震荡封闭1h;一抗4℃过夜。TBST反复洗膜后,将膜与二抗进行孵育,室温摇床震荡1h,TBST洗膜后ECL显色,凝胶图像分析系统测定各带吸光度(A)值作定量分析。
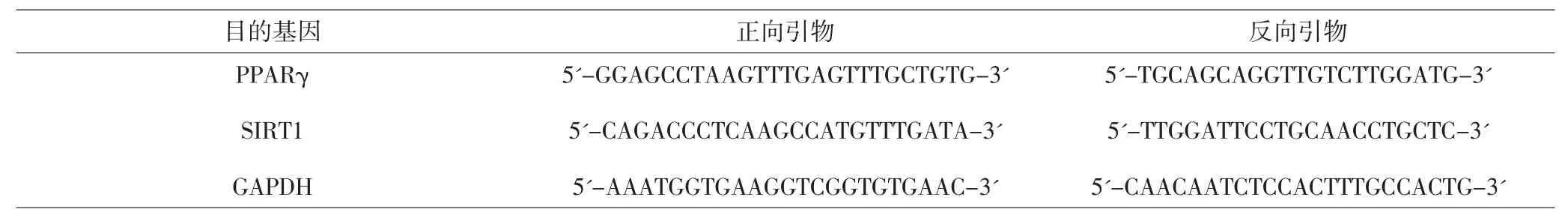
表1 引物序列Fig.1 Primer sequence
1.3.4.3 荧光分光光度计检测各组淋巴细胞胆固醇酯的含量 将培养72h后的各组细胞用预冷PBS洗1~2次,Nonidet P40处理细胞,离心后转移橙色层液相至新的离心管,置于50℃烘箱中30min,每孔加入200μL Cholesterol Assay Buffer,震荡溶解,37℃ 5%CO2培养箱孵育1h后,荧光分光分度计按照Ex/Em=535/585nm,测定OD值。
1.3.4.4 流式细胞仪检测各组淋巴细胞ABCA1蛋白表达 提取培养72h后的各组细胞,以100μL含1%叠氮化钠和10%胎牛血清的PBS重悬,加入兔抗小鼠ABCA1抗体(一抗),室温孵育30min。离心后PBS洗3次。用100μL含5%牛血清白蛋白的PBS重悬,加入FITC标记的羊抗兔IgG多克隆抗体(二抗),室温避光孵育30min。离心后PBS洗3次。PBS 500μL重悬,流式细胞仪检测。
1.4 统计学分析 采用SPSS 18.0统计软件进行统计学分析。计量资料以±s表示。两组间均数比较采用方差分析,行正态性与方差齐性检验。多组间比较方差齐时采用LSD-t检验,方差不齐时采用Dunnett’s T3检验。计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠脾淋巴细胞PPARγ和SIRT1 mRNA表达比较 与对照组比较,模型组PPARγ mRNA表达降低,SIRT1 mRNA 表达增高(P<0.05);与模型组比较,PPARγ siRNA+PNS组、PPARγ质粒转染组和PNS组PPARγ mRNA表达均上调,而SIRT1 mRNA表达均下调(P<0.05),其中PPARγ质粒转染组与PNS组比较,SIRT1 mRNA表达差异无统计学意义(P>0.05)。见表2。
2.2 各组小鼠脾淋巴细胞PPARγ和SIRT1蛋白表达比较 与对照组比较,模型组中PPARγ蛋白表达降低,SIRT1蛋白表达增高(P<0.05);与模型组比较,PPARγ质粒转染组、PNS组PPARγ蛋白表达均增高(P<0.05),而PPARγ siRNA+PNS组PPARγ蛋白表达无统计学差异(P>0.05);与模型组比较,PPARγ siR-NA+PNS组、PPARγ质粒转染组和PNS组中SIRT1蛋白表达均降低(P<0.05)。见图1、表3。2.3 各组LN小鼠脾淋巴细胞内胆固醇酯含量比较与对照组比较,模型组和PPARγ siRNA+PNS组细胞
表2 各组小鼠脾淋巴细胞中PPARγ及SIRT1 mRNA表达(±s,n=3)Tab.2 Expression of PPAR gamma and SIRT1 mRNA in spleen lymphocytes of mice in each group(±s,n=3)

表2 各组小鼠脾淋巴细胞中PPARγ及SIRT1 mRNA表达(±s,n=3)Tab.2 Expression of PPAR gamma and SIRT1 mRNA in spleen lymphocytes of mice in each group(±s,n=3)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与 PPARγ siRNA+PNS 组比较,△P<0.05;与 PPARγ 质粒转染组比较,▲P<0.05。Note:Compared with control group,*P<0.05;compared with model group,#P<0.05;compared with PPARγ siRNA and PNS group,△P<0.05;compared with PPARγ plasmid transfection group,▲P<0.05.
2.1584±0.0024*0.1037±0.0061*#0.0097±0.0033*#△0.0074±0.0092*#△1±0.0064组别 n mRNA相对表达量PPARγ SIRT1模型组PPARγ siRNA+PNS组PPARγ质粒转染组PNS组对照组3 3 3 3 3 0.0083±0.0042*0.0197±0.0085*#2.9281±0.0035*#△1.7654±0.0071*#△▲1±0.0053

图1 各组小鼠脾淋巴细胞中PPARγ及SIRT1蛋白表达Fig.1 Expression of PPAR gamma and SIRT1 protein in spleen lymphocytes of mice in each group
表3 各组小鼠脾淋巴细胞中PPARγ及SIRT1蛋白表达(±s,n=3)Tab.3 Expression of PPAR gamma and SIRT1 protein in spleen lymphocytes of mice in each group(±s,n=3)
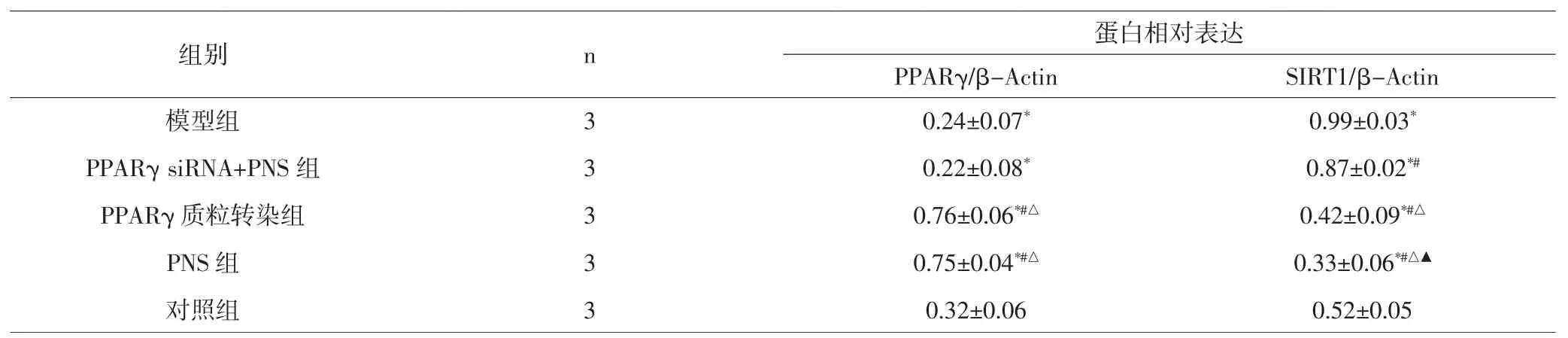
表3 各组小鼠脾淋巴细胞中PPARγ及SIRT1蛋白表达(±s,n=3)Tab.3 Expression of PPAR gamma and SIRT1 protein in spleen lymphocytes of mice in each group(±s,n=3)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与 PPARγ siRNA+PNS 组比较,△P<0.05;与 PPARγ 质粒转染组比较,▲P<0.05。Note:Compared with control group,*P<0.05;compared with model group,#P<0.05;compared with PPARγ siRNA and PNS group,△P<0.05;compared with PPARγ plasmid transfection group,▲P<0.05.
组别 n蛋白相对表达PPARγ/β-Actin SIRT1/β-Actin 0.99±0.03*0.87±0.02*#0.42±0.09*#△0.33±0.06*#△▲0.52±0.05模型组PPARγ siRNA+PNS组PPARγ质粒转染组PNS组对照组3 3 3 3 3 0.24±0.07*0.22±0.08*0.76±0.06*#△0.75±0.04*#△0.32±0.06
内胆固醇酯含量降低(P<0.05);而PPARγ质粒转染组、PNS组细胞内胆固醇酯含量升高(P<0.05)。与模型组比较,PPARγ质粒转染组、PNS组细胞内胆固醇酯的含量均增高(P<0.05);但PPARγ siRNA+PNS组与模型组比较无统计学差异(P>0.05)。见表4。
表4 各组小鼠脾淋巴细胞内胆固醇酯表达(±s,n=3)Tab.4 Cholesteryl ester expression in spleen lymphocytes of mice in each group(±s,n=3)

表4 各组小鼠脾淋巴细胞内胆固醇酯表达(±s,n=3)Tab.4 Cholesteryl ester expression in spleen lymphocytes of mice in each group(±s,n=3)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与 PPARγ siRNA+PNS 组比较,△P<0.05;与 PPARγ 质粒转染组比较,▲P<0.05。Note:Compared with control group,*P<0.05;compared with model group,#P<0.05;compared with PPARγ siRNA and PNS group,△P<0.05;compared with PPARγ plasmid transfection group,▲P<0.05.
组别OD值0.762±0.071*0.824±0.045*2.347±0.032*#△2.036±0.087*#△▲1.413±0.035模型组PPARγ siRNA+PNS组PPARγ质粒转染组PNS组对照组
2.4 各组小鼠脾淋巴细胞ABCA1蛋白表达比较与对照组比较,模型组、PPARγ siRNA+PNS组ABCA1蛋白表达增高,PPARγ质粒转染组和PNS组ABCA1蛋白表达降低(P<0.05);与模型组比较,PPARγ siRNA+PNS组、PPARγ质粒转染组、PNS组中ABCA1蛋白表达均降低(P<0.05),其中PNS组ABCA1蛋白表达下降程度最高(P<0.05)。见图2。
3 讨论
三七是五加科多年生草本植物,具有止血、散瘀、定痛等作用,为活血化瘀,止血生新的要药。作为活血化瘀药的代表,它既能化瘀又能补虚,正符合SLE本虚标实的病机特点,也是临床上治疗LN的常用药。PNS是三七主要有效活性成分之一。既往研究表明,PNS具有调节脂代谢的作用[17]。药理学研究还发现,其具有抗血栓形成、抗缺血性损伤、抗血小板聚集、扩张小血管、改善肾血管微循环、增加肾血流量等作用[18]。本研究中证实PNS能够降低激素耐药LN小鼠脾淋巴细胞中SIRT1表达,结合前期研究结果[14-16],再次证实PNS通过SIRT1/叉头转录因子(forkhead transcription factor 1,FoxO1)/多药耐药-1(multidrug resistance-1,MDR-1)/P-gp 信号通路降低 SIRT1 和P-gp表达,逆转LN鼠脾淋巴细胞激素耐药。
PPARγ是一类配体依赖的核受体转录因子,同时也是重要的激素受体,主要位于脂肪细胞、血管平滑肌细胞中,在淋巴细胞和巨噬细胞中也有分布[19]。研究证实,PPARγ是细胞脂代谢调控的关键靶标之一,主要参与细胞内脂质的合成[20-21]。SIRT1作为一种辅酶Ⅰ依赖性的Ⅲ类组蛋白去乙酰化酶,其底物就包括PPARγ[22]。在代谢性疾病领域的研究已证实PPARγ和SIRT1之间关系密切[23-24]。SIRT1通过对PPARγ的作用,促进“褐变”的白色脂肪组织分化和细胞内脂质合成[25]。在对慢性疾病防御机制的研究中发现,抑制SIRT1能够减轻成人高氧化应激和炎症反应[26]。本研究采用PNS和慢病毒质粒干预PPARγ,结果显示PNS既能提高激素耐药LN小鼠脾淋巴细胞内PPARγ表达,也能降低SIRT1表达,且对SIRT1表达的调控与PPARγ相关,一方面改善了LN淋巴细胞的激素耐药,另一方面调控了由PPARγ介导的细胞内脂代谢。

图2 各组小鼠脾淋巴细胞中ABCA1蛋白表达Fig.2 Expression of ABCA1 protein in spleen lymphocytes of mice in each group
研究发现,LN患者外周血总胆固醇、甘油三酯、低密度脂蛋白胆固醇水平较正常人群和不伴LN的患者增高[27]。众所周知,长疗程使用糖皮质激素可致LN患者外周血血脂水平升高。课题组在前项研究中也观察到,LN小鼠激素耐药模型外周血甘油三酯水平明显升高。研究证实,淋巴细胞内存在脂质代谢过程,而且细胞内的脂质调控水平与血清有所不同[28-29]。本项实验结果表明,激素耐药LN小鼠脾淋巴细胞内存在脂代谢紊乱,PNS可以提高细胞内胆固醇酯含量,改善脂代谢紊乱,维持正常脂质水平。ABCA1是一类依赖三磷酸腺苷(adenosine triphosphate,ATP)的转运体膜蛋白。作为参与介导细胞内胆固醇流出的关键蛋白,ABCA1通过修饰细胞膜脂筏或直接激活信号通路介导脂质流出,发挥抗炎功能[30],它能结合细胞表面贫脂或无脂的载脂蛋白A-Ⅰ(apolipoprotein A-Ⅰ,apoA-Ⅰ),促进高密度脂蛋白生成,启动胆固醇逆向转运(reverse cholesterol transport,RCT)过程,对防止动脉粥样硬化形成具有重要意义[31-32]。本研究通过检测细胞内胆固醇酯含量和ABCA1蛋白表达,结果显示激素耐药LN小鼠脾淋巴细胞内胆固醇酯合成减少,含量降低,细胞内脂代谢出现紊乱;同时细胞内RCT过程异常激活,胆固醇外流增加。PNS干预能降低耐药小鼠脾淋巴细胞内ABCA1蛋白表达,提高细胞内胆固醇酯含量,结合前文所述PNS能提高耐药模型细胞内PPARγ表达,揭示PNS可能通过多个作用途径改善细胞内脂代谢紊乱,维持细胞内脂质水平。
综上所述,激素耐药LN小鼠脾淋巴细胞内存在脂代谢紊乱,PNS能通过上调PPARγ表达,降低SIRT1表达;并抑制ABCA1蛋白高表达和提高细胞内胆固醇酯含量,起到既逆转激素耐药又改善脂质代谢紊乱的双重效应。本研究结果表明以三七为代表的活血化瘀类中药存在多方面的作用,为临床运用中药逆转LN激素耐药,提高疗效,防治动脉粥样硬化,改善患者远期预后及生存质量提供了科学依据。
[1]Baraka E,Dein M E,Farouk H,et al.Hyperhomocysteinemiaand metabolic syndrome are risk factorsfor sub-clinical atherosclerosis in women with systemic lupus erythematosus[J].Egyptian Rheumatologist,2014,37(2):67-74.
[2]Frieri M,Stampfl H.Systemic lupus erythematosus and atherosclerosis:Review of the literature[J].Autoimmun Rev,2015,15(1):16-21.
[3]Mina R,von Scheven E,Ardoin S P,et al.Consensus treatment plans for induction therapy of newly diagnosed proliferative lupus nephritis in juvenile systemic lupus erythematosus[J].Arthritis Care Res,2012,64(3):375-383.
[4]Ruiz-Irastorza G,Danza A,Khamashta M.Glucocorticoid use and abuse in SLE[J].Rheumatology(Oxford),2012,51(7):1145-1153.
[5]Tselios K,Koumaras C,Gladman D D,et al.Dyslipidemia in systemic lupus erythematosus:just another comorbidity[J].Semin Arthritis Rheum,2016,45(5):604-610.
[6]Al Gadban M M,Alwan M M,Smith K J,et al.Accelerated vascular disease in systemic lupus erythematosus:role of macrophage[J].Clin Immunol,2015,57(2):133-144.
[7]李丽丽,王翔鹏,向阳.狼疮性肾炎病因病机探析[J].风湿病与关节炎,2017,6(11):58-60.LI Lili,WANG Xiangpeng,XIANG Yang.Etiology and pathogenesis of lupus nephritis[J].Rheumatism and Arthritis,2017,6(11):58-60.
[8]孙铭鸿,张艳,肖阳,等.冠心病不同类型与中医病机辨证的关系[J].中西医结合心脑血管病杂志,2017,15(4):507-508.SUN Minghong,ZHANG Yan,XIAO Yang,et al.The relationship between different typesofcoronary artery disease and traditionalChinese medicine pathogenesis differentiation[J].Chin J Integr Med Cardio,2017,15(4):507-508.
[9]时莉晓,高铸烨,杨巧宁,等.冠心病主要危险因素与血瘀证的相关性研究[J].中西医结合心脑血管病杂志,2014,12(6):646-648.SHI Lixiao,GAO Zhuye,YANG Qiaoning,et al.Association of main risk factor with blood stasis syndrome in coronary artery disease[J].Chin J Integr Med Cardio,2014,12(6):646-648.
[10]Qiao Y,Zhang P J,Lu X T,et al.Panax notoginseng saponins inhibits atherosclerotic plaque angiogenesis by down-regulating vascular endothelial growth factor and nicotinamide adenine dinucleotide phosphate oxidase subunit 4 expression[J].Chin J Integr Med,2015,21(4):259-265.
[11]Yang X,Xiong X,Wang H,et al.Protective effects of Panax notoginseng saponins on cardiovascular diseases:a comprehensive overview ofexperimentalstudies[J].Evid Based Complement Alternat Med,2014,2014:204840.
[12]Liu Y,HaoF,ZhangH,etal.Panaxnotoginseng saponins promote endothelial progenitor cell mobilization and attenuate atherosclerotic lesions in apolipoprotein E knockout mice[J].Cell Physiol Biochem,2013,32(4):814-826.
[13]鲁盈,杨汝春,张华琴,等.三七皂苷对系统性红斑狼疮患者外周血淋巴细胞P-糖蛋白及激素效应的影响[J].中华风湿病杂志,2011,15(1):38-41.LU Ying,YANG Ruchun,ZHANG Huaqin,et al.The effects of Panax notoginseng saponins on P-glycoprotein and the function of glucocorticoid in lymphocytes of systemic lupus erythematosus patients[J].Chin J Rheumatol,2011,15(1):38-41.
[14]李跃进,鲁盈.三七皂苷逆转P-gp介导狼疮鼠淋巴细胞激素耐药机制及效应的研究[C]//浙江省医学会肾脏病学分会.2014浙江省肾脏病学术年会论文汇编.杭州:浙江省医学会肾脏病学分会,2014:422.LI Yuejin,LU Ying.Study on the mechanism and effect of Panax notoginseng saponins in reversing P-gp mediated drug resistance of lymphocytic hormone in lupus mice[C]//Branch of Nephrology of Zhejiang Provincial Medical Association.2014 Zhejiang Academy of Nephrology Annual Conference Paper Compilation.Hangzhou:Branch of Nephrology of Zhejiang Provincial Medical Association,2014:422.
[15]林京莲,任泽民,童晔玲,等.SIRT1在P-gp介导的狼疮肾炎小鼠激素耐药中的作用及三七皂苷的干预作用[C]//中国中西医结合学会肾脏疾病专业委员会.2016年中国中西医结合学会肾脏疾病专业委员会学术年会论文摘要汇编.上海:中国中西医结合学会肾脏疾病专业委员会,2016:25.LIN Jinglian,REN Zemin,TONG Yeling,et al.The role of SIRT1 in the hormone resistance of P-gp mediated lupus nephritis mice and the intervention of Panax notoginseng saponins[C]//China of Traditional Chinese and Western Medicine Association of Kidney Disease Committee.Abstract of the Thesis of Compilation of 2016 Annual Conference of China of Traditional Chinese and Western Medicine Association of Kidney Disease Committee.Shanghai:China of Traditional Chinese and Western Medicine Association of Kidney Disease Committee,2016:25.
[16]林京莲,陈宇,童晔玲,等.三七皂苷对激素耐药NZB/WF1狼疮鼠肾损伤和免疫学指标的影响[C]//中国中西医结合学会肾脏疾病专业委员会.2016年中国中西医结合学会肾脏疾病专业委员会学术年会论文摘要汇编.上海:中国中西医结合学会肾脏疾病专业委员会,2016:36.LIN Jinglian,CHEN Yu,TONG Yeling,et al.Effect of Panax notoginseng saponins on renal injury and immunological indexes of steroid resistant NZB/WF1 lupus mice[C]//China of Traditional Chinese and Western Medicine Association of Kidney Disease Committee.Abstract of the ThesisofCompilation of2016 AnnualConference of China of Traditional Chinese and Western Medicine Association of Kidney Disease Committee.Shanghai:China of Traditional Chinese and Western Medicine Association of Kidney Disease Committee,2016:36.
[17]王莹,褚扬,李伟,等.三七中皂苷成分及其药理作用的研究进展[J].中草药,2015,46(9):1381-1392.WANG Ying,CHU Yang,LI Wei,et al.Advances in the study ofsaponin and pharmacologicaleffectsin pseudo-ginseng[J].Journal of Chinese herbal medicine,2015,46(9):1381-1392.
[18]乔春玲,丁艳芬,杨崇仁.三七总皂苷药理研究进展[J].中国现代中药,2012,14(11):25-30.QIAO Chunling,DING Yanfen,YANG Chongren.Pharmacological research progress of Panax notoginseng saponin[J].Journal of Modern Chinese Medicine,2012,14(11):25-30.
[19]Hsu W H,Lee B H,Hsu Y W,et al.Inhibition of Th2 cytokine production in T cells by monascin via PPAR-γ activation[J].J Agri Food Chem,2013,61(34):8126-8133.
[20]Bajaj M,Suraamornkul S,Hardies L J,et al.Effects of peroxisome proliferator-activated receptor(PPAR)-α and PPAR-γ agonists on glucose and lipid metabolism in patients with type 2 diabetes mellitus[J].Diabetologia,2007,50(8):1723-1731.
[21]Thomas A W,Davies N A,Moir H,et al.Exercise-associated generation of PPARγ ligands activates PPARγ signaling events and upregulates genes related to lipid metabolism[J].J Appl Physiol,2012,112(5):806-815.
[22]Chang H C,Guarente L.SIRT1 and other sirtuins in metabolism[J].Trends Endocrinol Metab,2014 ,25(3):138-145.
[23]Hwang J S,Lee W J,Kang E S,et al.Ligand-activated peroxisome proliferator-activated receptor-δ and-γ inhibit lipopolysaccharide-primed release of high mobility group box 1 through upregulation of SIRT1[J].Cell Death Dis,2014,5(10):e1432.
[24]Han L,Zhou R,Niu J,et al.SIRT1 is regulated by a PPARγ-SIRT1 negative feedback loop associated with senescence[J].Nucleic Acids Res,2010,38(21):7458-7471.
[25]Imai S,Yoshino J.The importance of NAMPT/NAD/SIRT1 in the systemic regulation of metabolism and ageing[J].Diabetes Obes Metab,2013 ,15(Suppl 3):26-33.
[26]Uribarri J,Cai W,Pyzik R,et al.Suppression of native defense mechanisms,SIRT1 and PPARγ,by dietary glycoxidants precedes disease in adult humans;relevance to lifestyle-engendered chronic diseases[J].Amino Acids,2014,46(2):301-309.
[27]阮小贞,陶怡.狼疮肾炎患者血脂水平的研究探讨[J].热带医学杂志,2014,14(6):737-740.RUAN Xiaozhen,TAO Yi.Study on the level of blood lipid in patients with lupus nephritis[J].Journal of Tropical Medicine,2014,14(6):737-740.
[28]Xie Q B,Liang Y,Yang M,et al.DEPTOR-mTOR signaling is critical for lipid metabolism and inflammation homeostasis of lymphocytes in human PBMC culture[J].J Immunol Res,2017,2017:5252840.
[29]高雅楠.Gly14-Humanin对β细胞凋亡的保护作用及对糖代谢和脂代谢的相关调控作用[D].长春:吉林大学,2015:27-29.GAO Yanan.The protective effect of Gly14-Humanin on the apoptosis of beta cells and the related regulation of glucose metabolism and lipid metabolism[D].Changchun:Jilin University,2015:27-29.
[30]Zhao G J,Yin K,Fu Y C,et al.The interaction of ApoA-I and ABCA1 triggers signal transduction pathways to mediate efflux of cellular lipids[J].Mol Med,2012,18(1):149-158.
[31]路倩,陈五军,尹凯,等.动脉粥样硬化中胆固醇外流的研究进展[J].生物化学与生物物理进展,2011,39(4):319-326.LU Qian,CHEN Wujun,YIN Kai,etal.Research progress on cholesterol efflux in atherosclerosis[J].Prog Biochem Biophys,2011,39(4):319-326.
[32]Chang Y C,Lee T S,Chiang A N.Quercetin enhances ABCA1 expression and cholesterol efflux through a p38-dependent pathway in macrophages[J].J Lipid Res,2012,53(9):1840-1850.
——一道江苏高考题的奥秘解读和拓展

