Ⅱ型人回肠脂肪酸结合蛋白对人结肠癌细胞系HCT116增殖、迁移的影响及其机制
张姗姗,张永盟,袁明,赵卫星,鲍永华,杨万才
(1新乡医学院基础医学院,河南新乡453003;2济宁医学院精准医学研究院)
近年来,结直肠癌的发病率逐年升高。人回肠脂肪酸结合蛋白(FABP6)的mRNA有三种转录本(transcript 1、2、3),表达两种同工型蛋白,转录本1和3表达I型(isoform 1)蛋白,转录本2表达II型(isoform 2)蛋白。I型蛋白在肽链的N端较2型蛋白多49个氨基酸,因此,表达I型的基因又被称为IBABP-L[1]。早期研究[2]并未区分两种同工型蛋白,认为Ⅱ型FABP6高表达于结直肠癌组织中,与结肠癌的发生、发展有关。后续研究[1]证明在结直肠癌中显著高表达的是I型 FABP6蛋白,并非II型FABP6蛋白,Ⅰ型FABP6可通过调控NF-κB通路参与结直肠癌的发生、发展。Ⅱ型FABP6可调控FXR受体参与胆汁酸的转运、吸收和肝肠循环[3,4]。但Ⅱ型FABP6蛋白在结肠癌发生、发展中的具体作用机制目前并不清楚。我们观察了Ⅱ型人回肠脂肪酸结合蛋白(FABP6)对人结直肠癌细胞系HCT116增殖和迁移的影响,并对其作用机制进行了探讨。
1 材料与方法
1.1 细胞、试剂及仪器 HCT116(中国医学科学院肿瘤医院肿瘤研究所);FABP6 transcript2 引物(上海生工生物工程有限公司合成);DH-5α感受态(Takara公司);pEGFP-N1载体;BCA 蛋白定量试剂盒(上海碧云天生物技术有限公司);CCK8试剂盒(上海碧云天生物技术有限公司);Transwell小室(Corning公司);琼脂糖胶回收试剂盒(上海生工生物工程有限公司合成);DNA提取试剂盒(Omega公司);FABP6 抗体(Abcam 公司);STAT3抗体、p-STAT3抗体、AKT抗体(Proteintech公司);CyclinD1抗体(Abcam公司);p-CyclinD1抗体(Abcam公司)E-cadherin抗体(Abcam公司);N-cadherin抗体(Abcam公司);GAPDH抗体(Abcam);HRP标记山羊抗兔IgG、HRP标记山羊抗鼠IgG (上海碧云天生物技术有限公司)。
1.2 Ⅱ型FABP6过表达质粒pEGFP-FABP6构建 利用Primer 5软件设计能够特异性扩增FABP6-Ⅱ型转录本的引物,并经过BLAST比对,由上海生工生物工程有限公司合成,引物如下:FABP6基因(NM_001445)(上游引物:5′-ATGGCTTTCACCGGCAAGT-3′;下游引物:5′-GAGGCCAGTCTCTTGCT-3′),片段大小386 bp,限制性核酸内切酶EcoR1/BamH1。培养HCT116细胞,用TRIzol提取细胞总RNA,按照反转录说明书将RNA反转录成cDNA,以cDNA为模板,用上述引物进行扩增,琼脂糖凝胶电泳后进行胶回收,将回收片段和带有荧光标记的空载体pEGFP-N1用限制性核酸内切酶EcoR1/BamH1进行双酶切,两者酶切后的产物经T4 DNA连接酶37 ℃连接,连接后的产物即为带有荧光标记的Ⅱ型FABP6过表达质粒即pEGFP-FABP6,相对应的空载体作为对照质粒即pEGFP-N1。分别将两种质粒转化到宿主细胞DH-5α中进行扩增,按照DH-5α说明书操作,然后用DNA提取试剂盒进行质粒提取。过表达质粒pEGFP-FABP6经上海生工测序鉴定,与Ⅱ型FABP6基因碱基序列比对之后,结果正确。
1.3 细胞分组及pEGFP-FABP6转染 用RPMI1640培养基培养HCT116细胞,培养条件:37 ℃、5% CO2,培养箱相对湿度95%。选择处于对数生长期的细胞用于实验,细胞传代时用0.25%胰酶消化,均匀的接种到6孔板和96孔板中,备用。将细胞随机分为实验组和对照组,用Lipofectamine3000 转染试剂分别转染pEGFP-FABP6、pEGFP-N1。所有操作均严格按照Lipofectamine 3000转染试剂说明书进行。利用倒置荧光显微镜观察荧光蛋白GFP的表达,转染效率在80%左右,证明转染成功。
1.4 细胞增殖情况观察 采用CCK-8法。取两组细胞,种植于96孔板中,5 000/孔,每组5个复孔。分别于转染0、24 、48 h每孔加入10 μL CCK-8溶液,孵育2 h,用紫外分光光度计测定在450 nm处的吸光度OD值。以OD值代表细胞的增殖情况。实验重复3次,取平均值。
1.5 细胞迁移情况观察 采用Transwell实验。转染12 h取两组细胞,胰酶消化后收集细胞,各取2万个细胞铺到小室中,上室中加入200 μL无血清培养基,24孔板下室中加入600 μL含10%胎牛血清的培养基。继续培养24 h取出小室,4%多聚甲醛固定30 min,DAPI染色30 min,PBS清洗3遍,用棉棒将小室内的细胞擦拭干净,倒置显微镜下随机选取10个视野拍照,测算两组穿膜细胞数。实验重复3次,取平均值。
1.6 两组细胞STAT3、p-STAT3、AKT、CyclinD1、p-CyclinD1、N-cadherin、E-cadherin蛋白检测 采用Western blotting法。转染48 h取两组细胞,RIPA细胞裂解液裂解细胞,14 000 g/min离心20 min,吸取上清,BCA法测定蛋白浓度。统一浓度后加入蛋白上样缓冲液,煮沸10 min。所有操作均严格按照使用说明书进行。ECL显影剂显影,拍照。采用Image J 软件进行条带灰度处理,以目的蛋白灰度值与内参蛋白灰度值之比表示目的蛋白的相对表达量。

2 结果
2.1 两组细胞OD值比较 转染0、24 、48 h两组细胞OD值比较见表1。
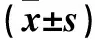
表1 不同转染时间两组细胞OD值比较
注:与对照组相比,*P<0.05。
2.2 两组穿膜细胞数比较 转染36 h时后观察组和对照组穿膜细胞数分别为(30.0±5.0)、(64.7±10.0 )个,二者比较,P<0.05。
2.3 两组细胞STAT3、p-STAT3、AKT、CyclinD1、p-CyclinD1、N-cadherin、E-cadherin蛋白相对表达量比较 见表2。

表2 两组细胞STAT3、p-STAT3、AKT、CyclinD1、p-CyclinD1、N-cadherin、E-cadherin蛋白相对表达量比较
注:与对照组比较,*P<0.05。
3 讨论
研究[5,6]发现,结直肠癌的发生跟胆汁酸特别是次级胆汁酸有关,胆汁酸的增多可以使正常肠道黏膜上皮损伤、凋亡,进而发生基因突变,导致结直肠癌的发生,而FABP6参与胆汁酸的转运、消化、吸收和肝肠循环。已有研究[1]证明,FABP6在结直肠癌中表达显著升高,但只是其中的Ⅰ型FABP6上调,才导致总FABP6升高,而Ⅱ型FABP6在结肠癌中的表达并未升高,因此猜测Ⅱ型FABP6是否另有作用。
Ⅱ型FABP6受FXR途径调控,FXR与Ⅱ型FABP6协同调节肠道胆汁酸的平衡。FXR 的激活可以上调Ⅱ型FABP6 的表达[7],Ⅱ型FABP6与胆汁酸结合,有助于胆汁酸的肝肠循环,从而降低胆汁酸在肠道的浓度以抑制其对肠道上皮细胞的毒性。已有研究[8,9]证明,FXR在结肠癌中低表达,并且抑制结肠癌细胞的生长。因此猜测Ⅱ型FABP6是否也有抑制结肠癌发生发展的作用。
众所周知,许多肿瘤的发生发展是由慢性炎症介导的,慢性结肠炎亦是结肠癌发生发展的关键,而STAT3则是介导结肠炎和结肠癌及炎症与炎症之间最重要的关键点,许多的炎症因子、信号分子及其他的信号通路都能够激活STAT3信号通路,STAT3能够促进肿瘤细胞的增殖,抑制肿瘤细胞的凋亡,促进肿瘤的侵袭和转移[10],本研究发现Ⅱ型FABP6能够抑制STAT3的活化。AKT是大多数组织中表达的一种常见致癌基因[11],PI3K/AKT信号途径是与癌症发展和进展相关的最常见的失调信号传导途径之一[12~15]。已有研究[16]证明,AKT信号途径的活化可以促进结肠癌细胞的增殖和转移,并抑制结肠癌细胞的凋亡,而在本研究中发现在结肠癌细胞中Ⅱ型FABP6能够下调AKT的表达。
E-cadherin的低表达或者不表达和N-cadherin的异常表达是很多恶性肿瘤发生转移的关键因素[17]。在结肠癌中,随着肿瘤恶性程度的发展,E-cadherin逐渐向N-cadherin转化,当新的转移灶形成后,E-Cadherin再次表达[18,19]。本研究发现,观察组E-cadherin蛋白表达增加,N-cadherin蛋白表达减少,提示Ⅱ型FABP6蛋白能够通过影响上皮间质转化的途径而促进结肠癌的转移。该结果提示,Ⅱ型FABP6蛋白能够抑制结肠癌细胞的增殖,其可能的机制是通过调节STAT3/AKT信号通路,还可能通过EMT途径影响结肠癌的迁移和转移,然而其影响上述蛋白的表达是由其自身调控还是通过和其他转录因子形成复合物发挥作用尚不清楚。胆汁酸特别是次级胆汁酸能够诱导大肠癌的发生发展,已经是大肠癌发生的一个高危因素[20],而FABP6蛋白是肠道内唯一能够直接结合胆汁酸而参与胆汁酸代谢的蛋白,其研究有望能够为临床上胆汁酸所诱导的大肠癌提供早起诊断和治疗的途径。
综上所述,Ⅱ型FABP6可抑制结肠癌细胞的增殖、迁移,可能与其抑制STAT3、p-STAT3、AKT、CyclinD1、p-CyclinD1、N-cadherin表达,促进E-cadherin蛋白表达有关。
参考文献:
[1] Fang C, Dean J, Smith JW. A novel variant of ileal bile acid binding protein is up-regulated through nuclear factor-kappaB activation in colorectal adenocarcinoma.[J]. Cancer Re, 2007, 67(19):9039-9046.
[2] Ohmachi T, Inoue H, Mimori K, et al. Fatty Acid Binding Protein 6 Is Overexpressed in Colorectal Cancer[J]. Clinic Cancer Res, 2006, 12(17):5090-5095.
[3] Dermadi D, Valo S, Ollila S, et al. Western diet deregulates bile acid homeostasis, cell proliferation, and tumorigenesis in colon[J]. Cancer Res, 2017, 77(12):3352-3363.
[4] 陈雪, 曹海龙, 王斯南,等. 高脂饮食促进结直肠癌发生机制的研究进展[J]. 肿瘤药学, 2016, 6(1):11-14.
[5] 李雪. 脱氧胆酸在大肠癌形成过程中的作用[J]. 重庆医学, 2017, 46(22):3141-3144.
[6] Gadaleta RM,Garcia-Irigoyen O.Bile acids and colon cancer: Is FXR the solution of the conundrum?[J]. Mol Aspects Med,2017,56:66-74.
[7] 李烁, 张志文, 管又飞. 胆汁酸受体FXR 的研究进展[J]. 生理科学进展, 2003, 34(4):314-318.
[8] 朱松明, 张超峰, 张捷,等. 法尼酯X受体的激活抑制结肠癌细胞生长[J]. 中国普外基础与临床杂志, 2014(7):827-831.
[9] 张捷, 张超峰, 龚庆豪,等. DCA对FXR的作用及结肠癌细胞生物学行为的影响[J]. 结直肠肛门外科, 2016(2):199-202.
[10] 侯嘉杰, 孙倍成. STAT3:慢性炎症介导肿瘤发生和进展的关键节点[J]. 生物化学与生物物理进展, 2014, 41(1):69-78.
[11] M Michael C. The AKT genes and their roles in various disorders[J]. Am J Med Genet A, 2013, 161(12):2931-2937.
[12] Bao Y, Kai L, Guo Y, et al. Tumor suppressor PRSS8 targets Sphk1/S1P/Stat3/Akt signaling in colorectal cancer[J]. Oncotarget, 2016, 7(18):26780-26792.
[13] Santhoshkumar S, Min Sook Ryu, In Kyoung Lim. B-cell translocation gene 2 mediates crosstalk between PI3K/Akt1 and NFκB pathways which enhances transcription of MnSOD by accelerating IκBα degradation in normal and cancer cells[J].Cell Commun Signal, 2013,11(1):1-14.
[14] 倪嘉延, 吴裕丹, 许林锋,等. HIF-1α基因表达沉默对肝癌细胞PI3K/AKT信号转导通路影响的研究[J]. 中华肿瘤防治杂志, 2014, 21(5):356-359.
[15] Liang J, Nagahashi M, Kim EY, et al. Sphingosine-1-phosphate links persistent STAT3 activation, chronic intestinal inflammation, and development of colitis-associated cancer.[J]. Cancer Cell, 2013,23(1):107-120.
[16] 曹涤非, 吴琼, 姜洋,等. PI3K/Akt通路在结肠癌中的研究进展[J]. 黑龙江科学, 2015,5(8):26-27.
[17] Song W, Mazzieri R, Yang T, et al. Translational Significance for Tumor Metastasis of Tumor-Associated Macrophages and Epithelial esenchymal Transition[J]. Front Immunol, 2017,37(8):1106.
[18] Guo C,Ma J, Deng G, et al. ZEB1 Promotes Oxaliplatin Resistance through the Induction of Epithelial - Mesenchymal Transition in Colon Cancer Cells[J]. J Cancer, 2017,8(17):3555-3566.
[19] 李竹林, 王振军, 赵博,等. 结直肠癌细胞外基质与癌细胞上皮-间质转化和分期的相关性[J]. 中华肿瘤防治杂志, 2016, 23(16):1076-1080.
[20] 李慧娟, 关景明, 王仙琦,等. 脱氧胆酸诱导大肠癌发生的研究[J]. 胃肠病学和肝病学杂志, 2014, 23(1):5-8.

