表没食子儿茶素没食子酸酯对乙肝病毒复制的体外抑制作用及其机制
吴绍凤,郑荣荣,司凤磊,刘宏博,郭文聪,李宁,侯琳
(1青岛大学基础医学院,山东青岛266021;2青岛大学附属医院)
乙型肝炎病毒(HBV)感染可引起急、慢性肝炎和重型肝炎,我国是HBV感染大国。目前临床上主要采用 α 干扰素 (IFN-α)和核苷类似物进行抗病毒治疗[1],核苷类药物的耐药性和 IFN-α 的无应答一直是当前抗病毒治疗的局限所在。寻找干预 HBV 感染和复制的新靶点和新方法,最大限度的抑制 HBV 复制,对阻止乙肝进程及并发症的发生具有重要意义。绿茶的主要功能成分是茶多酚,以黄烷醇和黄酮醇为主。儿茶素是绿茶中黄酮类的主要成分,其中以表没食子儿茶素没食子酸酯(EGCG)含量最多[2]。研究[3]表明EGCG具有抗肿瘤细胞增殖、抗细胞氧化、诱导细胞凋亡、抗菌等作用,且具有神经保护作用。最新研究[4]发现,EGCG还具有抗病毒活性,如能抗流感病毒、HIV病毒、EB病毒、腺病毒等。EGCG在体外可抑制乙肝病毒复制[5],但其具体作用机制却鲜有报道。2016年10月~2017年7月,我们以HepG2.2.15细胞为模型,观察了EGCG对HBV复制的体外抑制作用,并探讨其作用机制。
1 材料与方法
1.1 细胞、EGCG、试剂及仪器 HepG2.2.15细胞系购自iCell生物公司。HepG2.2.15细胞给予含15%胎牛血清(Gibco公司)的MEM(Gibco公司)培养基,置于5%的CO2、37 ℃饱和湿度的培养箱中培养。EGCG(南通飞宇生物科技有限公司),根据我们前期细胞毒性实验结果,80 μmol/L以下EGCG对HepG2.2.15细胞的细胞毒性较小,因此,我们选择40、80 μmol/L进行后续实验。
0.02%胰蛋白酶消化液(碧云天生物有限公司);MTT试剂盒(索莱宝生物公司);青链霉素混合液(碧云天生物有限公司);反转录试剂盒(Takara公司);实时定量PCR试剂盒(北京全式金生物有限公司);HBV抗原检测ELISA试剂盒(上海科华生物工程股份有限公司);自噬抑制剂(氯喹CQ、3-MA、Rapamycin)和兔抗LC3多克隆抗体(Sigma公司);鼠抗β-actin、p62多克隆抗体(SantaCruz公司);聚偏二氟乙烯(PVDF)膜(Millipore公司);BCA蛋白试剂盒和Protein marker(ThermoFisher公司);6xProtein loading buffer(北京全式金生物有限公司)。垂直电泳仪、湿法转膜仪(Bio-Rad公司);牛血清白蛋白(BSA)(索莱宝生物有限公司)。
1.2 EGCG对乙肝病毒抗原、DNA的影响观察
1.2.1 HepG2.2.15细胞分组及EGCG干预方法 取对数生长期HepG2.2.15细胞接种于12孔板,将细胞分为样本(A、B组)及对照组,每组5个复孔。A组、B组分别加入终浓度为40和80 μmol/L的EGCG,对照组不做任何处理。
1.2.2 各组乙肝病毒抗原检测 培养24 h后收集细胞上清,用PBS稀释10倍,按照ELISA试剂盒说明书进行乙肝病毒e抗原和s抗原的检测。分别置于酶标仪490、630 nm波长处检测各孔的光密度OD值,按照公式计算乙肝病毒e抗原和s抗原的相对表达量。抗原相对量=[样本(OD490-OD630)/空白(OD490-OD630)]×100%。
1.2.3 各组乙肝病毒DNA检测 采用real-time PCR法。培养24 h后收集细胞上清,用Takara公司的迷你病毒DNA提取试剂盒提取上清中病毒DNA。用预冷的PBS洗两遍,裂解液(50 mmol/L Tris-HCl,PH 7.4,1 mmol/LEDTA,1%NP-40)4 ℃旋转裂解15 min,14 000 g离心1 min,取上清,再用细胞DNA提取试剂盒按说明书提取细胞质中乙肝病毒DNA,将提取好的病毒DNA进行荧光定量PCR[6]。细胞总RNA的提取,将同组细胞按照TRIzol试剂盒说明书提取总RNA,取1 μg总DNA反转录为cDNA,对内参基因GAPDH进行real-time PCR相对定量。荧光定量PCR反应条件为94 ℃、30 s,94 ℃、5 s,60 ℃、30 s,40个循环数。荧光定量PCR的引物序列为乙肝病毒上游引物序列5′-TCTCTGCAATGTCAACGACC-3′,下游引物5′-CAGACCAATTTATGCCTACAGC -3′;GAPDH上游引物序列5′-GGAGCCAAAAGGGTCATCATCT -3′,下游引物5′-AGGGGCCATCCACAGTCTTCT-3′。细胞内、细胞外乙肝病毒DNA的相对表达量以2-ΔΔCt表示。
1.3 EGCG对自噬标记蛋白LC3-Ⅱ/LC3-Ⅰ、自噬降解相关蛋白p62/β-actin的影响观察 采用Western blotting法。取对数生长期HepG2.2.15细胞接种于6 cm培养皿中,将细胞分为1、2、3、4。1、2组分别加入终浓度为40和80 μmol/L的EGCG,C组加入200 nmol/L的Rapamycin,4组不做任何处理。培养24 h收集各组细胞,BCA法测蛋白浓度。20 μg上样,SDS-PAGE电泳,湿转法转膜,BSA室温封闭2 h,加入p62、β-actin、LC3一抗(p62 1∶500;β-actin 1∶1 000;LC3 1∶2 500)4 ℃孵育过夜,TBST洗膜3次,10 min/次,二抗室温孵育2 h,TBST洗膜3次,10 min/次,ECL发光液显色,放入成像系统显影并拍照。对自噬标记蛋白LC3和p62以及内参蛋白β-actin的条带进行扫描, 凝胶图象分析各条带的光密度值。自噬标记蛋白LC3有两个条带:游离形式的 LC3-Ⅰ和膜结合形式的LC3-Ⅰ,常将LC3-Ⅱ与LC3-Ⅰ条带的光密度比值LC3-Ⅱ/Ⅰ作为自噬发生的指标,其比值越大代表自噬越强;p62与β-actin条带的光密度比值p62/β-actin作为自噬降解的指标,其比值越小代表自噬越强。
1.4 抑制自噬后EGCG对乙肝病毒乙肝病毒抗原、DNA的影响观察 取对数生长期HepG2.2.15细胞接种于12孔板,将细胞分为空白组、对照组、自噬抑制组(又分为3-MA组和CQ组)。其中,对照组、3-MA组、CQ组又各自分为2组。对照组分别加入终浓度为40和80 μmol/L的EGCG处理。3-MA组和CQ组分别先用终浓度为10 mmol/L的3-MA和50 μmol/L的CQ预处理3 h抑制自噬后,再分别加入终浓度为40和80 μmol/L的EGCG。空白组不作任何处理。培养24 h收集细胞上清,检测各组乙肝病毒e抗原、s抗原和乙肝病毒DNA。方法同“1.2”。

2 结果
2.1 EGCG对乙肝病毒e抗原、s抗原的影响比较 见表1。
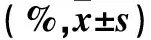
表1 培养24 h时A、B组e抗原、s抗原的相对量
注:与对照组比较,#P<0.01。
2.2 EGCG对乙肝病毒DNA的影响比较 见表2。
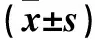
表2 A、B组细胞内、外乙肝病毒DNA的相对表达量
注:与对照组比较,#P<0.01。
2.3 EGCG对自噬标记蛋白LC3-Ⅱ/LC3-Ⅰ、自噬降解相关蛋白p62/β-actin的影响比较 见表3。

表3 各组细胞p62/β-actin、LC3-Ⅱ/Ⅰ相对表达量比较
注:与4组比较,#P<0.01;与1组比较,*P<0.01。
2.4 抑制自噬后 EGCG对乙肝病毒e抗原、s抗原及DNA的影响 见表4。
3 讨论
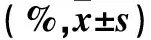
表4 抑制自噬后各组乙肝病毒e抗原、s抗原相对量及DNA相对表达量比较
注:与对照组同浓度比较,#P<0.05。
EGCG由于其抗癌、抗氧化、抗菌、抗病毒等优点,研究[4~6]发现,在恒河猴肾细胞中,EGCG可干扰病毒黏附从而抑制轮状病毒和肠病毒;EGCG可通过与病毒的表面蛋白相互作用抑制单纯疱疹病毒黏附到硫酸乙酰肝素,发挥直接破坏作用,使病毒失活。此外,研究[7]表明,EGCG对肝炎病毒也有抑制作用,包括HCV和HBV。多项研究[8]表明,EGCG可阻止HCV进入细胞,但对病毒复制、RNA合成和病毒颗粒分泌无影响。目前,EGCG对HBV的作用研究较少。本研究表明EGCG能有效抑制HBV复制,降低e抗原和表面抗原的分泌,抑制HBV DNA的表达,且其抑制率与药物浓度成量效关系。
自噬是真核生物进化过程中高度保守的一类降解途径,通过形成双层膜的自噬体,将蛋白质等生物大分子或细胞器(线粒体等)回收至溶酶体将其降解为氨基酸、单糖等小分子,实现循环再利用[9~11]。自噬的具体过程包括:起始、延伸、膜闭合、成熟和细胞内容物的降解。自噬体的膜延长需要两类泛素结合蛋白:ATG12- ATG5-ATG16L1复合物和LC3蛋白[12]。LC3存在于哺乳动物细胞中,与酵母的自噬基因Atg8同源,它有游离形式的LC3-Ⅰ和膜结合形式的LC3-Ⅱ两种形式。LC3单体的C端剪切加工后产生LC3-Ⅰ,而后与磷脂酰乙醇胺结合脂化,形成LC3-Ⅱ,被整合到自噬体的内外膜上,外膜上的LC3在自噬体与溶酶体融合后脱落,因此LC3常作为检测自噬的指标。另外,p62蛋白是监测自噬水平的另一指标,一方面它靶向泛素化的细胞器和一些异常蛋白,另一方面它与自噬体内膜的LC3蛋白相互作用,将这些异常细胞器和蛋白包裹进自噬体最终送至溶酶体降解,同时p62也一并被降解,它是自噬降解的特征性底物,其累积量与自噬水平相反。研究发现,细胞受到致病微生物感染时,自噬起到一定的防御作用[13~15]。Lee等[16,17]以人神经母细胞瘤SH-SY5Y为研究对象,发现EGCG可通过诱导Sirt1激活自噬对人朊蛋白诱导的神经细胞毒性发挥保护性作用。此外,EGCG在原发性渗出性淋巴瘤细胞中可抑制人疱疹病毒的复制,并诱导凋亡和自噬的产生[18,19]。Zhong等[20]研究发现,EGCG能够通过增强溶酶体酸性加强自噬从而抑制乙肝病毒的复制。因此,诱导肝细胞自噬可能成为治疗乙肝病毒感染的一种潜在途径。我们的研究发现EGCG能够激活HepG2.2.15细胞的自噬通量,使LC3Ⅱ/Ⅰ的表达增加,p62蛋白的表达降低,以上这些结果与Zhong等[20]研究一致,我们推测EGCG可能通过激活自噬发挥抗乙肝病毒作用。
为进一步探讨EGCG抑制乙肝病毒复制的机制,我们将EGCG分别与自噬抑制剂3-MA和氯喹联合处理HepG2.2.15细胞再检测其对乙肝病毒复制的抑制作用。3-MA主要通过作用于PI3KC-Ⅲ来干扰自噬的启始过程[21~23]。氯喹则是通过干扰溶酶体酸化来抑制自噬通量膜转运和底物降解[24,25]。研究发现,EGCG联用自噬抑制剂干预后,HepG2.2.15细胞外的HBV DNA的水平较EGCG单处理组明显升高,HBV表面抗原和e抗原的分泌也均有明显升高,但相比于空白组仍有降低,说明EGCG对HBV复制的抑制作用明显减弱,且该抑制作用部分依赖于自噬途径,同时也说明EGCG可能还通过其他途径抑制HBV复制,EGCG还通过哪些机制抑制HBV以及如何引发细胞自噬发挥抗乙肝病毒作用,仍需进一步探讨。
参考文献:
[1] Alonso S, Guerra AR, Carreira L,et al. Upcoming pharmacological developments in chronic hepatitis B: can we glimpse a cure on the horizon[J]. BMC Gastroenterol, 2017,17(1):168.
[2] Rameshrad M, Razavi BM, Hosseinzadeh H, et al. Protective effects of green tea and its main constituents against natural and chemical toxins:A comprehensive review[J].Food and Chemical Toxicol, 2017,100:115-137.
[3] Chakrawarti L, Agrawal R, Dang S, et al. Therapeutic effects of EGCG: a patent review[J]. Expert Opin Ther Pat, 2016, 26(8):907-916.
[4] Xu J, Xu Z, Zheng W,et al. A Review of the Antiviral Role of Green Tea Catechins[J]. Mol, 2017,22(8) :1337.
[5] 葛建,林芳,李明揆,等.表没食子儿茶素没食子酸酯(EGCG)生物活性研究进展[J].安徽农业大学学报,2011,38(2):156-163.
[6] 刘帅华,李春英,李朝,等. EGCG及其衍生物的病毒作用研究进展[J].黑龙江医药,2013,26(1):31-33.
[7] Huang HC, Tao MH, Hung TM, et al. (-)-Epigallocatechin-3-gallate inhibits entry of hepatitis B virus into hepatocytes[J]. Antiviral Res, 2014,111:100-111.
[8] Li N, Zhang L, Chen L, et al. MxA inhibits hepatitis B virus replication by interaction with hepatitis B core antigen [J]. Hepatology, 2012,56(3):803-811.
[9] Pavel M, Rubinsztein DC. Mammalian autophagy and the plasma membrane[J]. Febs J, 2017,284(5):672-679.
[10]余琳娜,柳唯意,马岚青.TFEB与非酒精性脂肪肝关系的研究进展[J].山东医药,2016,56(42):93-97.
[11]Damjana R.From Nonalcoholic fatty liver disease to hepatocellular carcinoma: a systems understanding[J] . Dig Dis Sci, 2014, 59(2):238-241.
[12] Gallagher LE, Williamson LE, Chan EY, et al. Advances in Autophagy Regulatory Mechanisms[J]. Cells, 2016,5(2):24.
[13] Liu B, Fang M, Hu Y, et al. Hepatitis B virus X protein inhibits autophagic degradation by impairing lysosomal maturation[J]. Autophagy, 2014,10(3):1-15.
[14] Tang CM, Yau TO, Yu J,et al. Management of chronic hepatitis B infection: current treatment guidelines, challenges, and new developments[J]. World J Gas,2014, 20(20):6262-6278.
[15] 郭海清,陈亚利,段钟平,等.细胞自噬与肝脏疾病[J].山东医药,2014,54(38):103-106.
[16] Lee JH, Moon JH, Kim SW, et al. EGCG-mediated autophagy flux has a neuroprotection effect via a class III histone deacetylase in primary neuron cells[J]. Oncotarget, 2015,6(12): 9701-9717.
[17]李春凤,孙瑶,简洁,等.表没食子儿茶素没食子酸酯调控自噬抗心肌缺血再灌注损伤[J].中国新药与临床杂志,2015,34(6):471-475.
[18] Tsai CY, Chen CY, Chiou YH, et al. Epigallocatechin-3-Gallate Suppresses Human Herpesvirus 8 Replication and Induces ROS Leading to Apoptosis and Autophagy in Primary Effusion Lymphoma Cells[J]. Int J Mol Sci, 2018,19(1):16.
[19]秦婧,洪莉.表没食子儿茶素没食子酸酯对人宫颈癌细胞系HeLa细胞凋亡及bcl-2/bax表达的影响[J].中国医药导报,2014,11(24):25-28.
[20] Zhong L, Hu J, Shu W, et al. Epigallocatechin-3-gallate opposes HBV-induced incomplete autophagy by enhancing lysosomal acidification, which is unfavorable for HBV replication[J]. Cell Death Dis, 2015,6:e1770.
[21] Liu F, Gao S, Yang Y, et al. Curcumin induced autophagy anticancer effects on human lung adenocarcinoma cell line A549[J]. Oncol Lett, 2017,14(3):2775-2782.
[22] 朱斐,王徵.细胞自噬与病毒复制[J].中国细胞生物学学报,2014,36(5):691-697.
[23] 伍思霖,黄玉莹,丁海林,等.自噬、自噬性细胞死亡与肿瘤的研究进展[J].生命科学,2017,28(8):769-772.
[24] Gallagher LE, Radhi OA, Abdullah MO, et al. Lysosomotropism depends on glucose:a chloroquine resistance mechanism[J]. Cell Death Dis, 2017,8(8):3014.
[25]钟漓,赵志.抑制自噬促进贝伐珠单抗对结肠癌细胞的生长抑制和凋亡诱导[J].现代肿瘤医学,2016,25(3):345-351.

