ANGPTL4的表达与肝癌微血管生成的关系
卫银银,吴方雄,闵亚莉,苗向霞,罗正奇,刘凯歌
(西安医学院第一附属医院消化内科,西安 710077;*通讯作者,E-mail:kaigeliu007@163.com)
肝细胞肝癌(hepatocellular carcinoma,HCC)是一种常见的、高发的恶性肿瘤,死亡率高。引起其发生、发展、浸润及转移的主要原因与肝癌新生血管的形成密切相关,而肝脏的双重血供又为这一事件的发生提供了必要的物质基础。人血管生成素样蛋白4(angiopoietin like 4,ANGPTL4)属于血管生成素样蛋白家族一员,它与肿瘤的生长、转移和血管生成密切相关[1]。而有关ANGPTL4对HCC的转移及血管新生的影响研究甚少。本文旨在通过研究ANGPTL4与新生血管内皮细胞黏附分子CD105在肝癌组织中表达及临床意义,探讨ANGPTL4在肝癌中的发生、转移及新生血管形成中的作用。
1 材料与方法
1.1 一般资料
选取西安医学院第一附属医院及第四军医大学西京医院2014-01~2017-01经手术切除的肝癌组织标本69例,平均年龄57.6(35-78)岁;30例相应癌旁正常肝组织(距肿瘤切缘>5 cm)作为对照组,平均年龄55.1(31-72)岁。所有患者术前均未行化疗、放疗及其他辅助治疗。
1.2 试剂与方法
兔抗人ANGPTL4多克隆抗体(美国Sigma公司)、兔抗人CD105单克隆抗体(美国Sigma公司)。按SABC法常规步骤进行免疫组化,兔抗人ANGPTL4多克隆抗体滴度1 ∶200,兔抗人CD105单克隆抗体滴度1 ∶1 000,以磷酸盐缓冲液作为阴性对照,用已知阳性标本作为阳性对照。
1.3 结果判读
1.3.1 ANGPTL4阳性表达结果判定 每张切片随机选择5个视野,依据每个视野中阳性细胞百分比和染色强弱进行评分:阳性细胞<5%为0分,5%-25%为1分,25%-50%为2分,≥50%为3分。仅对细胞核着蓝色者为阴性,胞膜、胞浆或胞核呈棕黄色者为阳性。0分为阴性,1分为弱阳性,2分为阳性,3分为强阳性。两项之和≤3分为阴性,>3分为阳性。
1.3.2 CD105阳性表达结果判定 微血管密度(microvascular density,MVD)计数参照Weidner方法[2]:先在低倍视野(×10)下选取棕黄色密度最高区域,再于高倍视野(×200)下计数,每张切片记录5个高倍镜视野下微血管数,取其平均值作为该标本的MVD。
1.4 统计学处理
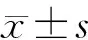
2 结果
2.1 肝癌及正常肝组织中ANGPTL4及CD105阳性表达
ANGPTL4主要表达于肝癌细胞浆中,少数表达于胞核,阳性表现为棕黄色弥漫状或颗粒状(见图1A)。ANGPTL4在肝癌组织、正常肝组织中的阳性表达率分别为56.52%(39/69)、20.00%(6/30),二者比较差异有统计学意义(P<0.05,见表1)。CD105主要表达于血管内皮细胞的胞膜或胞浆,形成条状或环状,呈棕黄色,排列多不规则,在大血管中表达极弱或不表达(见图1C)。在肝癌组织和正常肝组织中MVD分别是(34.82±11.51)个/HP、(15.87±7.52)个/HP,二者比较差异有统计学意义(P<0.05,见表1)。
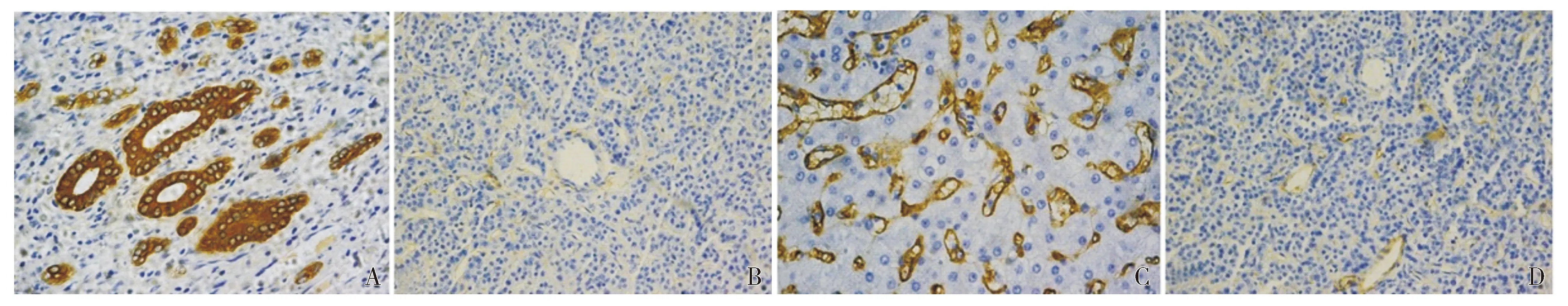
A. ANGPTL4在肝癌组织表达(SABC,×400) B. ANGPTL4在正常肝组织中的表达(SABC,×200) C. CD105在肝癌组织表达(SABC,×400) D. CD105在正常肝组织中的表达(SABC,×200)图1 ANGPTL4、CD105在肝癌组织和正常组织的表达Figure 1 The expression of ANGPTL4 and CD105-MVD in hepatocellular carcinoma and normal hepatocellular tissues
表1肝癌及正常肝组织中ANGPTL4及CD105-MVD阳性表达
Table1TheexpressionofANGPTL4andCD105-MVDinhepatocellularcarcinomaandnormalhepatocellulartissues

组别nANGPTL4[例(%)]MVD(个/HP)阳性χ2Px±stP肝癌组织 6939(56.52)6.3710.01234.82±11.519.3180.001正常肝组织306(20.00)15.87±7.52
2.2 肝癌组织中ANGPTL4阳性表达及CD105表达与临床病理参数的关系
在不同年龄、性别、肿瘤直径和是否有包膜浸润的肝癌患者中,ANGPTL4表达差异无统计学意义(P>0.05);而在是否有门静脉侵袭、淋巴结转移和不同TNM分期的表达差异有统计学意义(P<0.05)。在不同年龄、性别的肝癌患者中CD105的表达差异无统计学意义(P>0.05);在不同肿瘤直径,有无包膜浸润、门静脉侵袭、淋巴结转移和不同TNM分期的表达差异有统计学意义(P<0.05,见表2)。
表2肝癌组织中ANGPTL4及CD105表达与临床病理参数的关系
Table2RelationshipofANGPTL4andCD105expressioninhepatocellularcarcinomatissuewithclinicopathologicalcharacteristics
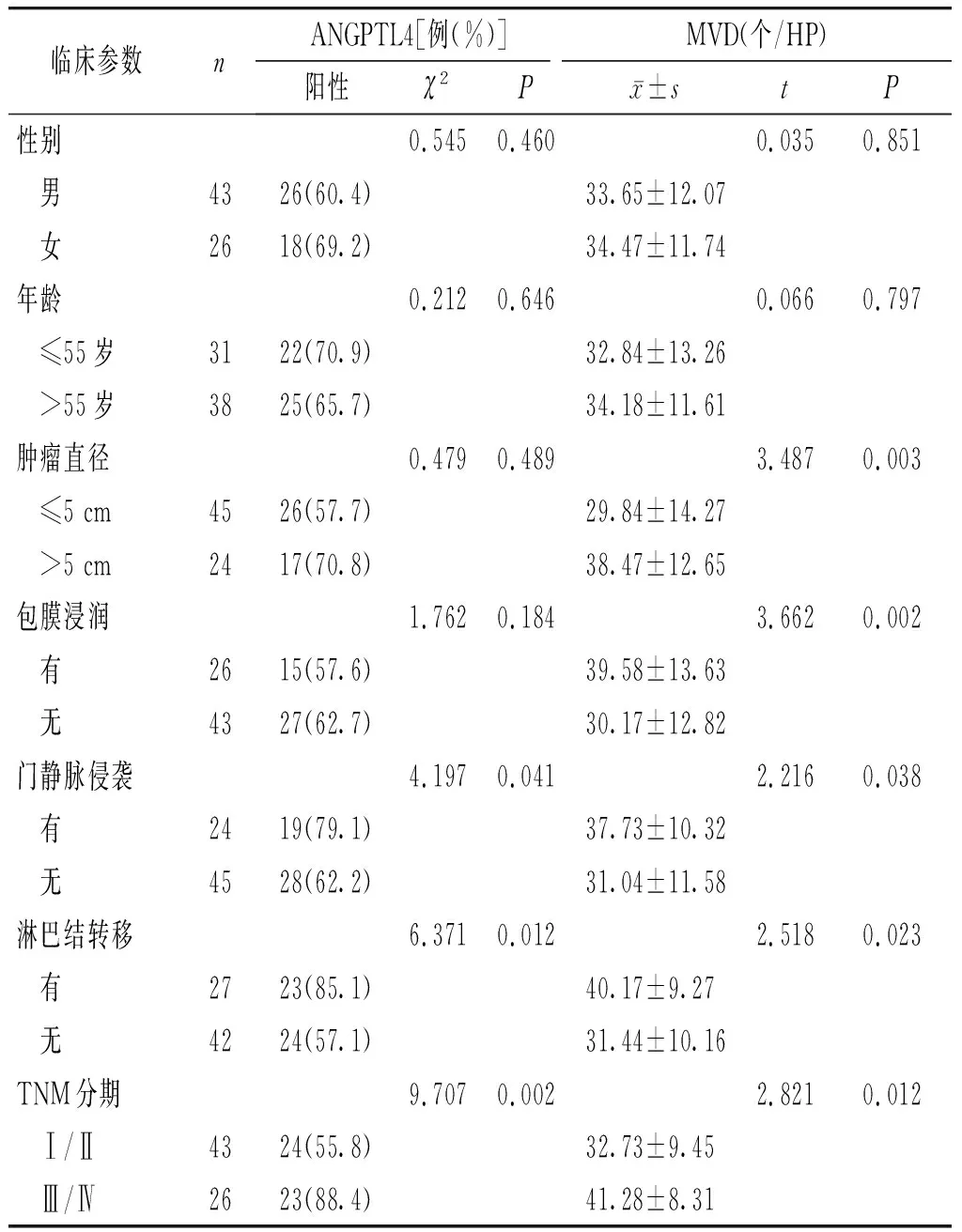
临床参数nANGPTL4[例(%)]MVD(个/HP)阳性χ2Px±stP性别0.5450.4600.0350.851 男4326(60.4)33.65±12.07 女2618(69.2)34.47±11.74年龄0.2120.6460.0660.797 ≤55岁3122(70.9)32.84±13.26 >55岁3825(65.7)34.18±11.61肿瘤直径0.4790.4893.4870.003 ≤5 cm4526(57.7)29.84±14.27 >5 cm2417(70.8)38.47±12.65包膜浸润1.7620.1843.6620.002 有2615(57.6)39.58±13.63 无4327(62.7)30.17±12.82门静脉侵袭4.1970.0412.2160.038 有2419(79.1)37.73±10.32 无4528(62.2)31.04±11.58淋巴结转移6.3710.0122.5180.023 有2723(85.1)40.17±9.27 无4224(57.1)31.44±10.16TNM分期9.7070.0022.8210.012 Ⅰ/Ⅱ4324(55.8)32.73±9.45 Ⅲ/Ⅳ2623(88.4)41.28±8.31
2.3 肝癌组织中ANGPTL4与MVD的关系
ANGPTL4阳性组MVD值为(38.85±10.27)个/HP,ANGPTL4阴性组MVD值为(30.49±12.38)个/HP,两组间差异具有统计学意义(t=3.548,P=0.002),ANGPTL4阳性组MVD值较高。
3 讨论
HCC是具有双重血液供应的富血管恶性肿瘤,它的发生、发展、转移及复发离不开新生血管的生成。血管生成是促进因子和抑制因子在多因子调控作用下发生的一系列复杂而有序的过程。其中ANGPTL4是血管生成素样蛋白家族中的一种分泌型糖蛋白,在脂肪和肝脏组织分布较多[3],它不仅参与脂质、葡萄糖代谢,还与肿瘤的发生、血管生成、伤口愈合及细胞分化密切相关[4]。Xin等[5]对体内外缺氧的视网膜细胞研究发现,ANGPTL4在促进血管渗透性发挥着重要的作用。同样ANGPTL4在缺氧诱导下的表达上调,可能参与了胃癌新生血管的生成[6]。我们的前期研究发现缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)表达与肝癌新生血管生成密切相关[7]。类似研究也表明[8],在HCC组织中HIF-1α与ANGPTL4表达正相关,HIF-1α通过激活靶基因ANGPTL4促进HCC新生血管的生成、转移及复发。本研究中,肝癌组织的ANGPTL4阳性表达率为56.52%,高于正常肝组织中的表达,两者比较差异有统计学意义;同时ANGPTL4在肝癌组织中的表达与门静脉侵袭、淋巴结转移和TNM分期密切相关(P<0.05),进一步研究提示,TNM分期高的肝癌组织ANGPTL4阳性表达率较高。与相关文献报道相似,肝癌组织中ANGPTL4的mRNA表达和蛋白水平较高,且淋巴结转移及肿瘤恶性度与ANGPTL4的表达密切相关;敲除或中和ANGPTL4明显抑制肝癌MHCC-97细胞转移及血管渗透[8,9]。因此,ANGPTL4可能是促进肝癌生长、转移和血管生成的因子,也可能是肝癌浸润、转移重要的生物标志物。
CD105作为标记肿瘤新生血管生成的因子,是一种跨膜蛋白,为转化生长因子β1和β3的受体[10],在处于增殖的肿瘤组织血管内皮细胞上高表达,大血管与正常组织中低表达或不表达,具有特异性[11]。MVD是评价人类肿瘤新生血管生成的较好方法,常被用来判断、评估肿瘤微血管增殖状况,在恶性肿瘤组织中MVD计数越高,提示肿瘤侵袭性越强、转移越早,预后越差。本研究中,CD105-MVD在肝癌组织中的表达明显高于正常肝组织,两者比较差异有统计学意义(P<0.05)。且在肿瘤直径较大伴有包膜浸润、门静脉侵袭、淋巴结转移和TNM分期高的肝癌组织中表达较多,提示恶性程度高的肿瘤促使微血管大量增殖为其提供所需的营养及血供。同时发现,ANGPTL4阳性组的CD105-MVD值高于ANGPTL4阴性组,两组间差异具有统计学意义(P<0.05),提示肝癌组织中ANGPTL4的表达上调可能通过参与肝癌微血管生成,且对微血管的增殖、形成有明显的促进作用,通过增殖的微血管为肿瘤细胞提供所需的血供,促进肝癌进一步的浸润、转移及复发,增强了侵袭及转移能力,影响了肝癌的生物学行为。
因此,ANGPTL4可能是促进肝癌血管新生,影响HCC转移及复发的细胞因子,与门静脉侵袭、淋巴结转移和TNM分期密切相关。ANGPTL4可能是肝癌浸润、转移的靶分子,对肝癌的治疗、评估及判断预后具有一定的临床意义。
参考文献:
[1] La PL, Listì A, Caruso S,etal. Potential role of ANGPTL4 in the cross talk between metabolism and cancer through PPAR signaling pathway[J]. PPAR Res, 2017,(20):8187235.
[2] Weidner N, Carroll PR, Flax J,etal. Tumor angiogenesis correlates with metastasis in invasive prostate carcinoma[J]. Am J Pathol, 1993, 143(2): 401-409.
[3] Kim I, Kim HG, Kim H,etal. Hepatic expression, synthesis and secretion of a novel fibrinogen/angiopoietin-related protein that prevents endothelial-cell apoptosis[J]. Biochem J, 2000, 346(3): 603-610.
[4] Zhu P, Goh YY, Chin HFA,etal. Angiopoietin-like 4: a decade of research[J]. Biosci Rep, 2012, 32(3): 211-219.
[5] Xin X, Rodrigues M, Umapathi M,etal. Hypoxic retinal Müller cells promote vascular permeability by HIF-1-dependent up-regulation of angiopoietin-like 4[J]. Proc Natl Acad Sci USA, 2013, 110(36):3425-3434.
[6] Kubo H, Kitajima Y, Kai K,etal. Regulation and clinical significance of the hypoxia-induced expression of ANGPTL4 in gastric cancer[J]. Oncol Lett, 2016, 11(2):1026-1034.
[7] 刘凯歌,谢华红,刘杰.乙型肝炎病毒X蛋白与缺氧诱导因子-1α在肝癌中的表达及可能的调节机制[J].中华肝脏病杂志,2007,15(2):122-126.
[8] Li H, Ge C, Zhao F,etal. Hypoxia-inducible factor 1 alpha-activated angiopoietin-like protein 4 contributes to tumor metastasis via vascular cell adhesion molecule-1/integrin β1 signaling in human hepatocellular carcinoma[J]. Hepatology, 2011, 54(3): 910-919.
[9] El-Shal AS, Zidan HE, Rashad NM,etal. Angiopoietin-like protein 3 and 4 expression 4 and their serum levels in hepatocellular carcinoma[J]. Cytokine, 2017, 96:75-86.
[10] Duff SE, Li C, Garland JM,etal. CD105 is important for angiogenesis: evidence and potential applications[J]. FASEB J, 2003, 17(9):984-992.
[11] Kwon YC, Sasaki R, Meyer K,etal. Hepatitis C virus core protein modulates endoglin (CD105) signaling pathway for liver pathogenesis[J]. J Virol, 2017, 91(21): e01235-17.

