大鼠睡眠剥夺后下丘脑组蛋白乙酰化修饰对小胶质细胞的作用
霍芳芳,史 明,屈杜洁,郭生龙,郭向阳,刘士福,郝敏锋,吴中亮*
(1第四军医大学西京医院神经内科,西安 710032;2榆林市榆阳区中医院内科;3西安市中心医院神经内科;*通讯作者,E-mail:wuzhongl@fmmu.edu.cn)
睡眠不足或者睡眠质量下降不但可以引起学习记忆受损和认知功能下降[1,2],还可以对机体的血液循环系统和免疫系统等造成损伤[3]。大量研究证实,人体在没有明显感染或损伤表现时,急性或慢性睡眠剥夺可导致外周血白细胞计数,C-反应蛋白以及炎症因子水平(IL-1β,IL-6,TNF-α)显著升高[4,5]。此外,在动物实验研究中发现,睡眠缺乏可引起小鼠海马和大脑皮层小胶质细胞的激活,同时引起局部神经炎症反应,进而加重神经功能损伤[6]。下丘脑是睡眠调节的中枢,但睡眠剥夺对下丘脑小胶质细胞和局部神经炎症的影响及其作用机制尚不明确。
组蛋白修饰是组蛋白在相关酶的作用下发生甲基化、乙酰化、磷酸化、泛素化等修饰。常见的组蛋白乙酰化修饰在H3K9(H3N一端第9位赖氨酸)K14、K23等位点[7]。本实验以组蛋白乙酰化H3N一端第9位赖氨酸位点(H3K9AC)为研究对象,组蛋白乙酰化水平主要由组蛋白去乙酰化酶(HDAC)和组蛋白乙酰化转移酶(HAT)进行调控。研究发现,组蛋白乙酰化修饰在免疫炎症反应中发挥重要的作用,SAHA是作用于HDAC的广谱性抑制剂。通过抑制HDAC,提高组蛋白去乙酰化修饰水平,提高组蛋白乙酰化修饰水平可以减少神经系统的炎性反应;抑制小胶质细胞的活化同时促进小胶质细胞向具有组织修复功能的M2表型转变[8]。但睡眠剥夺后组蛋白乙酰化修饰在小胶质细胞功能调节中的作用尚未见报道。本实验主要探讨睡眠剥夺对大鼠下丘脑区小胶质细胞的影响和组蛋白乙酰化修饰的改变,观察提高组蛋白乙酰化修饰水平对小胶质细胞活化和相关炎症因子的影响。
1 材料与方法
1.1 实验动物和主要试剂
雄性大鼠,二级清洁级(SPF)8-9周龄,生产许可证号:scxk(军)2012-0007)45只,体质量200-250 g,兔抗H3K9AC单克隆抗体和山羊抗Iba-1多克隆抗体购自英国Abcam公司,兔抗β-action多克隆抗体和HRP(辣根过氧化物酶)标记山羊抗兔IgG购自北京康为世纪公司,Cy3标记驴抗山羊购自美国Abbkine公司,异羟肟酸(SAHA)购自美国Selleck公司。
1.2 实验分组及给药方法
按照随机数字表法将45只雄性Sprague Dawley大鼠随机分为5组:对照组(control组,n=9)、睡眠剥夺3 d组(SD3组)、睡眠剥夺3 d+SAHA(SD3+SAHA组)、睡眠剥夺6 d组(SD6组)、睡眠剥夺6 d+SAHA(SD6+SAHA组),每组9只大鼠。对照组大鼠正常笼养,SD3组大鼠睡眠剥夺3 d,SD6组大鼠睡眠剥夺6 d。异羟戊酸(SAHA)是一种组蛋白去乙酰化酶抑制剂,通过抑制组蛋白去乙酰化酶,提高组蛋白去乙酰化修饰水平。将SAHA粉剂溶于二甲基亚砜(DMSO)中,对SD3+SAHA组与SD6+SAHA组分别以50 mg/(kg·d)从睡眠剥夺前一天开始连续腹腔注射,直至睡眠剥夺结束。对照组给予等体积DMSO。
1.3 睡眠剥夺大鼠模型的建立
采用国际公认的改良多平台睡眠剥夺法(modified multiple platform method,MMPM)建立睡眠剥夺模型[9]。制备大小为75.0 cm×40.0 cm×40.0 cm水箱,内设8个高8.0 cm、直径6.5 cm圆形平台,平台间距离为15.0 cm,水面低于平台约1-2 cm,水温保持20-24 ℃。大鼠可在各平台间自由活动和采食饮水,当大鼠睡眠进入REM期时,大鼠由于肌肉松弛,张力消失,掉入水中,再次清醒,因此达到REM期睡眠剥夺。在造模前2 d大鼠置于盛水的平台上适应2 d,每天2 h,第3天开始对SD3组、SD6组大鼠进行睡眠剥夺,造模时间每天光照从早9:00到晚9:00,以保证昼夜节律正常。SD3+SAHA组与SD6+SAHA组先笼养给药(如SD3+SAHA组,睡眠剥夺前一天开始给药,直至睡眠剥夺结束)。对照组大鼠笼养。
1.4 大鼠脑组织标本的采集
分别从各组中随机取3只大鼠,用10%水合氯醛(3-5 mg/kg)腹腔注射麻醉大鼠,暴露心脏,用止血钳夹起心脏,从心尖处将针头插入主动脉,打开灌注器,剪开右心耳,以30 r/min灌注生理盐水。当右心耳流出的血液变清澈时,改用4%多聚甲醛溶液灌注300-400 ml,快速取出大鼠脑组织,多聚甲醛溶液4 ℃固定过夜。30%蔗糖溶液脱水,脑组织下沉。根据西北大学出版社出版的第1版《大鼠脑读片提要及图谱》(文献号:ISBN 7-5604-0892-3/R 15)的图谱,用德国(Leica)切片机切片,以厚度30 μm切下丘脑区域,放入冻存液中,-20 ℃冰箱储存。
1.5 大鼠下丘脑小胶质细胞活化
Iba-1是小胶质细胞特异性的标记分子,实验通过Iba-1作为免疫荧光染色标记小胶质细胞,观察小胶质细胞形态的变化,从而表明其是否活化。小胶质细胞处于静息状态时呈分枝状,胞体小,分支较细长,而活化的小胶质细胞胞体增大,分支变粗而短,呈现出典型的阿米巴样状态或还未达到典型阿米巴样状态的中间活化状态[10]。
1.6 免疫荧光法检测小胶质细胞(Iba-1)
从-20 ℃的冰箱里分别取出各组大鼠下丘脑位置脑片,1×PBS(pH=7.4)洗3次,每次10 min,5%BSA封闭40-60 min,5%BSA稀释一抗,山羊抗Iba-1(1 ∶500),4 ℃过夜。1 ∶5 000稀释的Hochest稀释二抗,Cy3标记的驴抗山羊(1 ∶500)封闭,常温避光孵育2 h,脑片铺在载玻片上,甘油封片,德国(Leica)荧光显微镜观察,每张片取3个不同视野,计数Iba-1的活化数目。
1.7 Western blot检测H3K9AC
分别从各组中随机取3只大鼠,用10%水合氯醛(3-5 mg/kg)腹腔注射麻醉,断头取脑组织,取下丘脑,加入700 μl裂解液,用匀浆研磨器研磨、离心,取上清液,测量蛋白浓度,-80 ℃保存备用。取出蛋白组织,溶解后分别取60 μg,目的分子H3K9AC大小约17 kDa,内参β-actin 42 kDa,用SDS-PAGE凝胶试剂盒配制10%的分离胶电泳,NC膜转膜,5%脱脂牛奶封闭约1 h,分别孵育兔抗H3K9AC(1 ∶1 000)和兔抗β-actin(1 ∶2 000),4 ℃过夜,加山羊抗兔IgG(1 ∶1 000),室温孵育约2 h,用化学发光试剂盒配置的发光液成像,并应用Gel-Pro Application软件检测结果灰度值并记录。
1.8 RT-RNA检测TNF-α、IL-6、NOS2、IL-10的mRNA的表达
提取下丘脑组织总的RNA,紫外分光光度计测出RNA浓度和纯度,纯度检测A260/280在1.8-2.0,按照逆转录试剂盒PrimeScript RT Master Mix的说明书合成cDNA。RT-PCR扩增反应采用25 μl体系:分别向每个8联管加入Taq(2×)酶Ⅱ 12.5 μl、上下引物各1 μl、dH2O 8.5 μl、cDNA模板2 μl,每个样品设3个复孔。反应条件是95 ℃ 30 s变性,95 ℃ 5 s、60 ℃ 30 s、72 ℃ 15 s 40个循环。β-actin作为内参检测实验各组大鼠下丘脑的炎症因子TNF-α、IL-6、NOS2、IL-10的mRNA的表达。引物由TaKara公司设计和合成,所用引物序列见表1。
表1RT-PCR的目的基因引物序列
Table1TargetgeneprimersequencesofrealtimePCR

目的基因 引物序列TNF-αF:5'-TCAGTTCCATGGCCCAGAC-3'R:5'-GTTGTCTTTGAGATCCATGCCATT-3'IL-6F:5'-ATTGTATGAACAGCGATGATGCAC-3'R:5'-CCAGGTAGAAACGGAACTCCAGA-3'NOS2F:5'-GTAGCGGGGCTTCAAGATAGGGAG-3'R:5'-CGGACGAGACGGATAGGCAGAGAT-3'IL-10F:5'-CCCTTTGCTATGGTGTCCTT-3'R:5'-TGGTTTCTCTTCCCAAGACC-3'β-actinF:5'-GGAGATTACTGCCCTGGCTCCTA-3'R:5'-GACTCATCGTACTCCTGCTTGCTG-3'
1.9 统计学分析
采用Graph Pad Prism 6.00软件作图,数据使用SPSS17.0统计分析,以均数±标准差表示,组间差异分析采用单因素方差分析和LSD检验,当P<0.05时,组间差异具有统计学意义。
2 结果
2.1 各组大鼠下丘脑区小胶质细胞的表达
免疫荧光染色检测小胶质细胞活性细胞数(Iba-1),结果显示大鼠下丘脑区小胶质细胞广泛表达,应用红色荧光标记。与control组相比,SD3组、SD6组大鼠下丘脑小胶质细胞活性细胞数目明显增多,差异有统计学意义(P<0.05),而大鼠下丘脑小胶质细胞活性细胞数目在SD3组与SD6组组间相比差异无统计学意义(P>0.05);SD3+SAHA组与SD3组相比、SD6+SAHA组与SD6组相比,大鼠下丘脑中的小胶质细胞活性数目降低,差异有统计学意义(P<0.05),而SD3+SAHA组与SD6+SAHA组组间相比,小胶质细胞活性数目差异无统计学意义(P>0.05,见图1,2)。
2.2 各组大鼠下丘脑组蛋白H3K9乙酰化水平的改变
Western blot检测各实验组大鼠下丘脑组织中组蛋白乙酰化H3N一端第9位赖氨酸位点(H3K9AC)水平表达,结果显示,与control组相比,SD3组、SD6组大鼠下丘脑中的H3K9AC明显减少,差异均有统计学意义(P<0.01),而大鼠下丘脑中的H3K9AC的表达在SD3组与SD6组间相比,差异无统计学意义(P>0.05)。SD3+SAHA组与SD3组相比、SD6+SAHA组与SD6组相比,大鼠下丘脑中的H3K9AC水平明显提高,差异有统计学意义(P<0.05)。而大鼠下丘脑中的H3K9AC的表达在SD3+SAHA组与SD6+SAHA组进行组间相比,差异无统计学意义(P>0.05,见图3)。

图1 各实验组大鼠下丘脑中小胶质细胞Iba-1免疫荧光染色结果Figure 1 The activity of microglia in the rat hypothalamus by immunofluorescence
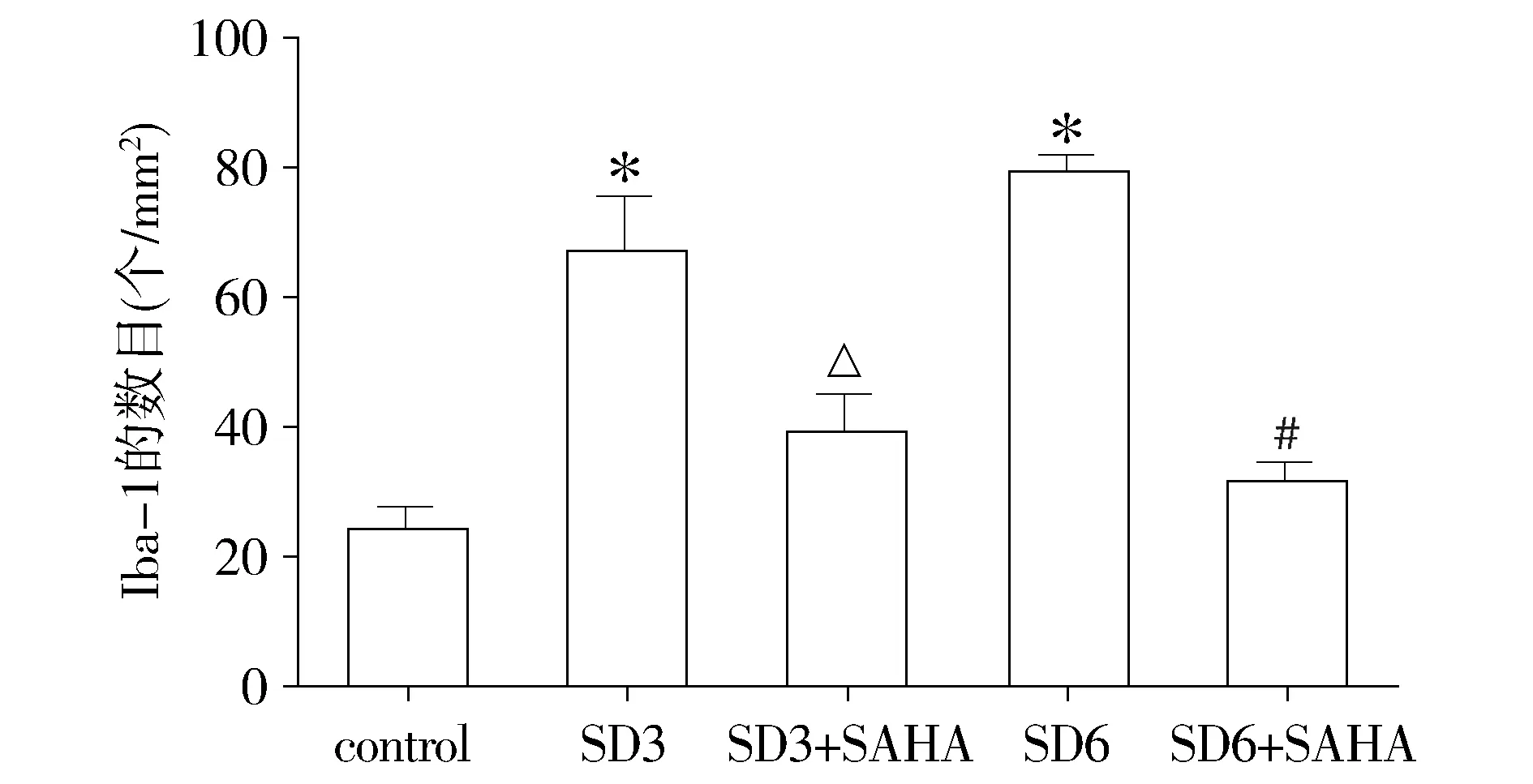
与control组比较,*P<0.05;与SD3组比较,△P<0.05;与SD6组比较,#P<0.05图2 各实验组大鼠下丘脑中小胶质细胞的活性对比Figure 2 Comparison of activity of microglia in the rat hypothalamus among five groups
2.3 各组大鼠下丘脑的炎症因子TNF-α、IL-6、NOS2、IL-10的mRNA表达
与control组相比,SD3组、SD6组大鼠下丘脑组织中炎症因子TNF-α、IL-6、NOS2、IL-10的mRNA表达水平增加,差异有统计学意义(P<0.05);SD3+SAHA组与SD3组相比,大鼠下丘脑组织中炎症因子IL-6、NOS2表达减少,差异有统计学意义(P<0.01);SD6+SAHA组与SD6组相比,大鼠下丘脑组织中炎症因子TNF-α减少,差异有统计学意义(P<0.05),IL-6、NOS2明显减少,差异有统计学意义(P<0.01),IL-10作为抗炎因子增多,差异有统计学意义(P<0.05,见表2)。

与control组相比,**P<0.01;与SD3组比较,△P<0.05;与SD6组比较,#P<0.05图3 大鼠下丘脑组蛋白H3K9乙酰化水平的改变Figure 3 The changes of histone H3K9 acetylation levels in the hypothalamus of rats
表2各组炎症因子mRNA水平在下丘脑的表达
Table2ExpressionofthelevelofinflammatoryfactormRNAinthehypothalamus

分组 TNF-α IL-6 NOS2 IL-10 Control组1 1 1 1 SD3组2.50±0.70#3.19±0.21#6.35±0.95#2.24±0.24#SD3+SAHA组1.43±0.421.49±0.51**2.39±0.48**2.40±0.59SD6组3.30±0.73#6.27±0.27#8.91±0.52#2.50±0.46#SD6+SAHA组1.77±0.41Δ2.89±0.39ΔΔ3.09±0.26ΔΔ4.90±0.80Δ
与对照组相比,#P<0.05,##P<0.01;与SD3组相比,*P<0.05,**P<0.01;与SD6组相比,ΔP<0.05,ΔΔP<0.01
3 讨论
睡眠不足或睡眠质量下降是炎症相关疾病的危险因素之一[11],如心血管疾病、免疫功能失调、代谢紊乱等[12-15]。尽管针对神经元细胞在睡眠剥夺后脑部功能异常中的作用已有大量研究,作用机制仍不清楚,而非神经元细胞在睡眠中的作用日益引起人们的重视。小胶质细胞是中枢神经系统的固有吞噬细胞,它们在突触发育及神经损伤修复过程中均发挥着重要的作用[16,17]。研究显示,在没有明显的感染及损伤情况下,急性和慢性睡眠剥夺可以引起小胶质细胞的激活[18]。此外,下丘脑是调节睡眠-觉醒的中枢[19],同时与神经垂体和腺垂体的内分泌调节密切相关[20]。基因与环境相互作用的表观遗传学机制可能对睡眠和睡眠障碍的调控发挥重要作用[21]。目前侧重于组蛋白乙酰化修饰对生物钟的基因表达调控。组蛋白乙酰化在肿瘤、炎性反应、脂肪代谢等方面已取得广泛研究,体内组蛋白乙酰化水平的变化由组蛋白乙酰化酶(HATs)和组蛋白去乙酰化酶(HDACs)调节,而后者在染色体结构重塑及基因表达调控中发挥着重要的作用[22]。那么睡眠剥夺对下丘脑部位的小胶质细胞、组蛋白乙酰化水平有什么样的作用?本实验结果证实,大鼠睡眠剥夺后下丘脑部位的小胶质细胞呈活化状态,主要表现为小胶质细胞数量的增多、细胞胞体增大以及分支变粗。同时,该部位促炎因子IL-6、TNF-α、NOS2的mRNA表达水平亦显著提高。
研究发现,HDAC抑制剂可以通过抑制小胶质细胞的炎症反应进而在神经变性疾病,如Alzheimer’s,Huntington’s等疾病中发挥神经保护作用[23-25]。Patnala等[26]在小鼠脑缺血模型中发现,HDAC抑制剂SB(sodium butyrate,SB)可以抑制缺血后的神经炎症反应,包括抑制小胶质细胞的激活、下调促炎因子IL-6、TNF-α、NOS2的表达并促进抑炎因子IL-10/STAT3通路的激活。本研究结果显示,睡眠剥夺后小胶质细胞组蛋白乙酰化H3K9水平显著降低,而注射HDAC抑制剂后(SAHA)乙酰化水平提高,同时活化的小胶质细胞数量显著减少,细胞体积减小,通过应用SAHA改变组蛋白乙酰化时,发现促炎性因子TNF-α、NOS2、IL-6表达减少,而抗炎因子IL-10表达增高,说明睡眠剥夺可能诱导IL-10/STAT3抗炎途径下游的基因表达,从而影响小胶质细胞的表达。
小胶质细胞活化至关重要的表观遗传学机制,可用于将小神经胶质细胞表型从神经毒性转变为神经保护性,帮助神经再生和在缺血性脑中发挥神经保护作用[27]。所以可认为组蛋白乙酰化对小胶质细胞起保护作用。也有实验表明神经胶质细胞和神经元之间相互影响[28],前期实验证明,睡眠剥夺引起神经元细胞显著减少,而注射HDAC抑制剂(SAHA)可改善睡眠剥夺诱导减少的神经元表达[29],而小胶质细胞是中枢的吞噬细胞,它们在突触发育及神经损伤修复过程中均发挥着重要的作用,所以进一步证明组蛋白乙酰化对神经有保护作用。
综上所述,本研究显示,睡眠剥夺可影响大鼠下丘脑区小胶质细胞的活化和组蛋白乙酰化修饰,通过使用HDAC抑制剂SAHA提高组蛋白乙酰化水平,可以明显抑制大鼠睡眠剥夺后下丘脑小胶质细胞的炎性反应,同时发挥重要的神经保护作用。因此需要进一步开展SAHA的临床研究,可望使其成为保护神经治疗措施的一种新选择,然而本研究的具体信号机制仍需进一步深入探讨。
参考文献:
[1] Sateia MJ. International classification of sleep disorders-third edition: highlights and modifications[J]. Chest, 2014, 146(5):1387-1394.
[2] 吴兴曲,陈玖,杨来启,等.36 h睡眠剥夺对青年军人听感觉门控P50的影响[J].山西医科大学学报,2013,44(3):200-202.
[3] 董开源,闫昱博,马珂,等.褪黑素对睡眠剥夺大鼠肝损伤的保护作用[J].山西医科大学学报,2012,43(12):903-906.
[4] Hurtado-Alvarado G, Pavn L, Castillo-García SA,etal. leep Loss as a Factor to Induce Cellular and Molecular Inflammatory Variations[J]. Clin Dev Immunol, 2013, 2013:801341labelpara:mylabel1
[5] He JY,Hsuchou H,He Y,etal. Sleep restriction impairs blood-brain barrier function[J]. J Neurosci, 2014,34(44):14697-14706.
[6] Bellesi M, de Vivo L,Chini M,etal. Sleep loss promotes astrocytic phagocytosis and microglial activation in mouse cerebral cortex[J]. J Neurosci, 2017, 37(21): 5263-5273.
[7] Tony K.Chromatin modifications and their function[J]. Cell, 2007, 128 (4):693-705.
[8] Lu J, Frerich JM, Turtzo LC,etal. Histone deacetylase inibitors are neuroprotective and preserve NGF-mediated cell survival following traumatic brain injury[J]. Proc Natl Acad Sci, 2013, 110 (26):10747-10752.
[9] Suchecki D, Tufik S. Social stability attenuates the stress in the modified multiple platform method for paradoxical sleep deprivation in the rat[J]. Physiol Behav, 2000, 68(3):309-316.
[10] Shigemoto-Mogami Y, Hoshikawa K, Goldman JE,etal. Microglia enhance neurogenesis and oligodendrogenesis in the early postnatal subventricular zone[J]. J Neurosci,2014, 34(6):2231-2243.
[11] Wisor JP, Schmidt MA, Clegern WC,etal. Evidence for neuroinflammatory and microglial changes in the cerebral response to sleep loss[J]. Sleep, 2011, 34(3):261-272.
[12] Rechtschaffen A, Gilliland MA, Bergmann BM,etal. Physiological correlates of prolonged sleep deprivation in rats[J]. Science, 1983, 221(4606):182-184.
[13] Everson CA, Bergmann BM, Rechtschaffen A,etal. Sleep deprivation in the rat: III. Total sleep deprivation[J]. Sleep, 1989, 12(1):13-21.
[14] Rechtschaffen A, Bergmann BM. Sleep deprivation in the rat by the disk-over-water method[J]. Behav Brain Res, 1995, 69(1-2):55-63.
[15] Muzio L, Brambilla V, Calcaterra L,etal. Increased neuroplasticity and hippocampal microglia activation in a mice model of rapid antidepressant treatment[J]. Behav Brain Res, 2016, 311: 392-402.
[16] Um JW. Roles of glial cells in sculpting inhibitory synapses and neural circuits[J]. Front Mol Neurosci,2017,10:381.
[17] Elbaz I, Foulkes NS, Gothilf Y,etal. Circadian clocks, rhythmic synaptic plasticity and the sleep-wake cycle in zebrafish[J]. Front Neural Circuits, 2013,7:9.
[18] Michels M, Sonai B, Dal-Pizzol F,etal. Polarization of microglia and its role in bacterial sepsis[J]. J Neuroimmunol, 2017, 303:90-98.
[19] Kim JH, Kim JH, Cho YE,etal. Chronic sleep deprivation-induced proteome changes in astrocytes of the rat hypothalamus[J]. J Proteome Res, 2014, 13(9):4047-4061.
[20] Bouret SG. Leptin, nutrition, and the programming of hypothalamic feeding circuits[J]. Nestle Nutr Workshop Ser Pediatr Program,2010,65:25-35.
[21] Palagini L, Biber K, Riemann D. The genetics of insomnia-evidence for epigenetic mechanisms?[J]. Sleep Med Rev,2014,18(3):225-235.
[22] Shahbazian MD, Grunstein M. Functions of site-specific histone acetylation and deacetylation[J]. Annu Rev Biochem, 2007, 76:75-100.
[23] New M, Olzscha H, La Thangue NB. HDAC inhibitor-based therapies: can we interpret the code?[J]. Mol Oncol, 2012, 6(6):637-656.
[24] Dokmanovic M, Clarke C, Marks PA. Histone deacetylase inhibitors: overview and perspectives[J]. Mol Cancer Res, 2007, 5(10):981-989.
[25] Montalvo-Ortiz JL, Keegan J, Gallardo C,etal. HDAC inhibitors restore the capacity ofaged mice to respond to haloperidol through modulation of histone acetylation[J]. Neuropsychopharmacology, 2014, 39(6):1469-1478.
[26] Patnala R, Arumugam TV, Gupta N,etal. HDAC Inhibitor Sodium Butyrate-Mediated Epigenetic Regulation Enhances Neuroprotective Function of Microglia During Ischemic Stroke[J]. Mol Neurobiol, 2017, 54(8):6391-6411.
[27] Rauzan M,Chuah CT,Ko TK,etal. The HDAC inhibitor SB939 overcomes resistance to BCR-ABL kinase Inhibitors conferred by the BIM deletion polymorphism in chronic myeloid leukemia[J]. PLoS One, 2017, 12(3):e0174107.
[28] 黄裕新,王景杰,王胜智,等.胶质细胞参与电针足三里对胃运动的调节作用[J].山西医科大学学报,2007,38(10):886-889.
[29] 马妮,史明,马安东,等.睡眠剥夺通过影响大鼠下丘脑组蛋白乙酰化调控神经元Orexin A的表达[J].神经解剖学杂志,2016,32(3):333-338.

