特发性膜性肾病患者外周血Th17/Treg失衡在环孢素A治疗后的变化及其对预后的影响
唐 丹,张剑彬,郭继光,陈 莉,段雪莲
(重庆医科大学附属永川医院肾内科,重庆 402160;*通讯作者,E-mail:906062731@qq.com)
特发性膜性肾病(idiopathic membranous nephropathy,IMN)是成人肾病综合征的常见病因,根据国内外的相关报道,特发性膜性肾病约占原发性肾病综合征的1/3,居于首位[1]。经过免疫治疗后仍有相当部分的患者不能缓解,最后进展到终末期肾病。关于特发性膜性肾病的发病机制仍未完全阐明,且缺乏敏感而特异的检测指标。近年来,有研究发现细胞免疫紊乱可能在特发性膜性肾病发病机制中起了重要作用[2]。
Th17、Treg是近年来发现的有别于Th1、Th2的CD4+辅助性T细胞亚群,二者维持相对平衡在调节机体免疫耐受、抗排斥反应、感染、肿瘤、炎症等多种疾病中发挥重要作用[3]。大量的研究表明[4,5],Th17及其主要分泌物IL-17在狼疮性肾炎、新月体性肾炎、增殖性肾小球肾炎等的发病中发挥重要作用。TNF-α是存在于T淋巴细胞、肾小球系膜细胞内的多效细胞因子,现已证实其可导致肾小球结构和功能的严重破坏。TGF-β1是促进人类Treg细胞分化的重要细胞因子,Treg维持体内免疫平衡主要依靠接触抑制或分泌抗炎因子(如IL-10、TGF-β1)起作用。研究发现,特发性膜性肾病患者外周血Treg细胞百分比较正常对照组显著降低,使用免疫抑制剂治疗后外周血Treg细胞百分比升高与临床疗效有密切关系[6]。
环孢素A(cyclosporine A,CsA)是一种具有高选择性的强效免疫抑制剂,可有效抑制T淋巴细胞增殖和活化,目前有报道[7,8]指出在自身免疫性疾病中使用CsA对Th17/Treg存在重要影响,且Th17/Treg变化可能与疗效有关。本研究旨在探讨Th17/Treg在特发性膜性肾病患者环孢素A治疗前后的变化及其与预后的关系,以进一步探讨环孢素A作用机制。
1 资料与方法
1.1 一般资料
选择我院2015-09~2016-10期间确诊的特发性膜性肾病患者24例作为观察组,年龄分布为20-77岁,平均年龄为(48.83±4.92)岁,其中男性15例,女性9例。所有患者经肾活检病理学诊断为膜性肾病,且尿蛋白定量≥4 g,并排除其他继发性膜性肾病的可能。观察组予以氢化泼尼松[0.5 mg/(kg·d)]联合环孢素A[3-5 mg/(kg·d)]治疗,同时监测环孢素A血药浓度达标(100-180 ng/ml)。另外选择12例与观察组在年龄、性别相匹配的健康志愿者12例作为健康组,其中男性7例,女性5例,并排除相关免疫性疾病和近期感染史。所有患者及志愿者均自愿签署知情同意书,表示愿意完全理解并配合本次研究。
纳入标准:①年龄≥18岁,性别不限;②经肾活检病理学诊断为特发性膜性肾病,且尿蛋白定量≥4 g;③初次诊断IMN,未使用过环磷酰胺、环孢素A等细胞毒药物或免疫抑制剂。排除标准:①同时存在感染、肿瘤、高血压及糖尿病等患者,②妊娠患者。
根据KDIGO指南危险分级方法对观察组进行危险程度分级:①中危组:肾功能正常,6个月内蛋白尿>4 g/24 h但<8 g/24 h;②高危组:肾功能不全或肾萎缩,蛋白尿>8 g/24 h。以24 h尿蛋白定量作为疗效评价指标。
经环孢素治疗6月后,根据2014中国成人肾病综合征免疫抑制治疗专家共识将观察组分两组。有效组:①完全缓解(complete remission,CR):24 h尿蛋白定量<0.3 g或尿蛋白/血肌酐<300 mg,肾功能正常,人血白蛋白>35 g/L,尿蛋白定性阴性;②部分缓解(partial remission,PR):24 h尿蛋白定量>0.3 g,但<3.5 g;或uPCR在300-3 500 mg/g;或24 h尿蛋白定量比基线水平下降50%且肾功能稳定(血肌酐较基线水平上升<20%)。无效组:①未缓解(no remission,NR):24 h尿蛋白定量>3.5 g,且下降幅度小于基线水平的50%;②复发(relapse):经治疗后缓解的患者重新出现24 h尿蛋白定量>3.5 g,或uPCR>3 500 mg/g。
1.2 方法
分别采集观察组与健康组治疗前、治疗6个月后的空腹静脉血8-20 ml,抽血后在2 h内进行血浆和细胞分离,采用全自动生化法检测患者血清ALB、24 h尿蛋白,采用酶联免疫法检测IL-17、TNF-α、TGF-β1,采用流式分析法检测血清Th17细胞百分比、Treg细胞百分比。
1.2.1 流式细胞术 提取外周血PBMCS,调整细胞浓度为2×106-2×108/ml后,加入培养基,放入37 ℃、5%CO2孵箱中培养5 h后收集细胞,进行表面标记和胞内标记的荧光染色。所有标本均采用人anti-human CD4-FITC进行表面标记,其中Treg细胞加入anti-human CD25-FITC进行表面标记,待孵化完成,采用专用破膜剂破膜,最后加入anti-human Foxp3-PE 5 μl/test进行胞内标记染色,上机检测;Th17细胞加入anti-human IL-17-PE进行胞内标记染色后上机。
1.2.2 外周血IL-17、TNF-α和TGF-β含量检测 取外周血血清样本,加入缓冲液配置为样品液,与标准液分别加入检测孔中,BCA蛋白浓度测定试剂盒检测各组上清液的蛋白浓度。按ELISA检测试剂盒说明书操作流程检测外周血IL-17、TNF-α和TGF-β1的含量。
1.3 统计学方法
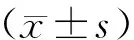
2 结果
2.1 特发性膜性肾病患者的一般情况
经入选的特发性膜性肾病患者和健康志愿者在性别、年龄方面经统计学检验差异无统计学意义(P>0.05)。
表1入组对象一般资料比较
Table1Baselinedataoftheenrolledstudysubjects

项目n性别(男/女)年龄(岁)病程(月)观察组2415/948.21±8.6911.85±10.26健康组127/548.55±5.82-
2.2 观察组与健康组细胞因子对比
观察组Th17细胞百分比较健康组显著升高(P<0.05),Treg细胞百分比较健康组明显降低(P<0.05)。观察组相关细胞因子浓度IL-17和TNF-α较健康组高(P<0.05),而TGF-β1则低于健康组(P<0.05,见表2)。
表2观察组与健康组外周血细胞因子对比
Table2ComparisonofperipheralbloodcytokinesbetweenIMNpatientsandhealthycontrols
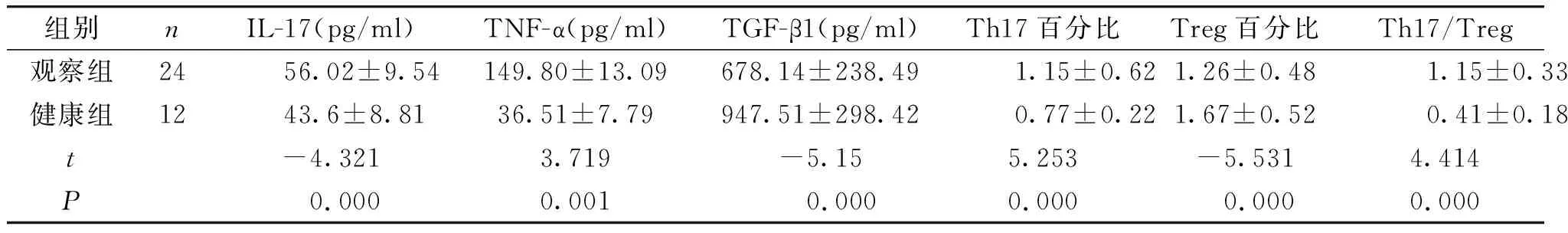
组别nIL-17(pg/ml)TNF-α(pg/ml)TGF-β1(pg/ml)Th17百分比Treg百分比Th17/Treg观察组2456.02±9.54149.80±13.09678.14±238.491.15±0.621.26±0.481.15±0.33健康组1243.6±8.8136.51±7.79947.51±298.420.77±0.221.67±0.520.41±0.18t-4.3213.719-5.155.253-5.5314.414P0.0000.0010.0000.0000.0000.000
2.3 特发性膜性肾病危险程度分层与外周血Th17和Treg细胞水平的关系
根据24 h尿蛋白水平将观察组分为中危和高危组,将其分别与健康组比较。表3结果显示,与健康组相比,中危组和高危组患者外周血Th17细胞百分比、IL-17、TNF-α及Th17/Treg均显著升高(P<0.05),而外周血Treg细胞百分比显著下降(P<0.05),且这种变化在高危组中尤为显著;与中危组相比,高危组外周血Th17细胞百分比、IL-17、TNF-α及Th17/Treg均显著升高(P<0.05),外周血Treg细胞百分比显著下降(P<0.05)。
表3不同危险程度IMN患者外周血Th17和Treg细胞水平
Table3PeripheralTh17,TregcellandrelevantcytokineslevelsinIMNpatientsstratifiedbyrisklevel
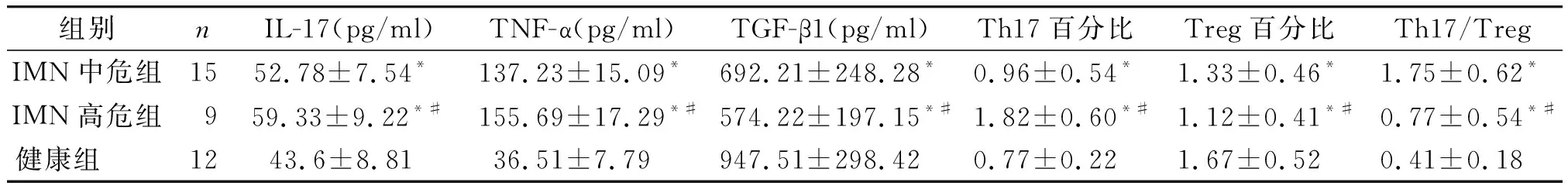
组别nIL-17(pg/ml)TNF-α(pg/ml)TGF-β1(pg/ml)Th17百分比Treg百分比Th17/TregIMN中危组1552.78±7.54* 137.23±15.09*692.21±248.28*0.96±0.54*1.33±0.46*1.75±0.62*IMN高危组959.33±9.22*#155.69±17.29*#574.22±197.15*#1.82±0.60*#1.12±0.41*#0.77±0.54*#健康组 1243.6±8.81 36.51±7.79947.51±298.420.77±0.221.67±0.520.41±0.18
与健康组相比,*P<0.05;与中危组相比,#P<0.05
2.4 特发性膜性肾病患者24 h尿蛋白水平与外周血Th17和Treg细胞水平的线性相关分析
IMN患者24 h尿蛋白水平与外周血Th17百分比呈显著正相关(r=0.741 6),与Th17/Treg比值呈显著正相关(r=0.845 9),与外周血Treg百分比呈负相关(r=0.841 5,见图1)。
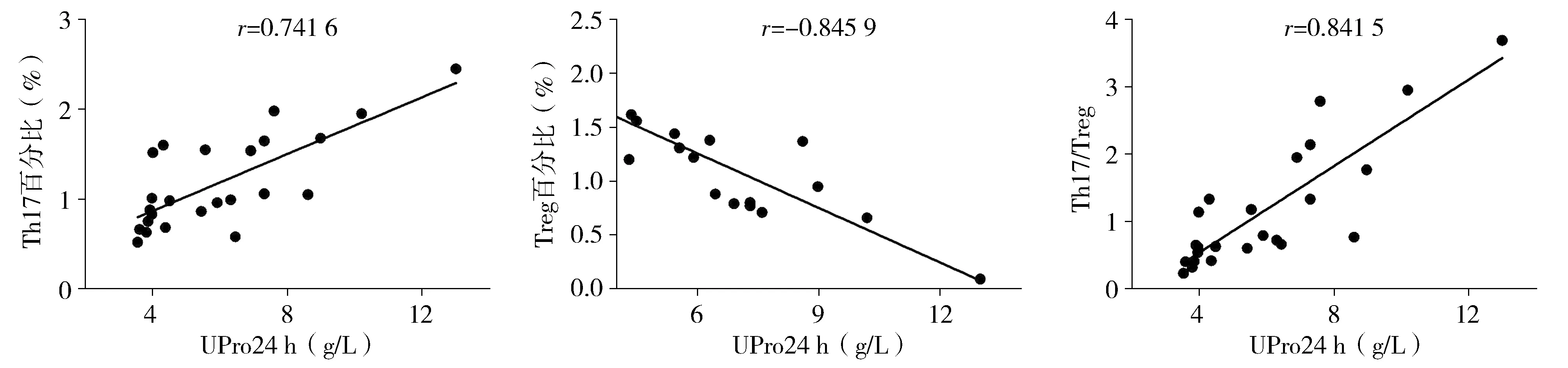
图1 特发性膜性肾病患者24 h尿蛋白水平与外周血Th17和Treg细胞水平的线性相关分析 Figure 1 Correlation analysis between 24 h urinary protein level and percentages of Th17, Treg and Th17/Treg ratio in IMN patients
2.5 IMN患者在CSA治疗前后临床指标及外周血Th17、Treg细胞百分比、Th17/Treg的变化
使用环孢素A治疗6个月后,根据血清Alb及24 h尿蛋白定量水平分为有效组和无效组,有效组治疗后不仅24 h尿蛋白水平明显下降(P<0.05),血清Alb水平上升,而且外周血Th17百分比和IL-17、TNF-α水平降低(P<0.05),外周血Treg百分比及TGF-β1升高(P<0.05);无效组治疗前后不仅24 h尿蛋白定量及血清Alb水平无明显变化(P>0.05),而且外周血Th17百分比和IL-17、TNF-α水平、外周血Treg百分比及TGF-β1上述改变也不明显(P>0.05,见表4)。
表4CSA治疗IMN前后临床指标和外周血Th17、Treg及其相关细胞因子的变化
Table4ChangesinclinicalparametersandperipheralTh17,TregandrelevantcytokinesinIMNpatientsbeforeandafterCsAtreatment
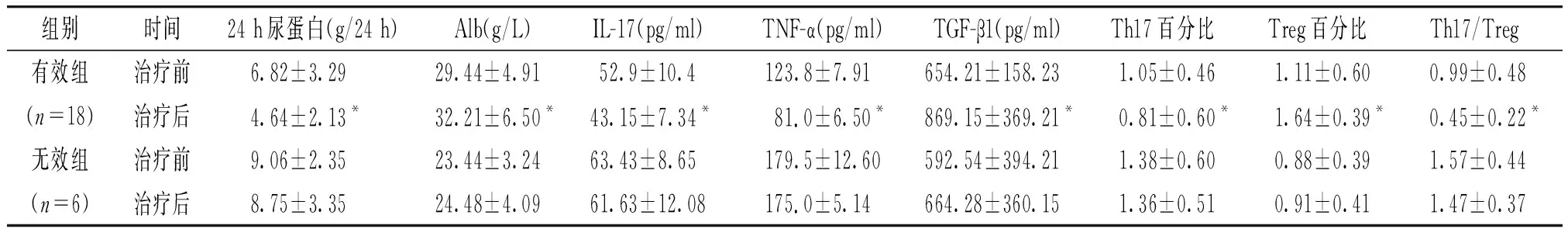
组别时间24 h尿蛋白(g/24 h)Alb(g/L)IL-17(pg/ml) TNF-α(pg/ml) TGF-β1(pg/ml) Th17百分比 Treg百分比 Th17/Treg 有效组治疗前 6.82±3.29 29.44±4.91 52.9±10.4 123.8±7.91654.21±158.23 1.05±0.46 1.11±0.60 0.99±0.48(n=18)治疗后 4.64±2.13* 32.21±6.50* 43.15±7.34* 81.0±6.50*869.15±369.21* 0.81±0.60* 1.64±0.39* 0.45±0.22*无效组治疗前 9.06±2.35 23.44±3.24 63.43±8.65 179.5±12.60592.54±394.21 1.38±0.60 0.88±0.39 1.57±0.44(n=6)治疗后 8.75±3.35 24.48±4.09 61.63±12.08 175.0±5.14664.28±360.15 1.36±0.51 0.91±0.41 1.47±0.37
与治疗前相比,*P<0.05
3 讨论
特发性膜性肾病(IMN)的发病机制是循环中的自身抗体识别肾小球足细胞的靶抗原,抗原与抗体结合后在上皮下形成免疫复合物,激活补体形成膜攻击复合物,引起基底膜和肾小球滤过屏障受损[9],但迄今为止尚未找到可用于临床监测IMN患者体内免疫活动的生物学标记。近年来研究发现IMN患者体内存在多种免疫活性细胞数量的变化,表现为Treg的减少,B细胞的增加和CD4/CD8比值升高[10],同时发现特发性膜性肾病患者体内外周血ICOS(+)和PD-1(+) Tfh细胞水平显著升高,外周血ICOS(+)/PD-1(+) Tfh cells比值和IL-21(+) Tfh水平与膜性肾病的病情进展密切相关,提示细胞免疫紊乱可能在特发性膜性肾病发病机制中起了重要作用,T/B淋巴细胞免疫失调可作为预测IMN病情进展的指标。Masutani等[11]通过流式细胞术定量分析各细胞亚群的比值,发现IMN患者IL-4+T细胞较对照组显著升高,Th1/Th2的比值较对照组显著降低,且血清IL-4水平与尿蛋白量显著相关,证实以Th1下调和Th2极化占优势的T淋巴细胞免疫反应改变了机体的免疫平衡稳态,可能促进了IMN的发生。Treg和Th17细胞是有别于Th1和Th2的两类CD4+T细胞亚群,Th17/Treg的平衡对维持免疫稳态、预防自身免疫性疾病有着重要作用。因而,我们探索性研究调节性T细胞和Th17细胞失衡在IMN发病中的作用及其在CSA治疗后的变化,以期从免疫炎症调节失衡的角度指导IMN病情评估及临床疗效判断。
本研究发现膜性肾病患者体内血清IL-17、TNF-α及Th17百分比明显高于正常对照组,而外周血Treg百分比及TGF-β1水平明显下降,这可能提示严重的T淋巴系统依赖性免疫缺陷可能存在于IMN患者中,外周血Treg细胞的减少和Th17细胞增多导致的Th17/Treg免疫失衡可能与IMN的疾病进展密切相关[12]。Treg在T细胞介导的免疫应答中起负性调节作用,抑制CD4+T淋巴细胞的增殖以及细胞因子(主要是IL-2)的分泌,此外Treg可以抑制抗原呈递细胞对Th细胞的活化,抑制Th活化B细胞的作用,抑制B细胞产生自身抗体,从而减轻组织中免疫复合物介导的损伤[13]。因此,Treg细胞的下调可能激活免疫系统,诱发IMN患者病理反应。Th17为近年新发现的重要的CD4+辅助T细胞亚群,Th17细胞可特异性表达核转录因子维甲酸相关孤儿受体γT(RORγT),分泌IL-17,TNF-α,IL-6及IL-23,参与了炎症反应和组织损伤过程[14]。Th17细胞分泌的细胞因子可以共同动员,收集和激活嗜中性粒细胞并介导炎症反应。适当的反应可以防止组织坏死和贫血,但如果反应过强,可能会导致组织破坏和免疫功能障碍。因此,Treg与Th17的相对平衡对于维持免疫耐受和预防炎性损伤至关重要[15,16].本研究结果显示IMN患者体内外周血Th17细胞和血清IL-17、TNF-α及IL-6水平升高,提示IMN启动了Th17型免疫应答的发生,可能通过IL-17、TNF-α等促炎因子的释放引起肾脏局部组织炎症,故本研究认为Th17细胞上调和Treg细胞下调可能通过免疫介导的损伤导致IMN的进展。
24 h尿蛋白是临床上判定特发性膜性肾病预后的指标,高24 h尿蛋白通常提示特发性膜性肾病患者预后不良。进一步的亚组分析,本研究发现Treg/Th17细胞失衡与24 h尿蛋白量呈线性相关,且Th17/Treg失衡程度与患者24 h尿蛋白量呈正相关,从而提示Th17/Treg失衡程度可能与疾病预后相关联。因此,以减少Th17/Treg引起的免疫失衡为目的免疫治疗可能对IMN患者有保护作用。
环孢素A是治疗膜性肾病的常用药物之一,可作为特发性膜性肾病的初始治疗,也在其他药物治疗无效时使用。其减少蛋白尿的主要机制是抑制免疫反应,选择性抑制T细胞活化,抑制IL-2的产生,同时抑制钙调磷酸酶,阻断其诱导的突触足蛋白脱磷酸作用,对肾脏足细胞的细胞骨架起到稳定作用,从而使蛋白降低[17]。目前报道[18]指出在自身免疫学疾病及器官移植术后CsA的使用对Th17/Treg存在重要影响,且可能与疗效有关。本研究通过检测特发性膜性肾病患者治疗前后体内Th17/Treg变化,发现有效组使用环孢素A治疗IMN患者后,患者体内Th17明显下降,Treg较治疗前明显升高,提示环孢素A可能通过调节机体Th17/Treg免疫失衡影响患者的疗效与预后。同时本研究还发现,环孢素A治疗无效组患者Th17/Treg变化不明显,提示Th17/Treg可作为判断病情缓解和预后的重要指标。但是,由于本研究样本量偏少,仍待进一步的大样本试验深入研究。
综上所述,特发性膜性肾病患者存在外周血Th17/Treg失衡,并且与病情严重程度相关;环孢素A治疗特发性膜性肾病可有效改善外周血Th17/Treg免疫失衡,其失衡改善程度与Th17/Treg失衡程度相关;监测特发性膜性肾病患者外周血Treg、Th17含量变化对指导病情评估及临床治疗疗效有重要意义。
参考文献:
[1] Kwatra IS,Prasher PK. Pathogenesis of membranous nephropathy: update[J]. J Assoc Physicians India,2013,61(11):807-810.
[2] ShiX,Qu Z,Zhang L,etal. Increased ratio of ICOS(+)/PD-1(+) follicular helper T cells positively correlates with the development of human idiopathic membranous nephropathy[J]. Clin Exp Pharmacol Physiol, 2016, 43(4): 410-416.
[3] Schmitt V,Rink L,Uciechowski P,etal. The Th17/Treg balance is disturbed during aging[J]. Exp Gerontol, 2013, 48(12): 1379-1386.
[4] JiaXY, Hu SY,Chen JL,etal. The clinical and immunological features of patients with combined anti-glomerular basement membrane disease and membranous nephropathy[J].ISN, 2014, 85(4): 945-952.
[5] Iannitti RG,Carvalho A,Cunha C,etal. Th17/Treg imbalance in murine cystic fibrosis is linked to indoleamine 2,3-dioxygenase deficiency but corrected by kynurenines[J]. Am J Resp Crit Care, 2013, 187(6): 609-620.
[6] Rosenzwajg M, Languille E, Debiec H,etal. B-and T-cell subpopulations in patients with severe idiopathic membranous nephropathy may predict an early response to rituximab[J]. Kidney Int, 2017, 92(1): 227-237.
[7] Sakai R,Taguri M,Oshima K,etal. A comparison of tacrolimus and cyclosporine combined with methotrexate for graft-versus-host disease prophylaxis, stratified by stem cell source: a retrospective nationwide survey[J]. Int J Hematol,2016,103(3):322-333.
[8] Tang B, Ren H, Liu H,etal.CCR5 blockade combined with cyclosporine A attenuates liver GVHD by impairing T cells function[J]. Inflamm Res, 2016, 65(11): 917-924.
[9] Mercadal L.Membranous nephropathy[J]. Nephrol Ther, 2013, 9(7): 507-517.
[10] 吴青,刘志红,汤曦,等.膜性肾病患者足细胞钙神经蛋白表达的检测及其临床意义[J].肾脏病与透析肾移植杂志,2010,19(1):3-11.
[11] Masutani K, Taniguchi M, Nakashima H,etal. Up-regulated interleukin-4 production by peripheral T-helper cells in idiopathic membranous nephropathy[J]. Nephrol Dial Transplant, 2004, 19(3): 580-586.
[12] 罗舒文.特发性膜性肾病患者外周血Th9、Th2、Treg免疫失衡及其与疾病活动的相关性研究[D].南宁:广西医科大学,2017.
[13] Kim BS, Nishikii H, Baker J,etal. Treatment with agonistic DR3 antibody results in expansion of donor Tregs and reduced graft-versus-host disease[J]. Blood, 2015, 126(4): 546-557.
[14] 孙秀丽,冯国徵,孙玲,等.肾病综合征患者尿足细胞与临床病理关系的分析[J].山西医科大学学报,2013,44(12):926-930.
[15] 刘莉莉,李学旺.Th17/Treg免疫平衡在特发性膜性肾病发病中的作用及环孢素A对其影响[D].北京:北京协和医学院,2011:1-139.
[16] 廉琳,马东红,郭明好,等.原发性膜性肾病患者外周血及肾组织Th17、Treg的变化及其意义[J].中国免疫学杂志,2016,32(11):1667-1671.
[17] Foxwell BM, Ruffel B.The mechanisms of action of cyclosporine[J]. Cardiol Clin, 1990, 8(1): 107-117.
[18] Herrmann SMS, Sethi S,Fervenza FC,etal. Membranous nephropathy: The start of a paradigm shift[J]. Curr Opin Nephrol Hypertens, 2012, 21(2): 203-210.

