原发性食管神经内分泌癌2例并文献复习
王海英,武希润,史美琴,张 超
(山西医科大学第二医院消化科,太原 030001;*通讯作者,E-mail:xirunwu66@126.com)
食管神经内分泌癌(neuroendocrine cancer of the esophagus,NEC)是一种较为少见的恶性肿瘤,其发病率约占食管恶性肿瘤的0.05%-5.9%[1]。由于其病因及发病机制不明,临床症状不特异,以及确诊困难等多种因素,致使相关的研究和报道少见。现报道2010-02~2017-02由山西医科大学第二医院收治的2例食管神经内分泌癌,并结合国内有关文献进行讨论。
1 临床病例
1.1 病例1
患者,男性,69岁,因间断呕血1年余,加重6 d于2013年5月25日就诊我院。2011年12月出现恶心、呕血,伴头晕、乏力,有出汗、心慌,无反酸、烧心,无腹痛、腹泻、黑便,行食管镜+胃镜:食管息肉,予抑酸、保护胃黏膜、补液、对症治疗后,病情好转出院。院外仍间断出现吞咽时哽噎感,以进食干硬食物时为著,无进行性发展。2013年5月20日再次因恶心、呕血、乏力行食管+胃肠镜,考虑食管息肉伴出血而入院。近1年体质量减轻约10 kg。吸烟50余年,约3支/d;饮酒20余年,2-3次/周,50-100 g/次,折合酒精量18 g/d。无食管疾病家族史。入院后查体:轻度贫血貌,全身浅表淋巴结未触及肿大,心肺腹部查体无明显阳性体征。化验血钾3.8 mmol/L,甲胎蛋白、癌胚抗原、糖链抗原199均为正常范围,其余常规化验未见明显异常。腹部彩超未见明显异常。胸部CT显示食管管壁局限性增厚,管腔狭窄。再次复查胃镜示:食管内距门齿27 cm处可见带蒂形球形肿物(见图1A)。病理活检:食管黏膜间质内可见恶性小细胞肿瘤组织(见图2A)。免疫组化:Syn(+),CgA(+),CD56(+),Ki-67>80%。结合患者临床症状、有关化验、检查,依据病理活检及免疫组化结果,明确诊断食管小细胞神经内分泌癌。患者一般情况尚可,胸部CT、腹部彩超均未见明显转移灶,可行内镜下治疗或胸科手术治疗,但患者表示拒绝内镜下或手术治疗,故后期未再随访。
1.2 病例2
患者,男性,75岁,主因腹痛20 d余,加重10 d于2017年2月23日就诊我院。2017年2月初出现腹痛,左上腹为主,进食后加重,伴后腰背部放射痛,夜间明显,无呕血、黑便,无乏力、纳差。2017年2月13日自觉腹痛进行性加重,呈持续性疼痛,予抑酸、调节脾胃功能、对症治疗后,腹痛仍不缓解而入院。1月内体质量减轻4 kg。平素吸烟史50余年,约10支/d;饮酒史50余年,折合酒精量16-32 g/d。无食管疾病家族史。入院后查体:体形消瘦,BMI 19.31 kg/m2,营养欠佳,全身浅表淋巴结未触及肿大,心肺未见明显阳性体征,腹部触诊,脐左上方压痛阳性。化验血钾3.37 mmol/L,癌胚抗原、甲胎蛋白、糖链抗原199均为正常范围,其余常规化验,如血常规、尿常规、便常规、肝转氨酶、胆红素、尿素氮、肌酐等均处于正常范围。腹部CT示:肝胃间隙占位,考虑恶性可能性大,不排除恶性间质瘤可能;肝实质内多发略低低密度影,考虑转移。胃镜示:食管内距门齿27-29 cm处可见隆起型肿物(见图1B);距门齿31-37 cm处可见溃疡性肿物。病理活检:食管内增生鳞状上皮下可见异型的小圆细胞浸润,伴坏死、溃疡形成(见图2B)。免疫组化结果:Ki-67>80%,CD56(+),Syn(+),CgA(+)(见图3)。结合患者临床症状、化验检查、内镜下表现,并联合病理及免疫组化结果综合分析,明确诊断食管小细胞神经内分泌癌。患者腹部CT可见多发转移,建议放化疗治疗,但患者拒绝放化疗治疗,后期未随访。

A.病例1,距门齿27 cm处可见2.8 cm×2.5 cm大小球形肿物,带蒂,表面颗粒样,充血糜烂,活动好,活检4块,质脆,易出血;B.病例2,距门齿27-29 cm处,可见2.0 cm×1.5 cm大小黏膜隆起,表面光整,钳触质韧,活动差图1 食管神经内分泌肿瘤的内镜下形态

A.病例1食管黏膜间质内可见恶性肿瘤细胞,部分肿瘤细胞聚集成团块状或巢状;B.病例2增生的鳞状上皮下可见异型的小圆细胞浸润,胞质少,伴坏死、溃疡形成图2 食管神经内分泌癌光镜下所见的病理活检(HE,×100)
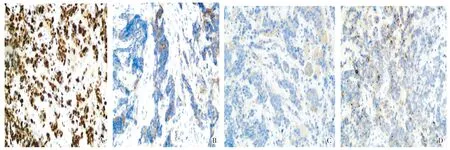
A. Ki-67B. CD56C.SynD. CgA图3 食管神经内分泌癌(病例2)中Ki-67、CD56、Syn、CgA的表达(En Vision法,×200)
2 讨论
2.1 国内有关食管神经内分泌肿瘤的文献复习
自1952年首次报道食管神经内分泌肿瘤(neuroendocrine neoplasms of the esophagus,NEN)至今,国内有关文献仅报道1 000余例,其中由中国知网、万方医学、维普收录的2010-2017年有关食管神经内分泌肿瘤的文献27篇,病例920例。男性患者579例,女性患者341例,男女比例约1.7 ∶1。发病年龄小于50岁者约占0.2%,50-60岁者约占15.5%,61-70岁者约占81.9%,大于70岁者占2.3%,病变部位约有89.7%(628/702)位于食管中下段,临床表现以吞咽困难、咽下疼痛为首发症状的约114例,伴有体质量减轻者3例,其余表现有腹痛3例,声音嘶哑2例,黑便2例,纳差1例。病理活检以Ki-67指数大于20%的神经内分泌癌为多,占879例,其中单纯小细胞型872例,约占食管内分泌肿瘤的94.8%。免疫组化显示突触素(Syn)阳性率85.2%(259/304)、CD56阳性率84.9%(219/258)、嗜铬粒蛋白A(CgA)阳性率60.5%(158/261)、神经元特异性烯醇酶(NSE)阳性率82.9%(116/140)。
2.2 食管神经内分泌肿瘤的发病机制
关于食管神经内分泌肿瘤的发病及作用机制尚不明确。据推测,NEN来源于内胚层内的基底细胞,鳞状细胞或具有相同作用的黏膜腺体细胞的多分化[2],发病机制可能与某些基因的异常表达和酶学的信号传导通路改变有关[3]。有研究表明,年龄、性别、发病部位、生活习惯对于食管NEN的发病有一定的影响。发病年龄高峰期为60-70岁,以男性居多,男女比例约3 ∶1[3、4],病变多发于食管中下段,这可能与中远端食管的神经内分泌细胞的黏膜腺体最为密集有关[5],并且以长期吸烟、饮酒者更为多见[3]。
2.3 食管神经内分泌肿瘤的临床表现
食管神经内分泌肿瘤的临床症状无特异性,主要表现为进行性吞咽困难,伴有胸骨后疼痛,其他不典型症状包括腹部不适,体重减轻和黑便,有少数研究显示有激素分泌异常综合征,如抗利尿激素分泌过多,具有低钾血症的水样腹泻和盐酸缺乏症等[3]。
2.4 食管神经内分泌肿瘤的诊断与鉴别诊断
食管神经内分泌肿瘤的诊断和鉴别诊断较为复杂,首先是在内镜下观察到隆起型或带蒂息肉样、溃疡型、蕈伞型肿物。这与食管良性肿瘤,如平滑肌瘤、食管息肉,以及食管恶性肿瘤,如鳞癌、腺癌,从肉眼上难以区分,需进一步依靠病理组织学的结果[6]。
根据WHO关于神经内分泌肿瘤的病理学分类(2016)[7],将NEN分为神经内分泌瘤(NET)G1级与G2级、神经内分泌癌(NEC)G3级、混合性腺神经内分泌癌(MANEC)、增生性和肿瘤前病变。神经内分泌瘤(NET)G1级:核分裂像计数<2和Ki-67阳性指数≤2%;神经内分泌瘤(NET)G2级:核分裂像计数2-20和Ki-67阳性指数3%-20%;神经内分泌癌(NEC)G3级:核分裂像计数>20,Ki-67阳性指数>20%。NEC又可分为小细胞NEC和大细胞NEC,当两种细胞均存在,则为混合型NEC,临床上以小细胞NEC为多[8]。食管小细胞NEC多聚集成团块状或巢状[9],细胞为圆形、椭圆形和梭形,细胞边界模糊,胞质少,有细颗粒状的染色质胞核,核质脆,缺乏主要核仁,坏死面积大,有丝分裂率高[10]。相比之下,大细胞NEC呈小梁状、网格状或栅栏状排列,细胞体积大,呈多角形,边缘不规则,嗜碱性胞质,染色质呈粗颗粒状,核浆比较小,核浆/细胞质比低,囊泡染色质内核仁突出[11,12]。免疫组化检查中神经元特异性烯醇酶(NSE)、突触素(Syn)、CD56和嗜铬粒蛋白A(CgA)的检查有助于食管NEN的诊断。
2.5 食管神经内分泌肿瘤的治疗
对于食管NEN的治疗,未出现远处转移,或者仅有邻近区域淋巴结转移的患者,目前可通过手术局部切除[13]。对于有淋巴结转移或远处转移患者,采用术前或术后配合化疗、放疗。因食管NEN的侵袭性高,且早期即可转移的特性,手术联合放化疗是较为理想的治疗方案[14]。
参考文献:
[1] 李同飞,万云云.食管小细胞神经内分泌癌的诊断与治疗[J].社区医学杂志,2012,10(21):8-9.
[2] Morita M, Saeki H, Nakaji YU,etal. Conversionto neuroendocrine carcinoma from squamous cell carcinoma of the esophagus after definitive chemoradiotherapy[J]. Anticancer Res,2016, 36:4045-4050.
[3] 曹磊,田向永,李果,等.原发性食管神经内分泌癌的诊断进展[J].医学综述,2017,23(16):3179-3183.
[4] 顾向森,周悦,王伟,等.食管神经内分泌癌41例临床特点及预后分析[J].中国胸心血管外科临床杂志,2016,23(10):978-981.
[5] Lee CG, Lim YJ, Park SJ. The clinical features and treatment modality of esophageal neuroendocrine tumors: a multicenter study in Korea[J]. BMC Cancer, 2014, 14:569.
[6] 袁柏思,金鑫鑫,刘炯,等.食管神经内分泌癌:临床病例回顾性分析[J].胃肠病学,2014,19(3):139-142.
[7] 徐建明,杨晨.胃肠胰腺神经内分泌肿瘤国际诊断共识的解读[J].临床肿瘤学杂志,2011,16(11):1033-1038.
[8] Vos B, Rozema T, Miller RC,etal. Small cell carcinoma of the esophagus: a multicentre rare cancer network study[J]. Dis Esophagus, 2011, 24(4): 258-264.
[9] 何黄河,刘锦源,薛磊,等.原发性食管小细胞神经内分泌癌21例临床分析[J].南京医科大学学报(自然科学版),2016,36(9):1101-1103.
[10] Nevórez A,Saftoiu A,Bhutan MS.Primary small cell carcinoma of the esophagus: clinico-pathological features and therapeutic options[J]. Curr Health Sci J, 2011, 37(1):31-34.
[11] Tustumi F, Takda FR, Uema RH,etal.Primary neuroendocrine neoplasma of the esophagus:report of 14 cases from a single institute and review of the literature[J]. Arq Gastroenterol, 2017, 54(1):4-10.
[12] KuriryH, Swied AM. Large-cell neuroendocrine carcinoma of the esophagus: a case from Saudi Arabia[J]. Case Rep Gastroenterol, 2015, 9:327-334
[13] Li AF,Li AC,Hsu CY,etal. Small cell carcinomas in gastrointestinal tract: immunohistochemical and clinicopathological features[J].J Clin Pathol, 2010, 63(7):620-625.
[14] Usami S, Motoyama S, Maruyama K,etal. Small cell carcinoma of the esophagus treated with esophagectomy and following chemotherapy: case report with review of the literature[J]. Eur Surg Res, 2010, 45(1): 41-44.

