桃叶卫矛花粉超低温保存
李万义, 孔 鑫, 韩亚洁, 宋 红
(东北林业大学园林学院,黑龙江哈尔滨 150040)
桃叶卫矛(Euonymusbungeanus),别称白杜、丝绵木,是卫矛科卫矛属的一种落叶小乔木,是我国常见的观赏类庭园树种之一。桃叶卫矛叶形秀丽,植株繁茂,包被有红色假种皮的果实可长期宿存于枝头,到了冬季,白雪红果相映,十分美丽,在冬季可为季相色彩单调的北方园林增添了不少色彩。近年来,许多研究人员从多方面对桃叶卫矛进行了研究:温阳等通过对8个乡土树种抗逆性的对比研究发现,桃叶卫矛在耐寒、抗旱、抗风等方面具有良好的适应性[1];刘继阳等通过对桃叶卫矛果实中主要活性成分的提取并对这些成分进行研究发现,桃叶卫矛果实总皂苷对人肝癌细胞系SMMC、人宫颈癌细胞系HeLa和乳腺癌细胞系MCF7有明显的抑制生长作用[2];宋红等通过研究发现,桃叶卫矛种子粗脂肪中含有棕榈酸、硬脂酸、油酸和亚油酸等脂肪酸[3];还有研究发现,桃叶卫矛木材细腻坚韧,可用于雕刻、制作帆杆或滑车等,其种子可作药用,用于治疗膝关节痛、漆疮等疾病[4]。由此可见,桃叶卫矛是一种集工业、药用、观赏应用于一身的植物,具有较高的推广价值。随着近年来各种极端气候的出现以及人为因素对生态环境的破坏,如何对桃叶卫矛的种质资源进行妥善保存是今后的研究方向。若采用传统的保存方法,如就地保存、迁地保存等, 极易使种质资源受到病菌或虫害的影响,
进而给种质资源的保护造成极大障碍,因此,寻求一条经济、高效、便捷的种质资源保存途径迫在眉睫。
植物种质资源超低温保存是指将植物细胞、组织或器官在液氮(-196 ℃)的超低温条件下进行保存,在如此低的温度下,植物材料中参与新陈代谢的各种生物酶的活性受到极大抑制,生物体新陈代谢基本停止,处于“假死”状态,利用该方法可以实现植物种质资源的永久保存[5]。目前已经成功进行超低温保存的材料类型有种子、休眠芽、茎尖分生组织、花粉、合子胚(胚轴)、体细胞胚、悬浮细胞、愈伤组织、原生质体等[6]。其中花粉超低温保存操作简单,可保持特定的基因型,解决杂交育种时的花期不遇或地理隔离等问题,也可有效解决每年采集花粉时担心与其他品系花粉混合的问题。因此,本试验将对桃叶卫矛的花粉进行超低温保存,通过对花粉最适萌发培养基配比、培养条件、培养时间、超低温保存最适含水量以及超低温保存后的化冻方式进行探究,以期为今后桃叶卫矛种质资源保存及其新品种培育的深入研究提供理论依据。
1 材料与方法
1.1 试验材料
本试验地点设在适宜桃叶卫矛生长的黑龙江省哈尔滨市东北林业大学校园内。哈尔滨市的气候属中温带大陆性季风气候,冬长夏短,全年平均降水量为569.1 mm,降水主要集中在6—9月份,夏季占全年降水量的60%,集中降雪期为每年11月至次年1月。四季分明,冬季1月平均气温约为 -19 ℃,夏季7月的平均气温约为23 ℃[7]。桃叶卫矛为聚伞花序腋生,每个花序有3~15朵花,花两性,为黄绿色,花期为5月下旬至6月[8]。本试验从2015年6月开始,选择晴朗天气,从生长发育良好的桃叶卫矛母树上用镊子采集新鲜花粉,采集完毕后装入硫酸纸袋后拿回实验室。
1.2 试验方法
1.2.1 花粉生活力测定方法 花粉生活力是衡量花粉健康与否的重要指标,目前对于花粉生活力的表述有生活力(viability)、可染性(stainability)、花粉质量(pollen quality)、活力(vigour)、萌发力(germinability)、可育性(fertility)、受精力(fertilization ability)[9]。根据前人的研究进展以及预试验结果分析,本试验选用可染性和萌发力2项指标。可染性的测定采用氯化三苯基四氮唑(简称TTC)染色法,参照韩成刚等对芍药花粉生活力的测定方法[10],将一定量的0.5% TTC溶液注入1块凹载片的凹穴中(液面不超过凹穴的最大深度),用解剖针将花粉均匀地撒在溶液上面。将该凹载片放置在铺有湿润滤纸的培养皿内,然后将其放入25 ℃人工气候箱中进行黑暗培养,6 h后取出凹载片,放在电子显微镜下观察花粉染色情况,选取3个视野,统计被染色花粉占视野内全部花粉总数的比例。萌发力的测定采用悬滴萌发法[11],首先将1滴花粉萌发培养液(少于200 μL)滴在方形盖玻片上,然后将桃叶卫矛花粉用解剖针均匀地撒在培养液上,再将盖玻片反转放置在凹载片上,使花粉悬浮于培养液上,如图1所示。将凹载片缓缓放入铺有湿润滤纸的培养皿内,防止由于转移过程中产生的摇晃使得培养液与凹载片接触。将培养皿放入 25 ℃ 人工气候箱中培养一段时间后,将凹载片取出,放置在电子显微镜下观察并统计萌发的花粉数。花粉管长度超过花粉直径即为萌发花粉。每次随机选取3个视野,统计视野内萌发花粉数占花粉总数的百分比,最后取平均值,作为该花粉的萌发率。

1.2.2 花粉萌发最适培养液的选择 以桃叶卫矛花粉为材料,以去离子水作为溶剂,加入不同浓度的蔗糖、硼酸,采用2因素完全随机的方法,共设计16种不同培养基(表1)。在培养液上均匀地撒播桃叶卫矛花粉,然后将其放置在25 ℃人工气候箱中光照培养一段时间后观察花粉萌发状况,根据花粉的萌发率确定桃叶卫矛花粉萌发的最适培养液。
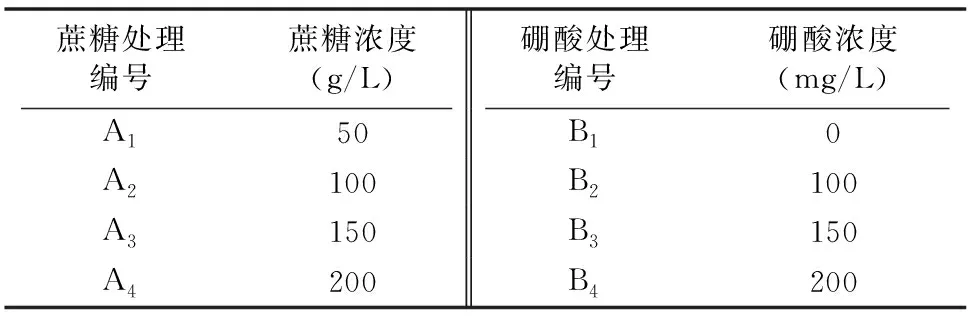
表1 因素水平设计
1.2.3 不同培养时间及培养环境对花粉萌发率的影响 以桃叶卫矛花粉为材料,将其均匀地撒播在筛选出的最适培养液上,然后分成2组,置于室温条件下,1组放在光照下培养,另1组放于暗处培养,培养0.5、1.0、1.5、2.0、2.5、3.0 h后,观察并记录花粉萌发状况。
1.2.4 花粉日活力的变化 从桃叶卫矛开花的一天中选定不同的时段,即06:00、08:00、10:00、12:00、14:00、16:00、18:00,每隔2 h测1次花粉活力 (萌发率),观察一天中花粉活力的日变化。
1.2.5 超低温保存后不同化冻方式对桃叶卫矛花粉萌发率的影响 将新鲜花粉装入1.8 mL冷冻管中,花粉含量不超过冷冻管最大体积的2/3。投入液氮罐中至少保存1 h以上后取出,采用以下3种不同的化冻方式进行解冻:(1)室温化冻30 min;(2)40 ℃水浴化冻2 min;(3)自来水化冻8 min。化冻完毕后对花粉的生活力进行测定,比较花粉的萌发率,选出最适化冻方式。
1.2.6 桃叶卫矛花粉超低温保存 (1)不同含水量花粉的制备。首先采用烘干法测得桃叶卫矛花粉的最大含水量,具体方法如下:将称量瓶放入烘箱中,将温度调至105 ℃,烘至恒质量,称量得数据ma,放入花粉再称量,得数据mb(即样品烘干前鲜质量);然后放入烘箱内,在5~10 min内将温度调至105 ℃,开始计时,于105 ℃ 2 h烘干后取出瓶盖封口,放入干燥器,冷却20~30 min,取出称质量,然后再敞开瓶盖,在105 ℃条件下烘烤40~60 min,反复2~3次,直到质量恒定,得数据mc,即样品烘后干质量,以鲜质量为基数,根据如下公式计算花粉含水量:
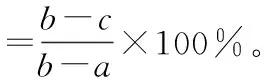
(1)
在得到桃叶卫矛花粉最大含水量ω1后,利用硅胶干燥法进行花粉不同含水量梯度的配制。具体方法如下:称取一定量的新鲜花粉ma,放入1.8 mL冷冻管中,然后称取二者总质量mb,再然后将装有花粉的冷冻管放入硅胶干燥器中,干燥一定时间后取出冷冻管,称取其质量mc,根据公式(2)计算出该段时间损失的含水量ω2,最终测得干燥一定时间后的花粉含水量ω,以此类推进而得到不同含水量梯度的花粉。相关公式如下:
(2)
ω=ω1-ω2。
(3)
(2)根据上述方法将花粉调制成不同含水量梯度后,将其投入液氮罐中保存一段时间后取出,化冻后测定桃叶卫矛花粉的萌发率。
1.2.7 数据分析 采用SPSS 20.0和Excel软件对所测数据进行统计分析,用Excel对所得数据进行统计画图。
2 结果与分析
2.1 桃叶卫矛花粉染色法的结果分析
经过TTC染色后,在显微镜下没有观察到被染成红色的花粉粒,可见该方法不适合用于桃叶卫矛花粉活力的测定。这与杨秀莲等研究桂花花粉活力时得出的研究结果一致[12],因此本研究中桃叶卫矛花粉活力的测定选用离体悬滴萌发法。
2.2 桃叶卫矛花粉萌发最适培养液的选择
从表2可以看出,桃叶卫矛花粉在不同配方的培养液中萌发情况有差异。花粉在蔗糖浓度为100 g/L时萌发率达到最高值。而随着蔗糖浓度的进一步增加,花粉的萌发率又降低。对桃叶卫矛花粉在不同蔗糖和硼酸浓度培养基上的萌发率进行方差分析,由表3可以看出,花粉的萌发率在不同的蔗糖浓度间(F=78.428,P<0.01)、硼酸浓度×蔗糖浓度间(F=23.243,P<0.01)以及不同硼酸浓度间(F=10.047,P<0.01)差异都极显著。从两者贡献的离差平方和来看,蔗糖对花粉萌发率的影响大于硼酸对花粉萌发率的影响,即蔗糖贡献的离差平方和(630.190)大于硼酸贡献的离差平方和(80.733)。结合桃叶卫矛花粉的萌发率,最终本研究筛选出桃叶卫矛花粉培养液中蔗糖浓度和硼酸浓度最适配比为 100 g/L 蔗糖+150 mg/L硼酸。
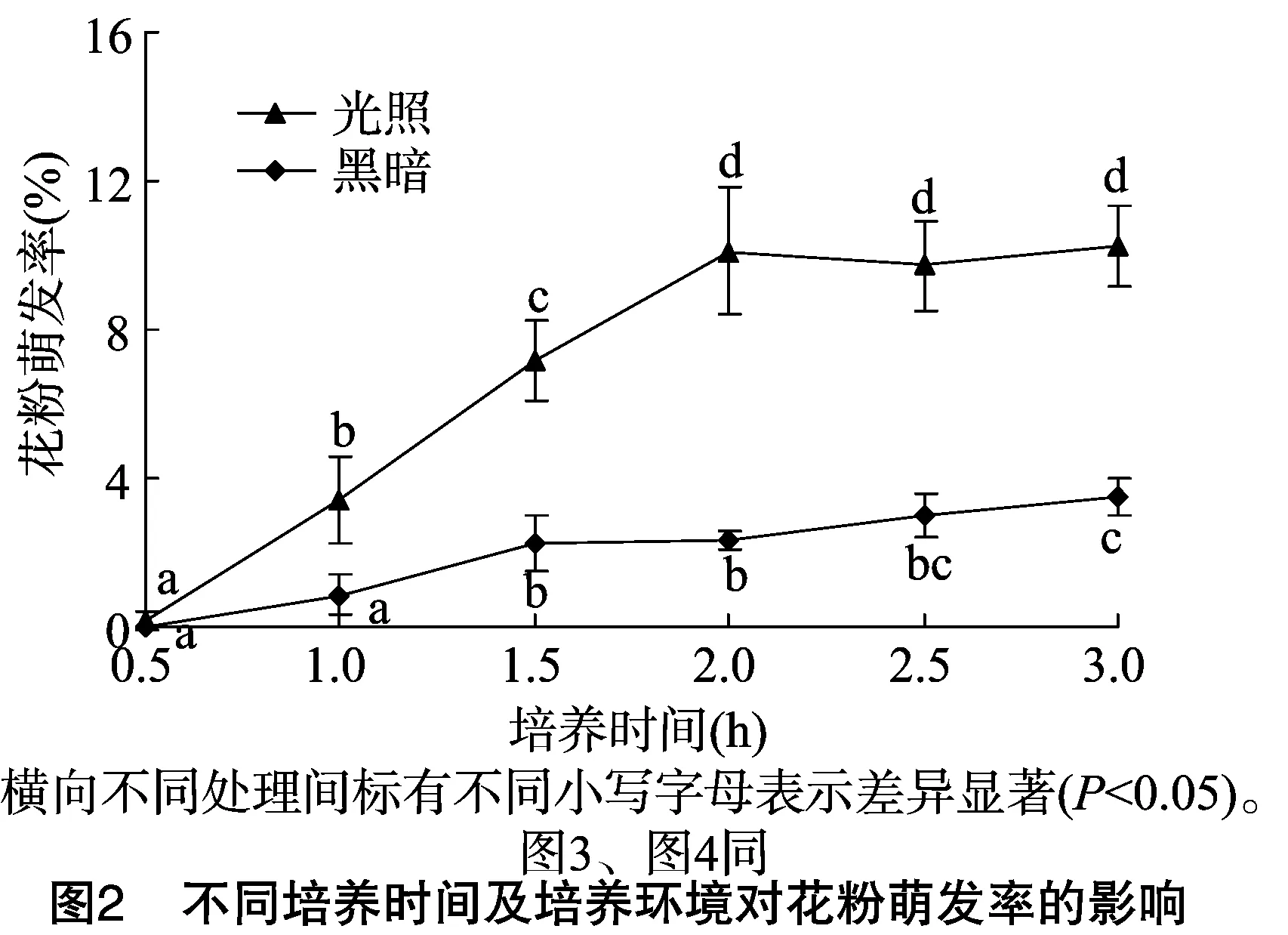
2.3 不同培养时间及培养环境对桃叶卫矛花粉萌发率的影响
从图2可以看出,桃叶卫矛花粉在不同培养环境下的萌发率有明显的差异,其中在光照条件下萌发率最高可达10.22%,而在黑暗条件下的最高萌发率为3.5%,因此对于桃叶卫矛花粉的培养应在光照条件下进行。进一步通过方差分析可知,F=21.273,对应的P<0.01,可以认为6个培养时间中至少有1个培养时间与其他培养时间之间存在显著差异。利用多重比较(LSD)分析可知,光照条件下0.5、1.0、1.5、2.0 h与其他培养时间存在显著差异,而2.0、2.5、3.0 h之间没有显著差异。由图2可知,花粉前2.0 h的培养时间内,其萌发率有逐渐升高的趋势,而在2.0 h后该趋势进入较为平稳的阶段,花粉萌发率不再有明显的变化幅度。由此推测,桃叶卫矛花粉最佳的培养时间为2.0 h。在试验中还发现,当培养时间过长时, 花粉的萌发数量不再增加,但花粉管的长度在不断伸长,最终会影响试验结束后对花粉萌发数量的统计,这与陈珊对亮叶蜡梅花粉进行活力测定时通过暗培养24 h后进行观察统计的结果不一致[13],推测引起该结果的原因为植物基因型的差异。
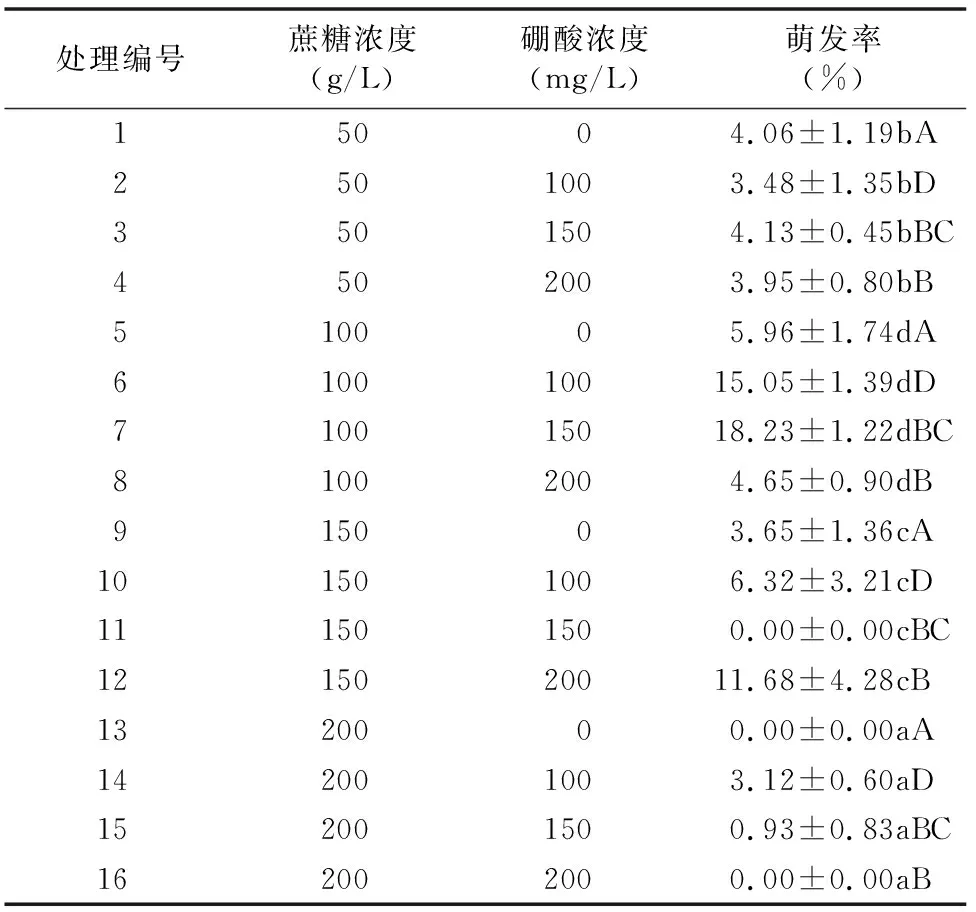
表2 不同蔗糖和硼酸浓度对桃叶卫矛花粉萌发率的影响
注:数值为每个处理3个重复的“平均值±标准差”。同列数据后不同小写、大写字母分别表示差异显著、极显著。
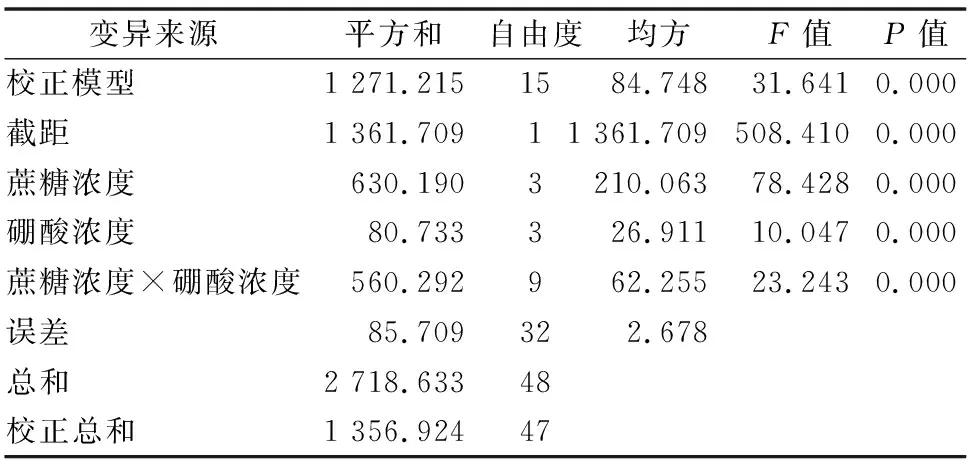
表3 不同蔗糖和硼酸浓度下桃叶卫矛花粉萌发率的方差分析结果
注:双因素方差分析置信区间为95%。P<0.05表明显著,P<0.01表明极显著。
2.4 桃叶卫矛花粉日活力变化的结果分析
由图3可知,桃叶卫矛的花粉萌发率(活力)在一天中的不同时段是不同的,其大致趋势为06:00—12:00时段为下降趋势,在12:00花粉活力降至最低值;而在12:00—16:00时段花粉活力呈上升趋势,并在16:00达到最高值;在16:00—18:00时段,花粉活力逐步下降。通过方差分析可以看出,F=30.119,对应的P=0.00(<0.05),可以认为在7个时刻中至少有1个时刻与另外1个时刻存在显著差异。通过进一步多重比较分析可知,12:00与16:00与其他各时刻基本存在显著差异。因此可知,桃叶卫矛花粉在一天中12:00时的活力最低,在16:00时的活力最高,这与李稚的研究结果一致[14],可能是因为桃叶卫矛花粉在外界环境温度较高时,花粉自身的酶活性降低,影响了其萌发力。
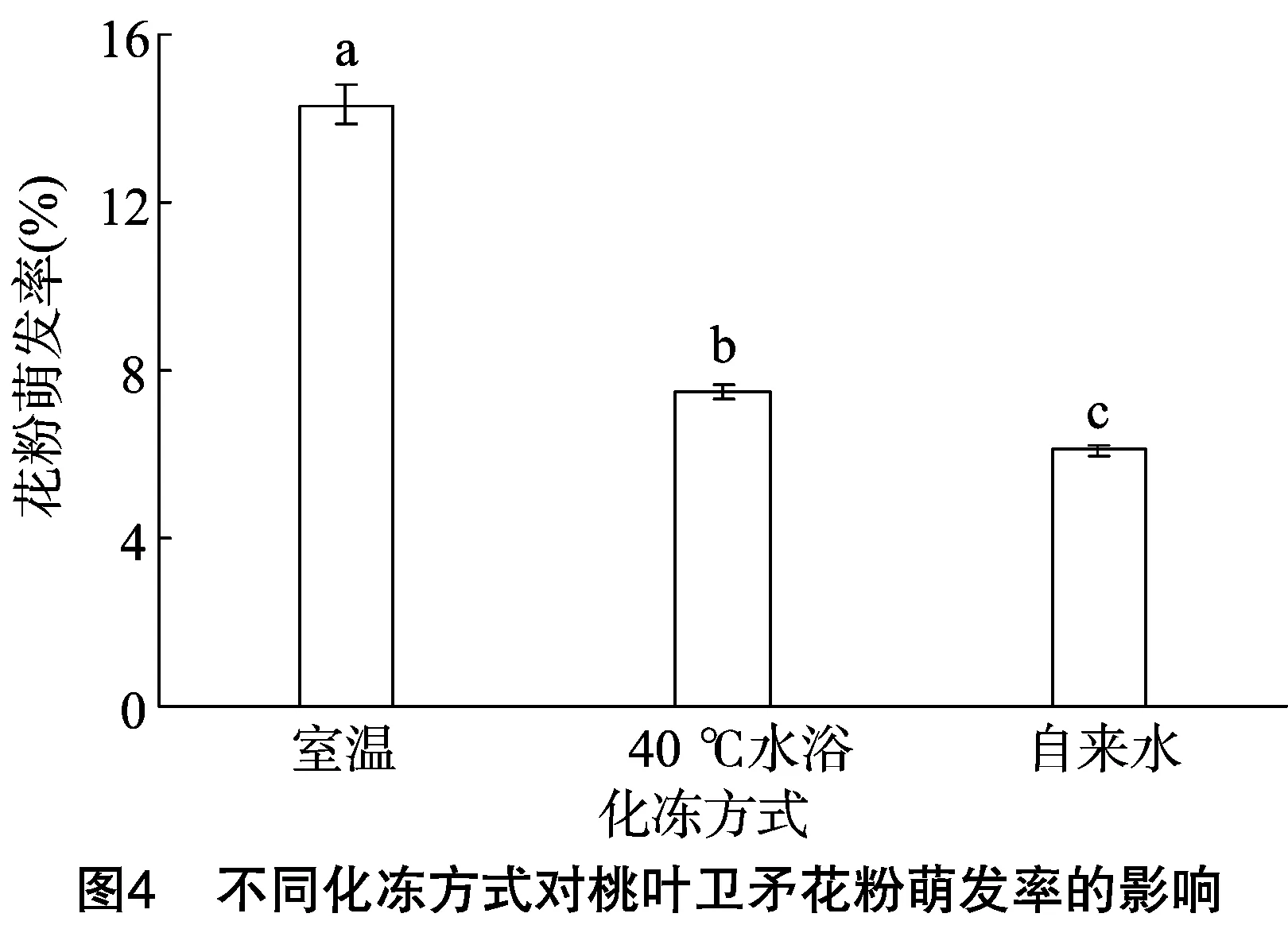
2.5 不同化冻方式对桃叶卫矛花粉萌发率的影响
本试验采用3种化冻方式于桃叶卫矛花粉超低温保存24 h后进行化冻试验,比较3种化冻方式对花粉萌发率的影响,最终筛选出最佳化冻方式。由图4可知,化冻方式对保存后的桃叶卫矛花粉萌发率有极显著影响(F=613.430,P=0.00<0.01),采用室温化冻30 min后,桃叶卫矛的花粉萌发率可达14.34%,其效果优于40 ℃水浴化冻2 min和自来水化冻8 min这2种化冻方式。由此可以推测,室温化冻 30 min 的化冻效果较好,可以将其运用于下一步的桃叶卫矛花粉超低温保存试验中。
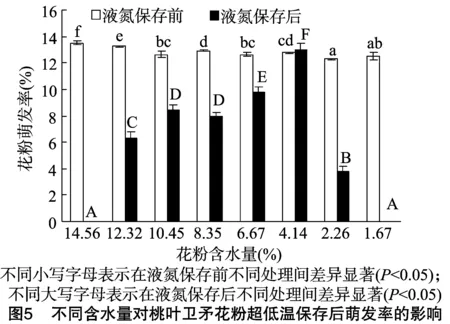
2.6 不同含水量花粉超低温保存前后的萌发率
脱水环节对花粉的超低温保存是至关重要的,花粉含水量越高,低温冷藏时细胞内越易形成冰晶,以致细胞膜受损,保存后的花粉死亡率就会越高,不能达到超低温保存的目的。因此,探究花粉液氮保存前最适含水量对于花粉超低温保存具有重要影响。由图5可以看出,不同含水量的桃叶卫矛花粉在液氮保存前的萌发率没有显著差异,当花粉经过液氮保存后,出现了显著差异。当桃叶卫矛花粉含水量为初始状态(14.56%)时,液氮保存后的花粉全部死亡,推测是由于花粉内部含水量较高,在-196 ℃的超低温环境中产生了冰晶,进而破坏花粉内部的细胞结构,导致花粉死亡。随着花粉含水量的进一步降低,在4.14%~12.32%的含水量区间内,超低温保存后的花粉萌发率呈现随含水量降低逐步升高的趋势。而当花粉含水量进一步从4.14%降低至1.67%时,超低温保存后的花粉萌发率又开始降低,并最终全部死亡,可能是因为进一步的干燥对花粉细胞内的束缚水造成了破坏,最终使花粉死亡。这与张玉进等的研究结果[15]一致。
3 讨论
园林植物种质资源的类型有很多,如种子、花粉、茎尖等,而评价这些种质资源好坏的关键因素就是其生活力指标。根据王钦丽等的研究结果可知,花粉生活力的测定方法目前可分为萌发测定和不萌发测定2种[9]。本研究选用了2种测定方法相结合,对桃叶卫矛花粉的生活力进行测定。试验结果表明,经TTC染色法染色后的花粉没有变红的现象,而经离体萌发法测定后,桃叶卫矛花粉的花粉管有了明显的伸长,由此可知TTC染色法不适合用来检测桃叶卫矛花粉的生活力。
蔗糖和硼酸对于花粉萌发具有十分重要的作用。研究表明,蔗糖在花粉萌发过程中主要有2个方面的作用:一是保持了花粉细胞与外部培养液之间的渗透平衡,防止花粉及花粉管由于渗透失衡而出现破裂;二是可以给花粉的萌发以及花粉管的伸长提供能量。而硼酸在花粉萌发过程中的主要作用是促进花粉内部钙离子的输送,同时帮助花粉更大程度地吸收糖分,产生糖-硼酸复合体,对营养物质的运输以及花粉萌发起到促进作用[16-18]。本试验研究了蔗糖、硼酸双因素作用下对花粉萌发的影响,结果表明,二者对花粉萌发率的影响都呈现出随着浓度的不断升高,桃叶卫矛花粉萌发率先升高后降低的规律。同时方差分析的结果表明,无论是蔗糖、硼酸的单因素作用,还是两者共同作用,都对花粉的萌发起着显著作用,说明桃叶卫矛花粉的萌发培养液需要蔗糖和硼酸。进一步比较可知,二者共同作用时,桃叶卫矛花粉的萌发率要优于二者的单因素作用。最终筛选出桃叶卫矛花粉萌发的最适培养液配方为100 g/L蔗糖+150 mg/L硼酸。
花粉的萌发主要是由内因和外因共同决定的。内因是指花粉自身的基因型,而外因是指环境因素。本试验中研究了桃叶卫矛花粉在不同培养时间以及不同培养环境中的萌发情况。结果显示,桃叶卫矛花粉在光照环境下的萌发率要大于黑暗环境下的萌发率。而有的木本植物的花粉如亮叶蜡梅,需要在黑暗环境下进行培养,推测其原因是由花粉自身的基因型决定的。而对于花粉的培养时间,不同的植物材料其花粉的培养时间也不同,有些植物花粉的培养时间需要3 h,如魔芋、山茶[15,19],而亮叶蜡梅的花粉培养时间需要长达 12 h[13]。本试验结果表明,桃叶卫矛花粉的最佳培养时间为 2 h,当培养时间大于2 h后,花粉的萌发率将不再有较为明显的变化。此外还发现,当培养时间过长时会导致花粉管过长,不利于后期统计萌发率。
赵剑颖等的研究表明:一天中万寿菊的花粉活力呈先升高后降低的趋势,在11:00—13:00之间花粉活力最高[20]。而在本研究中桃叶卫矛花粉在盛花期中的某天内的活力变化趋势为先降低后升高,在12:00时花粉活力最低,而在16:00时花粉活力最高。这与李稚在研究桂花花粉日活力变化时的研究结果一致[14],可能是由于夏季日最高气温集中在中午,过高的气温使得花粉内部的酶活性降至较低的水平,从而导致花粉萌发率降低。综上所述,桃叶卫矛花粉最佳采集时期为一天中的16:00。
化冻方式是影响花粉超低温保存效果的又一个重要的因素,如果采用了不适当的化冻方式,有可能在化冻过程中细胞内部产生次生冰,对花粉造成二次伤害,从而影响其花粉活力。目前主要的化冻方式大致可以分为35~40 ℃水浴化冻、自来水化冻、室温化冻。因此在本试验中对应研究了桃叶卫矛花粉超低温保存后采用40 ℃水浴化冻2 min、自来水冲洗8 min、室温化冻30 min 3种方式进行化冻。结果显示,室温化冻30 min是超低温保存桃叶卫矛花粉的最佳化冻方式。目前较为广泛的化冻方式为35~40 ℃水浴化冻,而该试验结果与其他植物花粉超低温保存化冻方式有所区别[13-15,19],因此,对于选择何种方式进行化冻应根据具体植物的花粉情况来决定。
新鲜的花粉含水量一般都比较高,过高的含水量在冷冻过程中形成冰晶,导致细胞膜受损,最终使花粉死亡。因此许多研究表明,适宜的花粉含水量是实现超低温保存的关键[21-23]。然而由于花粉形态的特殊性和采集的难度,如果采用传统的烘干法会消耗大量的花粉[24],因此本试验中采用室温硅胶干燥法,先测出新鲜花粉的最大含水量,然后通过将花粉放入硅胶干燥器中干燥不同时间,产生一定的质量差,而这个质量差即花粉在该干燥时间内失去的水分质量,求出失去水分占原花粉质量的比例,再用最大含水量减去失去水分的比例,即可求得花粉的含水量,这样既可以得到所需的花粉含水量,又可以避免烘干法测定花粉含水量时的高温环境使花粉丧失活性。利用该方法制备得到不同含水量梯度的桃叶卫矛花粉后,将这些花粉进行超低温保存并解冻,测定花粉萌发率显示,桃叶卫矛花粉超低温保存的最适含水量为4.14%。
桃叶卫矛属两性花,在本试验中发现,桃叶卫矛的雄花容易受到外界恶劣气候的影响,导致出现花期不遇、结实率低的问题,而通过花粉超低温保存可以有效解决这样的问题。此外,桃叶卫矛花粉超低温保存还可以为其杂交育种提供优良的花粉,为进一步培育新品种提供了一条有效途径。
参考文献:
[1]温 阳,杨文彬,阎栓喜,等. 8个乡土树种抗逆性对比研究[J]. 干旱区资源与环境,2006,20(4):204-208.
[2]刘继阳,于新海,刘 莹,等. 桃叶卫矛中营养元素的分析测定[J]. 微量元素与健康研究,2014,31(3):37-38.
[3]宋 红,李万义,丁格根其尔,等. 不同贮藏方法对桃叶卫矛种子萌发和营养物质的影响1)[J]. 东北林业大学学报,2015(6):30-33,63.
[4]陈有民. 园林树木学[M]. 北京:中国林业出版社,2007:527.
[5]Engelmann F. Plant cryopreservation:progress and prospects[J]. In Vitro Cellular & Developmental Biology-Plant,2004,40(5):427-433.
[6]陈晓玲,张金梅,辛 霞,等. 植物种质资源超低温保存现状及其研究进展[J]. 植物遗传资源学报,2013,14(3):414-427.
[7]刘玉莲,周海龙,苍蕴琦. 四季分明是哈尔滨气候的显著特征[J]. 黑龙江气象,2003(4):21,28.
[8]卢 曦. 卫矛属二种植物比较解剖学研究[D]. 长春:吉林农业大学,2008.
[9]王钦丽,卢龙斗,吴小琴,等. 花粉的保存及其生活力测定[J]. 植物学通报,2002,19(3):365-373.
[10]韩成刚,盖树鹏. 芍药花粉活力测定方法的研究[J]. 江苏农业科学,2012,40(5):124-126.
[11]刘 伟,丁长春,沐建华. 淡黄花百合花粉活力及其测定方法比较[J]. 江苏农业科学,2015,43(4):198-199.
[12]杨秀莲,向其柏. 桂花花粉活力测定与“晚籽银”桂柱头可授性分析[J]. 林业科技开发,2007,21(3):22-25.
[13]陈 珊. 蜡梅属植物花粉低温及超低温保存研究[D]. 武汉:华中农业大学,2005.
[14]李 稚. 桂花传粉生物学与杂交育种研究[D]. 南京:南京林业大学,2014.
[15]张玉进,张兴国,刘佩瑛. 魔芋花粉的低温和超低温保存[J]. 园艺学报,2000,27(2):139-140.
[16]张 颖,罗凤霞,年玉欣,等. 矮牵牛花粉生命力测定方法的研究[J]. 种子,2005,24(8):26-28.
[17]余义和,李桂荣,王新娟,等. 蔗糖和硼酸浓度对金光杏梅花粉离体萌发的影响[J]. 山西果树,2006,112(4):7-8.
[18]郭光明,张福锁,尚忠林,等. 硼对百合花粉萌发过程中细胞内游离钙离子的影响[J]. 中国农业大学学报,2002,7(5):32-37.
[19]李广清. 山茶花粉超低温保存研究[D]. 北京:北京林业大学,2005.
[20]赵剑颖,张华丽,张西西,等. 万寿菊花粉活力及柱头可授性研究[J]. 中国农学通报,2012,28(19):159-163.
[21]Lee C W,Thomas J C,Buchmann S L. Factors affectinginvitrogermination and storage of jojoba pollen[J]. Journal of the American Society for Horticultural Science,1985,110(5):671-676.
[22]刘 燕,张亚利. 梅花花粉的超低温保存研究[J]. 北京林业大学学报,2004(增刊1):22-25.
[23]姜忠国,董 丹,张 琪,等. 玉蝉花花粉生活力检测和超低温保存研究[J]. 安徽农业科学,2016(1):216-219.
[24]王小敏,李海燕,吴文龙,等. 蓬蘽花粉低温贮藏研究[J]. 江苏农业科学,2010(3):170-171.

