胸腺素α1对重症急性胰腺炎大鼠肺损伤作用的实验研究*
邱兆磊,王振杰,程峰,郑传明,李磊,姜海,杜召辉
(蚌埠医学院第一附属医院 急诊外科,安徽 蚌埠 233004)
重症急性胰腺炎(severe acute pancreatitis,SAP)是急性胰腺炎发展的重症阶段,常伴有重要脏器功能障碍,仍是并发症多、死亡率高的疾病之一[1]。急性肺损伤是(acute lung injury,ALI)是SAP常见且严重并发症,据统计SAP出现肺损伤等多脏器衰竭的死亡率高达54%。
胸腺素α1(Thymosinα1,Tα1)是一种细胞免疫增强剂[2],具有促进体内细胞因子的分泌以及淋巴细胞的功能,而Tα1对SAP大鼠相关肺损伤的作用国内外鲜见报道。本文通过复制SAP肺损伤大鼠动物模型,探讨Tα1在SAP大鼠肺脏损伤中的作用,观察肺组织病理以及肿瘤坏死因子α(tumor necrosis factor α,TNF-α)的变化,为探索SAP肺损伤相关机制和保护性治疗提供新策略。
1 材料与方法
1.1 实验动物与分组
清洁级成年雄性Sprague-Dawley(SD)大鼠24只,体重180~210 g,随机平均分为3组:对照组(A组)、SAP组(B组)和Tα1 干预组(C组),每组各8只。
1.2 SAP模型复制和处理
所有大鼠术前禁食12 h,自由饮水。吸入性麻醉药异氟烷(上海雅培制药有限公司)对大鼠进行麻醉,无菌条件下行腹正中切口入腹。A组大鼠入腹后仅翻动十二指肠及胰腺后即刻关腹;B组大鼠采用5%牛磺胆酸钠(0.1 ml/100 g,美国Sigma公司)经胆胰管逆行匀速缓慢注入(0.1 ml/min)复制SAP动物模型;C组大鼠在复制模型前0.5 h经腹皮下注射Tα1(6 mg/kg)(上海实业联合集团长城药业有限公司)。
1.3 观察指标与检测方法
分别于复制模型成功后12 h处死各组大鼠,经腹主动脉采血备用,取肺组织和胰腺组织用于光镜病理学检查。另一部分肺组织经液氮置入-80℃冰箱冷冻保存,用于检测肺组织细胞间黏附分子(intercellular adhesion molecule,ICAM-I)及TNF-α的蛋白表达。
1.3.1 各组大鼠血清淀粉酶检测 采用全自动生化分析仪检测各组大鼠血清淀粉酶水平。
1.3.2 胰腺组织和肺组织病理学检查 ①病理学检查:胰腺、肺组织标本以10%甲醛溶液常规固定、石蜡包埋、苏木素-伊红染色。②Western blot法检测肺组织ICAM-I蛋白和TNF-α蛋白表达情况。
1.4 统计学方法
数据分析采用SPSS 16.0统计软件,计量资料以均数±标准差(±s)表示,比较采用方差分析和q检验,P<0.05为差异有统计学意义。
2 结果
2.1 血清淀粉酶及肺湿干比比较
3组血清淀粉酶及肺湿干比(W/D)比较,差异有统计学意义(P<0.05),C组与B组比较,C组降低(q=12.133,P=0.000),B组与A组比较,B组升高(q=35.688,P=0.000)。见表1。
2.2 胰腺、肺脏组织病理改变
B、C组胰腺组织可见腺泡水肿、炎症细胞浸润,有的间质坏死,损伤较A组重;而C组胰腺组织损伤较B组减轻;A组胰腺组织未见明显病理改变。见图1~3。
B、C组肺组织间质炎症细胞的浸润、水肿,损伤较A组加重;C组肺组织损伤较B组减轻;A组肺组织未见明显病理改变。见图4~6。
表1 3组大鼠血清淀粉酶及肺W/D比较 (n=8,±s)
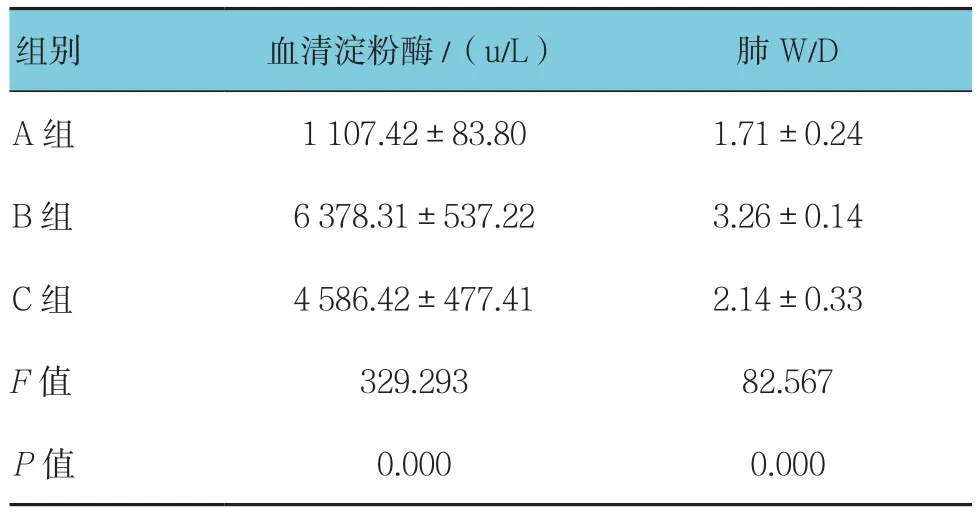
表1 3组大鼠血清淀粉酶及肺W/D比较 (n=8,±s)
组别 血清淀粉酶/(u/L) 肺W/D A组 1 107.42±83.80 1.71±0.24 B 组 6 378.31±537.22 3.26±0.14 C 组 4 586.42±477.41 2.14±0.33 F值 329.293 82.567 P值 0.000 0.000
2.3 各组肺组织ICAM-1和TNF-α蛋白表达比较
3组肺组织ICAM-1和TNF-α蛋白表达比较,差异有统计学意义(P<0.05),B、C组较A组升高(q=10.850和3.574,均P=0.000),C组较B组降低(q=7.276,P=0.000)。见表2和图7。
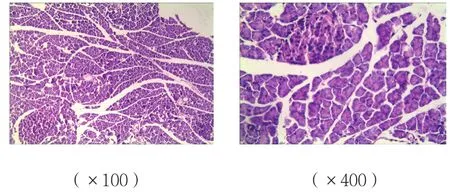
图1 A组胰腺组织病理改变 (HE染色)
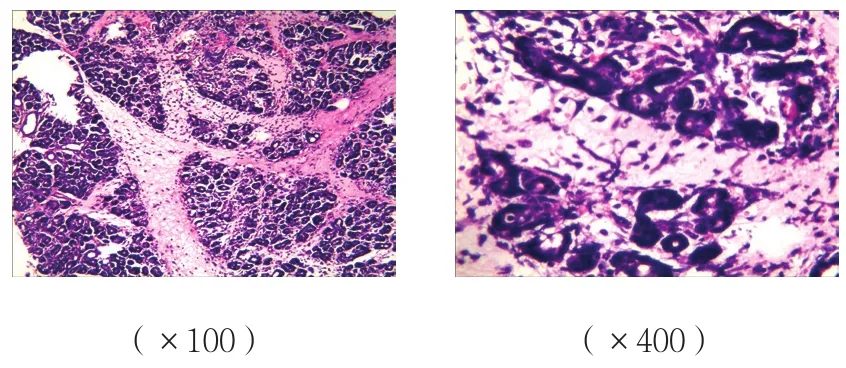
图2 B组胰腺组织病理改变 (HE染色)
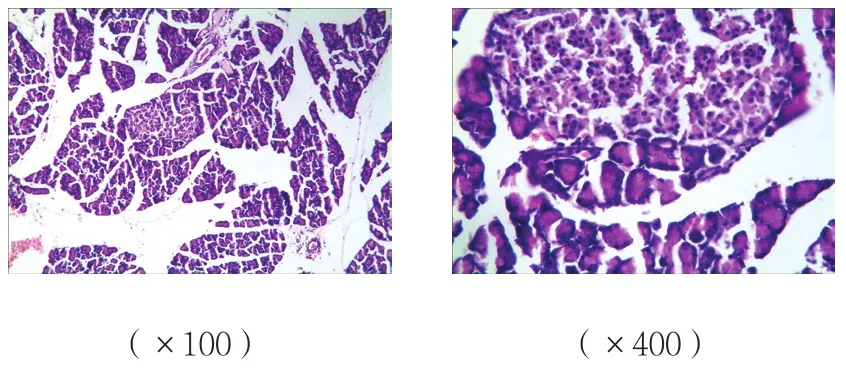
图3 C组胰腺组织病理改变 (HE染色)
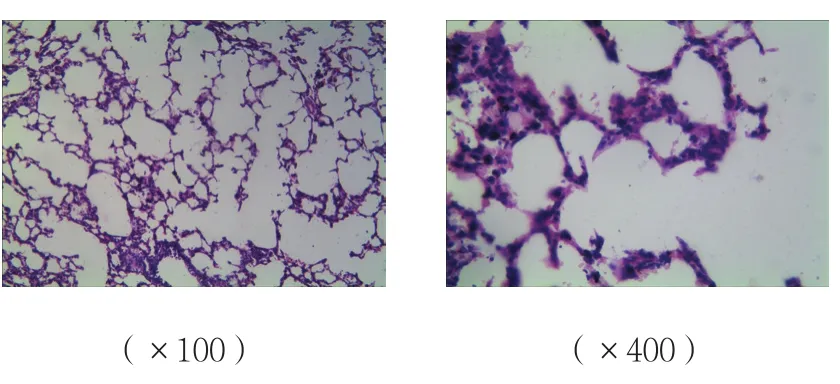
图4 A组肺组织病理改变 (HE染色)
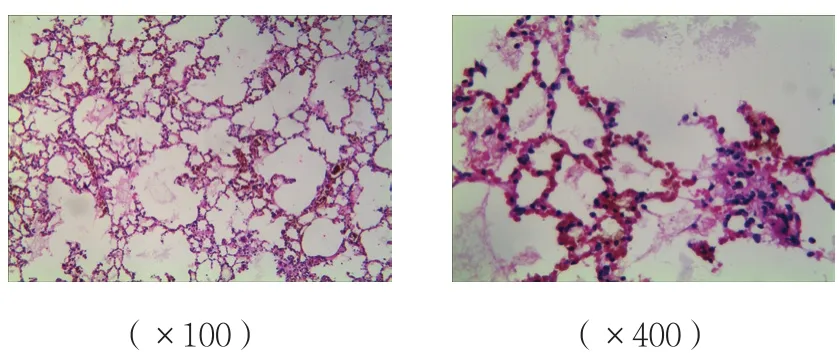
图5 B组肺组织病理改变 (HE染色)
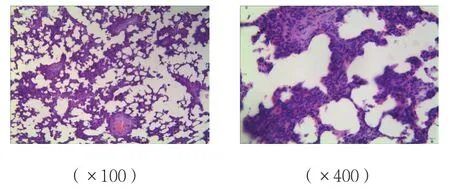
图6 C组肺组织病理图 (HE染色)
表2 3组肺组织ICAM-1和TNF-α蛋白表达比较(n=8,±s)
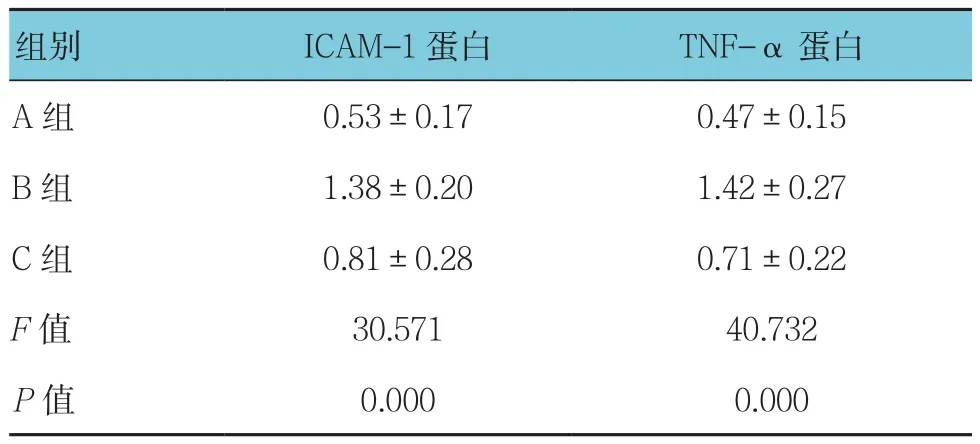
表2 3组肺组织ICAM-1和TNF-α蛋白表达比较(n=8,±s)
组别 ICAM-1蛋白 TNF-α蛋白A组 0.53±0.17 0.47±0.15 B 组 1.38±0.20 1.42±0.27 C 组 0.81±0.28 0.71±0.22 F值 30.571 40.732 P值 0.000 0.000
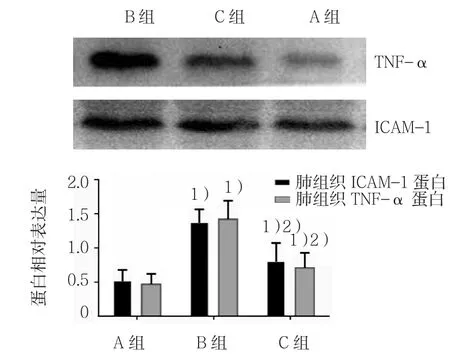
图7 3组肺组织ICAM-1和TNF-α蛋白表达
3 讨论
SAP发病机制错综复杂,病情危重,迄今缺乏特异性治疗方法。SAP时会促使炎症细胞释放大量细胞因子,导致的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)及多脏器衰竭(multiple organ failure,MOF)是SAP死亡的重要因素[3]。目前研究认为[4],TNF-α、IL-6等是SAP引起全身炎症反应综合征的强效介质,其中TNF-α是最早产生并起关键作用的炎症介质,并且TNF-α可直接促使组织细胞坏死及蛋白酶激活[5],作用于血管内皮细胞,导致组织出血及坏死。TNF-α可作为启动因子可引起瀑布样连锁及级联效应[6],促使机体释放氧自由基、前列环素、IL-6、缓激肽等,形成复杂和高度偶联的网络体系,这种失控性的炎症级联反应在SAP组织持续性损伤中起关键作用,可导致组织结构与功能的改变、细胞坏死,产生ARDS、SIRS、MODS及DIC等。在炎症反应过程中,ICAM-1的表达受TNF-α调节,ICAM-1可和粒细胞的整合素相作用,介导白细胞的游出和紧密连接,导致组织器官损伤[7]。
本实验中B组大鼠复制模型成功12 h后血清淀粉酶、肺组织ICAM-1及TNF-α蛋白水平较A、C组升高,肺组织可见炎症细胞浸润、组织水肿,损伤较重。肺是SAP发生时最先累及的胰腺外脏器,肺损伤时大量的炎症介质迁移到肺组织,释放大量的炎症介质,对肺泡上皮及肺毛细血管上皮严重造成损害,引起肺不张及肺水肿等,最终导致多器官衰竭,病死率高达40%~50%[8-9]。SAP发生时,肺组织脂质过氧化物迅速增高,NF-kB激活,TNF-α、IL-6等炎症介质及ICAM-1等基因表达上调,炎症介质大量释放,中性粒细胞的活化、浸润,产生过多的活性氧,导致肺组织炎症介质浸润,可导致肺组织及毛细血管的损害,从而加重肺损伤[10]。本实验中B组大鼠肺组织损伤较A、C组重,肺组织ICAM-1及TNF-α蛋白水平较A、C组升高。
Tα1是胸腺肽组分中活性最强的成分,在细胞免疫等方面具有重要调节作用[11]。Tα1在机体炎症调节、细胞凋亡等病理生理过程中可通过作用于胸腺细胞,刺激T淋巴细胞的分化成熟,激活NK细胞、CD3+、CD4+、CD8+T淋巴细胞,促进前NK细胞的补充、成熟,增强NK细胞的杀伤能力,增强机体的免疫功能[12],并可抑制有害炎症介质的产生。因此,Tα1具有增强机体的细胞免疫及体液免疫功能。Tα1调节作用是双向性,其可以上调有益的细胞因子如干扰素、IL-2等,对有害的炎症因子如TFN-α等可以下调。研究表明[13],Tα1在联合动脉导管化疗药物灌注栓塞治疗原发性肝癌安全性高,疗效显著;在治疗恶性肿瘤过程中可提高CD4+/CD8+比值及NK细胞数量、功能,对于T淋巴细胞功能和骨髓造血功能均具有一定的保护作用[14];在治疗丙型肝炎肝硬化患者方面已取得满意的效果[15],而Tα1对SAP肺损伤的疗效如何目前鲜见报道。本实验通过用Tα1对SAP大鼠肺损伤进行干预,结果表明,B组大鼠肺组织TNF-α、ICAM-1及淀粉酶水平至复制模型成功后12 h升高,胰腺及肺组织可见炎症细胞浸润,组织水肿、出血。使用Tα1干预后,C组大鼠血清淀粉酶和肺组织TNF-α、ICAM-1蛋白水平较B组降低,胰腺及肺组织损害情况较B组减轻,但仍高于A组,本结果表明Tα1能够降低SAP肺损伤大鼠炎症介质及细胞因子水平,能够减轻SAP的肺组织坏死及炎症细胞浸润,具有一定的保护作用。本实验通过血清学检查、蛋白水平分析Tα1对SAP大鼠肺损伤的保护作用,ICAM-1及TNF-α等炎症介质的下调,肺组织损伤减轻。由于SAP并发肺损伤是多炎症因子参与的动态过程[16],早期安全有效地抑制这些炎症介质活性将有利于控制肺损伤的进一步恶化,为临床治疗SAP患者提供了新的策略,其保护机制仍有待进一步探讨。
[1]FROSSARD J L,STEER M,PASTOR C M.Acute pancreatitis[J].Landcet,2008,371(9607): 143-152.
[2]GARACI E.Thymosin alpha-l: a historical overview[J].Ann NY Acad Sci,2007,1112(1): 14-20.
[3]WANG Y Z,WANG S W,ZHANG Y C,et al.Protective effect of exogenous IGF-I on the intestinal mucosal barrier in rats with severe acute pancreatitis[J].World J Emerg Med,2012,3(3): 213-220.
[4]MOTHOFER K,CASTILLO CFD,FRICH T W,et al.Increased intrapancreatic trypsinogenactive ischemia induced experimental pancreatitis[J].Annual of Surgery,1995,221(4): 364-371.
[5]SENDLER M,DUMMER A,WEISS F U,et al.Tumour necrosis factor alpha secretion induces protease activation and acinar cell necrosis in acute experimental pancreatitis in mice[J].Gut,2013,62(3): 430-439.
[6]余佳,金浩,陈辰,等.聚ADP核糖聚合酶抑制剂对重症急性胰腺炎大鼠肺炎症介质表达和肺损伤的影响[J].中华急诊医学杂志,2012,21(1): 38-42.
[7]HSU W Y,CHAO Y W,TSAI Y L,et al.Resistin induces monocyte-endothelial cell adhesion by increasing ICAM-1 and VCAM-1 expression in endothelial cells via p38MAPK-dependent pathway[J].J Cell Physiol,2011,226(8): 2181-2188.
[8]刘松桥,邱海波.急性呼吸窘迫综合征诊治进展[J].中华急诊医学杂志,2014,23(3): 248-251.
[9]MIKKELSEN M E,SHAH C V,MEYER N J,et al.The epidemiology of acute respiratory distress syndrome in patients presenting to the emergency department with severesepsis[J].Shock,2013,40(5): 375-381.
[10]武雅琴,蒋峰,黄建峰.辛伐他汀通过PI3K/Akt通路缓解肺泡Ⅱ型细胞缺氧复氧损伤[J].中华实验外科杂志,2011,28(11):1941-1943.
[11]吕永丰,陈清霞,李国成,等.乌司他丁对氟尿嘧啶植入剂治疗肝癌手术后恶性胸腹水患者免疫功能的影响观察[J].成都医学院学报,2011,6(3): 254-256.
[12]MOODY T W.Thymosin alphal as a chemopreventive agent in lung and breast cancer[J].Ann N Y Acad Sci,2007,112(1): 297-304.
[13]黄祥忠,高峰,任冬青,等.胸腺素αl联合动脉导管化疗药物灌注栓塞治疗原发性肝癌的疗效观察[J].实用临床医药杂志,2012,16(15): 11-13.
[14]NAYLOR P H,QUADRINI K,GARACI E,et al.Immunopharmacology of thymosin alpha l and cytokine synergy[J].Ann NY Acad Sci,2007,1112: 235-244.
[15]章前标,范磊.胸腺素α1治疗丙型肝炎肝硬化29例临床分析[J/CD].中华临床医师杂志: 电子版,2013,7(24): 11873-11874.
[16]魏明,刘佳,涂玲,等.重症急性胰腺炎肺损伤大鼠磷脂酰肌醇-3激酶表达及其抑制剂对肿瘤坏死因子-α表达的影响[J].中华急诊医学杂志,2015,24(1): 51-54.

