伴高危因素的低级别脑胶质瘤患者辅助治疗策略的选择
霍伟康 桂小娟
在颅内原发恶性肿瘤中胶质瘤最为常见,在世界卫生组织(WHO)分类中将其分为四级,其中Ⅰ、Ⅱ级为低级别胶质瘤 (low-grade gliomas,LGGs),Ⅲ、Ⅳ级为高级别胶质瘤 (highgrade gliomas,HGGs)[1]。对于高级别胶质瘤的术后辅助治疗,目前已达成共识,需要进行进一步化疗及放疗。对于WHOⅠ级的胶质瘤,因其具有较低的增殖潜能,被认为是良性肿瘤,可通过单独手术治愈,无需放疗及化疗。WHOⅡ级的胶质瘤,根据其起源分为:星形细胞起源、少突胶质细胞起源及混合型胶质瘤。其手术后的辅助治疗,目前仍有相当大的争议,目前多数人倾向对具有高危因素的LGGs患者进行术后的辅助治疗。LGGs的高危因素有[2,3]:①年龄≥40岁。②星形细胞瘤组织亚型。③肿瘤最大直径≥6 cm。④肿瘤跨过中线。⑤手术前存在神经功能缺失(不包括单纯癫痫发作)。将LGGs患者分为低危组和高危组,≤2个高危因素的为低危组,≥3个高危因素的为高危组。低危组LGGs中位生存时间7.72年,高危组LGGs中位生存时间3.2年。近年来,伴随分子病理学进展,IDH1/2野生型、无1p19q联合缺失在最新的美国国立综合癌症网络(NCCN)指南中也被认为是高危因素。对于这些伴有高危因素的LGGs,术后应该采取TMZ化疗、放疗亦或是联合放化疗,目前尚无统一标准,造成困惑。本文通过回顾性分析2011年1月~2015年1月南方医院的伴高危因素的LGGs患者93例,探讨单纯放疗、TMZ化疗及放化疗联合治疗对患者术后无进展生存期(progression free survival time,PFS)的影响 ,从而为具有高危因素的LGGs患者的辅助治疗方案提供理论依据。
1 资料与方法
1.1 一般资料 选取2011年1月~2015年1月南方医院的伴高危因素的LGGs患者93例作为研究对象,所有患者均经过手术切除并确诊为胶质瘤WHOⅡ级,手术尽可能达到镜下全切,患者至少伴有3项以上高危因素,患者中男53例、女 40 例 ,年龄 3~84 岁 ,平均年龄 (38.7±3.7)岁。随机分为对照组(20例)、化疗组(28例)、放疗组(21例)及联合治疗组(24例)。四组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。见表 1。

表1 四组患者的一般资料比较(n)
1.2 方法 ①对照组不处理;②化疗组具体方案:剂量150~200 mg/(m2·d),每 28 天进行连续 5 d 药物治疗 ,共 12 疗程;③放疗组一般术后2个月内行放疗,根据患者放射剂量选择45~54 GY;④联合治疗组患者术后行同步放化疗,放疗时同步服用 TMZ,75 mg/(m2·d),放疗完成后继续口服 TMZ,剂量 150~200 mg/(m2·d),每 28 天进行连续 5 d 药物治疗。经过3~7年的随访观察,记录各组患者的PFS时间。
1.3 统计学方法 采用SPSS19.0统计学软件进行数据分析,患者临床资料的因素差异性分析用方差分析;应用Kaplain-Meier法行生存分析,Log-rank法对结果进行检验,并绘制生存曲线;患者各组之间的PFS比较采用方差分析进行统计。均以α=0.05为检验水准;计数资料采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
对照组、化疗组、放疗组、联合治疗组PFS分别为(36.250±1.430)、(48.652±3.305)、(46.588±2.257)、(56.100±2.862)个月 ,平均 PFS 为 (47.539±1.571)个月 ,应用 Kaplain-Meier 法进行统计学分析,并绘制生存曲线。见图1。采用Log-rank进行检验,四组患者PFS的差异具有统计学意义(χ2=32.661,P=0.000<0.05)。进一步比较各组的差异性 ,采用方差分析。化疗组、放疗组、联合治疗组的PFS和对照组比较 ,差异有统计学意义 (P=0.012、0.043、0.000<0.05);联合治疗组PFS明显长于化疗组、放疗组,差异有统计学意义(P=0.023、0.013<0.05);放疗组 PFS与化疗组比较 ,差异无统计学意义 (P=0.699<0.05)。
3 讨论
目前大部分学者认为术后放疗可延长LGGs的PFS和总体生存时间[4],本研究结果亦表明 ,经放疗后 ,患者 PFS 得到显著延长。欧洲癌症研究治疗中心(european organization for research and treatment of cancer,EORTC)22845 实验[3]显示早期的放疗明显提高 PFS(中位 PFS5.3 VS 2.4 年 ,HR=0.59,P<0.0001)。有反对者拒绝放疗的原因在于其所带来的认知功能异常,Douw等[5]在一项报道中,对患者进行了长达12年的随访,发现早期接受放疗的患者中有53%发生了明显的认知功能障碍,未放疗组为27%,其临床症状是进行性注意力、记忆力和执行能力的减退、步态和平衡障碍等。当然本研究并未涉及患者在认知方面的研究,目前对于高危因素人群,早期进行放射治疗,多数学者仍持有较肯定的态度。LGGs分化相对较好、生长缓慢,因此放疗剂量的选择仍存在争议[6]。通过 EORTC 22844 的随机试验 ,大剂量放疗可导致放射性损伤,且不能延长患者总体生存率及无进展生存率,目前广泛接受总剂量45~50.4 GY的放疗方案。研究发现45~59.4 GY 和 50.4~68.4 GY 并无明显统计学差异[7]。因此目前针对 LGGs,放射剂量一般选取 45~50.4 GY 的小剂量 ,尽可能消除放射治疗所带来的副作用。
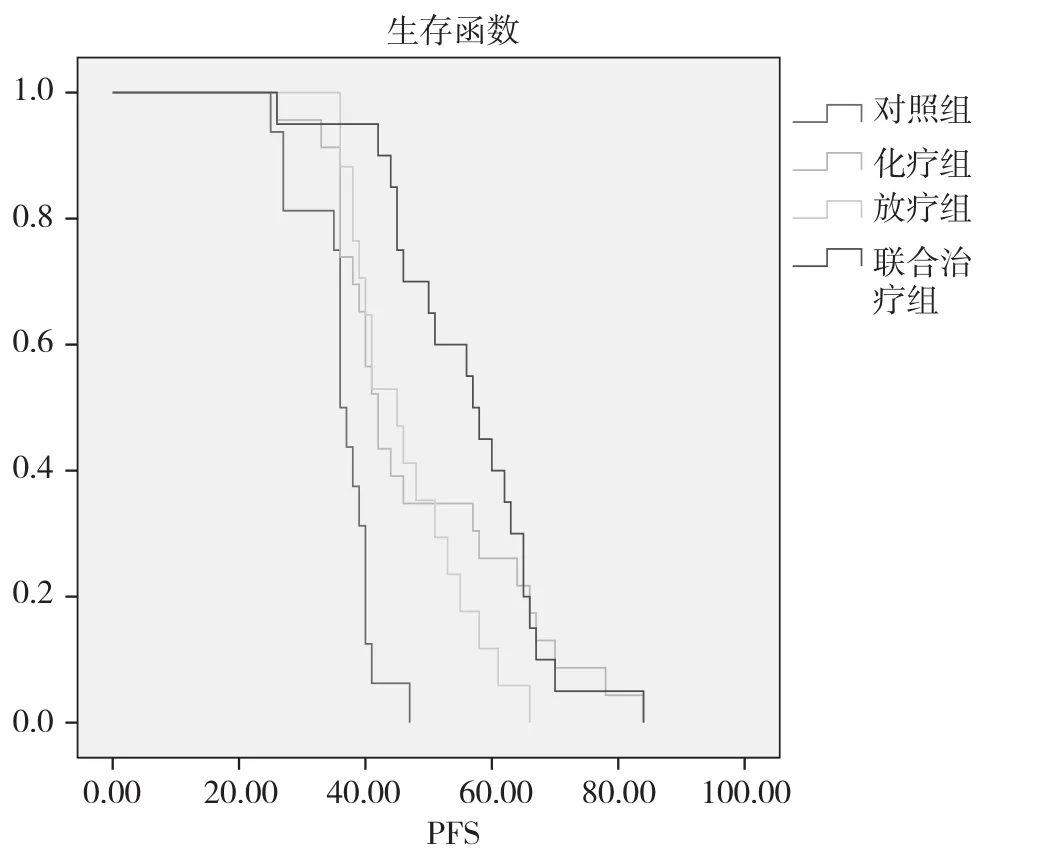
图1 四组患者PFS生存曲线图
TMZ作为可口服的烷化剂,其药理特性主要有以下几点:容易透过血脑屏障,脑脊液内药物浓度较高,不易产生耐药性,对人体毒副性小,药物使用便捷。本研究表明,TMZ化疗和放射治疗对患者的PFS无显著性差异。在EORTC 22033~26033 三期临床试验[8]中 ,进一步发现 TMZ 化疗和仅行放疗相比较,患者总的PFS差异无统计学意义,但进一步分析表明对于IDH1/2突变并伴有无1p/19q联合缺失患者,TMZ化疗并不是很好的选择,Ziu[9]等研究建议IDH1/2突变伴1p/19q丢失的患者更应该使用TMZ进行化疗。说明了分子病理诊断对于治疗的指导意义,因此本研究下一步重点将关注LGGs的分子分型在化疗中的意义。另外,Jaap[10]在试验中发现放疗和口服TMZ相比,患者的生存质量并无明显不同,因此不少学者提出对于部分LGGs,用TMZ代替放疗进行辅助治疗。
本研究发现,联合治疗和单纯放疗、化疗相比,患者的PFS有显著性提高。较为遗憾的是没有对患者联合治疗的精神、认知等功能进行有效的随访,未能进一步明确联合放化疗所带来的危险因素。有学者指出TMZ对于放射治疗有很好的增敏效应[11,12],因此 ,在胶质瘤术后的综合治疗中 ,放射线的使用、化疗药物的作用以及TMZ具有对于放疗的增敏效应,从而产生放化疗之间的协同效应,以上特点使得术后放疗+TMZ治疗方案在高级别胶质瘤的治疗中呈现出很好的疗效。比如在一项国外的三期临床试验中[13],在使用三维适形放疗的早期联合TMZ化疗,和单纯运用三维适形放疗相比,患者的生存率得到明显提高。但是对于LGGs的联合治疗研究相对较少,美国肿瘤放射协助组(Radiation Therapy Oncology Group,RTOG) 0424 研究[14]表明 ,TMZ 联合放疗组的患者生存时间明显高于单独放疗组,这有可能和IDH突变有关,或者TMZ的增敏作用,该研究给出如此解释。近期公布的RTOG 9802试验[15]的长期随访结果显示:对于高风险的患者,甲基苄肼+洛莫司汀+长春新碱(PCV)方案+放疗和单独放疗相比,患者的PFS明显延长。而且和单纯放疗相比,并未明显增加患者的精神及认知障碍。但替莫唑胺的出现是否可以取代传统的PCV方案,该研究并未做出进一步解释,寄希望于最新的三期临床试验结果验证答案。
当然,本研究的随访时间及病例数量不足,且下一步要继续关注患者生存质量以及各种并发症。不同分子分型的预后,更适合哪种方案,如何进行联合放化疗方案等,仍需要更多的前瞻性多中心对照研究。在未来LGGs的诊治中,其分子分型以及基因测序等技术,代表以后的发展方向,有可能成为LGGs治疗的突破点。
[1] Louis DN,Ohgaki H,Wiestler OD,et al. The 2007 WHO Classification of Tumours of the Central Nervous System.International Agency for Research on Cancer,2007.
[2] Pignatti F,Bent MVD,Curran D,et al. Prognostic Factors for Survival in Adult Patients With Cerebral Low-Grade Glioma.Journal of Clinical Oncology Official Journal of the American Society of Clinical Oncology,2002,20(8):2076-2084.
[3] Mj VDB,Afra D,De WO,et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial.Digest of the World Core Medical Journals,2005,366(9490):985.
[4] Vassal M,Rigau V,de Champfleur NM,et al. Surgical management of diffuse low-grade gliomas associated with other intracranial diseases. Acta Neurochirurgica,2014,156(2):339-347.
[5] Douw L,Klein M,Fagel SS,et al. Cognitive and radiological effects of radiotherapy in patients with low-grade glioma: Long-term follow-up. Lancet Neurology,2009,8(9):810.
[6] 陈诗师,李金泉. 成人低级别胶质瘤的治疗. 中国神经肿瘤杂志 ,2012(4):277-281.
[7] Shaw E,Arusell R,Scheithauer B,et al. Prospective randomized trial of low- versus high-dose radiation therapy in adults with supratentorial low-grade glioma: initial report of a North Central Cancer Treatment Group/Radiation Therapy Oncology Group/Eastern Cooperative Oncology Group study. Journal of Clinical Oncology,2002,20(9):2267-2276.
[8] Baumert BG,Hegi ME,Mj V D B,et al. Temozolomide chemotherapy versus radiotherapy in high-risk low-grade glioma (EORTC 22033-26033): a randomised,open-label,phase 3 intergroup study. Lancet Oncology,2016,17(11):1521-1532.
[9] Ziu M,Kalkanis S N,Gilbert M,et al. The role of initial chemotherapy for the treatment of adults with diffuse low grade glioma: A systematic review and evidence-based clinical practice guideline. Journal of neuro-oncology,2015,125(3):585-607.
[10] Reijneveld J C,Taphoorn M J,Coens C,et al. Health-related quality of life in patients with high-risk low-grade glioma (EORTC 22033-26033): a randomised,open-label,phase 3 intergroup study. Lancet Oncology,2016,17(11):1533-1542.
[11] Mcgirt M J,Chaichana K L,Gathinji M,et al. Independent association of extent of resection with survival in patients with malignant brain astrocytoma. Journal of Neurosurgery,2009,110(1):156-162.
[12] Chan MD. Recent Technical Advances and Indications for Radiation Therapy in Low-Grade Glioma. Seminars in Radiation Oncology,2015,25(3):189-196.
[13] Feigl GC,Ritz R,Moraes M,et al. Resection of malignant brain tumors in eloquent cortical areas: a new multimodal approach combining 5-aminolevulinic acid and intraoperative monitoring.Journal of Neurosurgery,2010,113(2):352-357.
[14] Fisher B J,Hu C,Macdonald D R,et al. Phase 2 study of temozolomide-based chemoradiation therapy for high-risk lowgrade gliomas: preliminary results of Radiation Therapy Oncology Group 0424. Int J Radiat Oncol Biol Phys,2015,91(3):497-504.
[15] Schaff L R,Lassman A B. Indications for Treatment: Is Observation or Chemotherapy Alone a Reasonable Approach in the Management of Low-Grade Gliomas. Seminars in Radiation Oncology,2015,25(3):203-209.

