血管内皮生长因子对大鼠离体心脏骨髓间充质干细胞滞留率的影响
王 佶 胡权腾 何忠良朱成楚何雪明 辛顺心 伍勇勇
目前细胞移植治疗心脏疾病越来越受到人们的重视,随着研究的深入,已有一些应用骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的动物实验和临床研究报道,但如何促进更多的移植细胞游走到组织间隙来提高其疗效已成为国内外研究热点[1-5]。血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)作为血管通透剂对缺血性心脏病有一定的疗效,但是否对移植细胞的迁移有影响报道极少[6]。本研究观察VEGF预处理对正常灌注与缺血再灌注模型下大鼠离体心脏BMSCs滞留率的影响。
1 实验材料
1.1 实验动物 2周龄清洁级雄性SD大鼠20只作为BMSCs的来源,12周龄清洁级近交系雌性SD大鼠106只,体质量(210.83±12.5)g制备离体心脏正常灌注和缺血再灌注模型,由浙江省实验动物中心提供,实验动物合格证:SCXK(浙)2014-0001。所有大鼠均在相同的条件下饲养,人工光照明、暗各12h/d。
1.2 主要试剂和仪器 Langendorff心脏离体灌注装置、pH计(美国Beckman);高速冷冻离心机(德国Hermle);倒置相差/荧光显微镜(日本 Olympus公司);Countess自动细胞计数仪(Invitrogen Proprietary公司);Genomic DNA Purification Kit(PromegaWizard公司);DMEM培养基、胎牛血清、胰蛋白酶、PBS缓冲液(美国GibcolBRL公司);PCR试剂盒(北京易莱西诺生物科技有限公司);PCR引物(美国invitrogen公司),7300 Real-time PCR System(ABI公司);小鼠抗大鼠 CD29、CD34、CD44、CD45 和CD106 的单克隆抗、VEGF、DAPI(Sigma 公司,批号SAB4700294、SAB1403649、SAB1405590、SAB4700471、SAB1305520、SRP6255、D9542)。
2 实验方法
2.1 大鼠BMSCs分离、培养和鉴定 取2周龄清洁级雄性SD大鼠20只,氯胺酮30mg/kg、安定5mg/kg腹腔注射麻醉,无菌条件下取出股骨和胫骨,用DMEM培养基缓慢冲洗骨髓腔,冲洗出来液体离心收集细胞,接种到含DMEM培养基的培养瓶中,置37°C、5%CO2饱和湿度培养箱中培养,原代培养24~48h后换液,细胞长满70~80%融合时按1:3传代,3代以后的细胞用于实验;用倒置显微镜观察第3代BMSCs的形态,流式细胞仪检测细胞表面抗原CD29、CD34、CD44、CD45 和 CD106 的 表 达 ,用Countess自动细胞计数仪记录活细胞总数。
2.2 实验分组与模型构建 (1)大鼠适应性饲养1周后,采用随机数字表法将大鼠分成正常灌注组与缺血再灌注组,每组50只,其中正常灌注组又分成BMSCs组(n=25)与 BMSCs+VEGF组(n=25),缺血再灌注组也分成BMSCs组(n=25)与BMSCs+VEGF组(n=25)。(2)正常灌注组中BMSCs组大鼠给予戊巴比妥钠(30mg/kg)腹腔注射麻醉、肝素(250U/kg)抗凝,快速显露,保留3~4mm主动脉剪下心脏,将灌注管固定在主动脉端,连接离体心脏灌注系统,灌注液流量约8mL/min,待心脏稳定搏动15min后,注入BMSCs细胞 1mL(1×106/mL),停 2min 后重新开始灌注,于 5、10、30、60、120min 时间点收集从心脏流出的所有灌注液,每个时间点5只。注入高钾停跳液使心脏在舒张期停跳后,取出心脏,放入液氮中存储。BMSCs+VEGF组灌注BMSCs前预先向心脏中注入VEGF1mL(浓度 1000μmol/L),其他步骤与 BMSCs组相同。(3)缺血再灌注组先建立心脏离体灌注模型,待心脏稳定搏动15min后,关闭灌注系统使心肌缺血30min,建立缺血再灌注模型,其他操作步骤与正常灌注组相同,见表1。
2.3 测定 BMSCs滞留率 (1)RT-PCR检测:从BMSCs中提取的DNA按梯度制成细胞数-CT值的标准曲线。把备用的心脏制成10%组织匀浆,用紫外可见分光光度计测量OD260/280比值,判定DNA的质量,计算浓度;(2)RT-PCR扩增:SRY上游引物:5’-3’CATCGAAGGGTTAAAGTGCCA,下游引物:5’-3’ATAGTGTGTAGGTTGTTGTCC。每个样品含量:10uL的目标 DNA,上下游引物各 1μL,12.5μL的Power:SYBR Green PCR Master Mix 和 0.5μL 的DEPC水。循环条件是:95℃预变性10min,95℃变性15s,60℃退火 1min,每个样本重复 3 次,7300 Realtime PCR System检测SRY目标基因。
2.4 统计学方法 应用SPSS16.0统计软件分析,数据用平均值±标准差(s) 表示。各组内5个时间点比较采用配伍组设计方差分析;两两组间比较采用t检验和秩和检验。P<0.05为差异有统计学意义。
3 结果
3.1 大鼠BMSCs分离培养和鉴定 形态学观察:采用贴壁法,通过换液、培养去除不贴壁细胞,细胞长到培养瓶面积70%可进行第1次传代,开始细胞形态不一,主要为圆形、梭形、纺锤形、多角形。经过3次传代后纯化,细胞呈长梭形纤维状,生长均匀,形态趋于一致。每个培养瓶可收集到BMSCs(1.8±0.3)×106个,平均细胞直径为17.2μm。经流式细胞仪鉴定计数,其中 CD34、CD45 表达阴性,CD29、CD44、CD106表达阳性的细胞占95%以上,分离培养后的细胞具有较高的纯度;用Countess自动细胞计数仪进行计数可计算出BMSCs的活性,传至第3代的BMSCs细胞活性接近100%,
3.2 动物模型建立 取大鼠106只,其中在手术中损伤心脏1只,主动脉根部破裂1只,心脏提前停止跳动4只,其余均在1min内取下心脏并悬挂至Langendorff装置,成功建立大鼠心脏离体灌注模型,成功率94.3%。
3.3 PCR检测结果 从BMSCs中提取的DNA经101~105倍稀释后获得每个浓度的CT值,制成细胞数-CT值的标准曲线,推算出细胞数量的计算公式:细胞数=10(31.49-Ct)/3.2412。滞留率=心脏内滞留的细胞量/灌注细胞总量,心脏内滞留的细胞量通过RT-PCR 计算得出:(1)正常灌注 BMSCs组在 5、15、30、60、120min五个时间点平均BMSCs滞留率之间差异无统计学意义(P>0.05),这说明BMSCs的滞留主要发生在细胞注射后的5min之内,之后减少不明显;(2)缺血再灌注组与正常灌注组各同一时间点的平均BMSCs滞留率比较,缺血再灌注组均显著高于正常灌注 BMSCs组(P 均<0.05);(3)正常灌注 BMSCs+VEGF组与正常灌注BMSCs组各同时间点滞留率比较,差异无统计学意义(P>0.05);缺血再灌注BMSCs+VEGF组与缺血再灌注BMSCs组各同时间点滞留率比较,差异无统计学意义(P>0.05);(4)缺血再灌注BMSCs+VEGF组与正常灌注BMSCs+VEGF组同时间点比较,滞留率均明显增加(P均<0.05),见表 2。
4 讨论
BMSCs是骨髓中的一种具有自我更新和多向分化能力的多功能非造血干细胞,它可以通过在体外分离、培养、扩增获得较多的细胞数并仍有分化的潜能,在特定条件下可分化为软骨细胞、脂肪细胞、肌细胞等多种组织细胞,对损伤组织有显著的修复功能,并且具有独特的免疫调节特性(免疫抑制)和极低的免疫原性(免疫赦免)等重要的生物学特性[7-8]。这些特点有可能使BMSCs移植治疗心脏疾病成为切实而有效的治疗方法,而BMSCs的归巢和滞留对于细胞移植的治疗效果至关重要。

表1 各组大鼠干预处理情况
表2 各组大鼠离体心脏不同时间点BMSCs滞留率(%,±s)
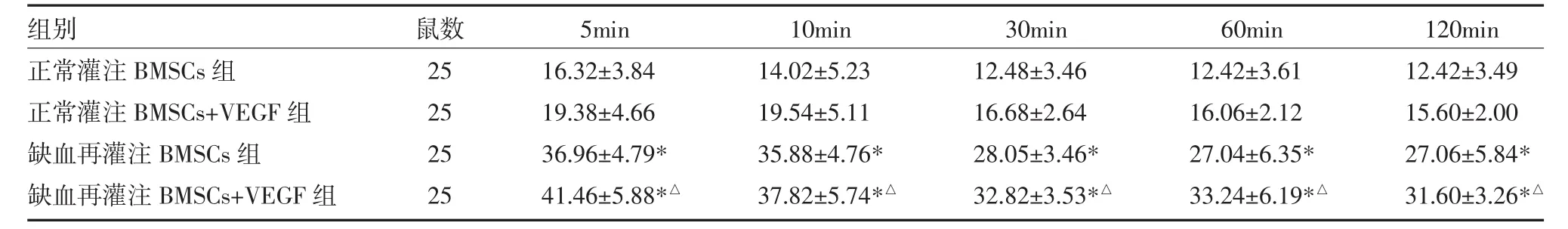
表2 各组大鼠离体心脏不同时间点BMSCs滞留率(%,±s)
注:与正常灌注组BMSCs比较,*P<0.05;与正常灌注BMSCs+VEGF组比较,△P<0.05;BMSCs:骨髓间充质干细胞;VEGF:血管内皮生长因子
组别正常灌注BMSCs组正常灌注BMSCs+VEGF组缺血再灌注BMSCs组缺血再灌注BMSCs+VEGF组鼠数25 25 25 25 5min 16.32±3.84 19.38±4.66 36.96±4.79*41.46±5.88*△10min 14.02±5.23 19.54±5.11 35.88±4.76*37.82±5.74*△30min 12.48±3.46 16.68±2.64 28.05±3.46*32.82±3.53*△60min 12.42±3.61 16.06±2.12 27.04±6.35*33.24±6.19*△120min 12.42±3.49 15.60±2.00 27.06±5.84*31.60±3.26*△
本实验通过检测大鼠离体心脏正常灌注下BMSCs滞留率,发现注入心脏后BMSCs滞留大部分发生在5min内,之后几乎所有细胞被冲出心脏,滞留率较低,在16.32%左右,与Amado等[9]追踪BMSCs移植后的结果相同。同时发现大鼠离体心脏缺血再灌注可以显著增加BMSCs的滞留率,达到36.96%,原因是心肌缺血会对一些信号分子产生应答激活,损伤部位释放趋化因子、黏附分子、生长因子和酶等多种配体,与BMSCs上表达的相应受体结合,驱动BMSCs迁移到受损部位的作用[10-11]。Mangi等[12]用大鼠心肌梗塞模型,上调BMSCs的ATk基因表达后注入心脏发现细胞移植的治疗效果要明显好于对照组,因为增强细胞对低氧的耐受,减少细胞凋亡,提高BMSCs的存活率。有研究表明,将过表达PKCε基因的BMSCs注入急性心肌梗死大鼠模型的心脏后,BMSCs在心肌的滞留率和存活率明显提升,并改善心室重塑和心脏功能,且这种效应在抑制CRCR4和PI3K后依然存在,PKCε基因的过表达可以激活SDF-1/CXCR4轴和PI3K/AKT信号通路,两者在间充质干细胞的归巢过程中起重要作用[13]。
VEGF是体内一种强效促血管生成因子,也是一种强效血管通透剂。虽然VEGF和BMSCs各自治疗心脏缺血性疾病的有许多报道,但两者联合应用是否有协同作用的报道却并不多见。鉴于此,有学者将转染VEGF基因的MSCs移植于心肌梗死区域后,MSCs可在心肌梗死区顺利存活,实验组毛细血管数量显著高于对照组,心功能改善程度也优于对照组[14]。Wang等[15]通过体外细胞实验发现,VEGF通过激活FAK和Rac1信号分子促进BMSCs迁移,且这种效应在BMSCs向神经细胞方向预诱导分化24h后最明显,而在心肌细胞中尚未见报道。本研究中正常灌注BMSCs组与正常灌注BMSCs+VEGF组大鼠离体心脏BMSCs滞留率差异无统计学意义(P>0.05);缺血再灌注BMSCs组和缺血再灌注BMSCs+VEGF组大鼠高体心脏BMSCs滞留率差异也无统计学意义(P>0.05),说明VEGF作为血管通透剂对提高BMSCs滞留率可能无明显作用,不能促使更多的细胞进入组织间隙,分析原因可能一是大鼠离体心脏经VEGF预处理后,立即开始灌注BMSCs,VEGF没有起作用的缓冲时间,影响了其疗效,二是VEGF的生物半衰期比较短,注入体内易稀释,而且缺血受损组织会释放某些生物因子,刺激BMSCs分泌促血管生成因子VEGF影响微血管。因此,一次性注入外源性VEGF可能对整个滞留过程影响并不大。此外,有文献报道,将BMSCs移植到受损心肌后是通过提高血管新生,增加血供和营养支持来发挥修复受损心肌的作用,这种作用依赖于胎盘生长因子(PLGF),而不是如经典学说认为的那样大量分化为心肌细胞,以此来替代受损的细胞[16],也有学者发现外源性补充VEGF对BMSCs的血管再生效应有抑制作用[17]。
总之,缺血再灌注可以显著增加大鼠离体心脏的BMSCs滞留率,而血管内皮生长因子(VEGF)对其无明显增加作用,在受损心肌中是否有作用有待进一步深入研究。
[1] Schachinger V,Erbs S,Elsasser A,et al.Intracoronary bone marrow-derived progenitor cells in acute myocardial infarction[J].N Engl J Med,2006,355(12):1210-1221.
[2] Roncalli J,Mouquet F,Piot C,et al.Intracoronary autologous mononucleated bone marrow cell infusion for acute myocardial infarction:results of the randomized multicenter BONAMI trial[J].Eur Heart J,2011,32(14):1748-1757.
[3]Furlani D,Ugurlucan M,Ong L,et al.Is the intravascular administration of mesenchymal stem cells safe Mesenchymal stem cells and intravital microscopy[J].Microvasc Res,2009,77(3):370-376.
[4] Hare JM,Fishman JE,Gerstenblith G,et al.Comparison of allogeneic vs autologous bone marrow-derived mesenchymal stem cells delivered by transendocardial injection in patients with ischemic cardiomyopathy:the POSEIDON randomized trial[J].JAMA,2012,308(22):2369-2379.
[5]Trachtenberg B,Velazquez DL,Williams AR,et al.Rationale and design of the Transendocardial Injection of Autologous Human Cells(bone marrow or mesenchymal)in Chronic Ischemic Left Ventricular Dysfunction and Heart Failure Secondary to Myocardial Infarction (TAC-HFT)trial:A randomized,double-blind,placebo-controlled study of safety and efficacy[J].Am Heart J,2011,161(3):487-493.
[6] Tao ZX,Chen B,Tan X,et al.Coexpression of VEGF and angiopoietin-1 promotes angiogenesis and cardiomyocyte proliferation reduces apoptosis in porcine myocardial infarction(MI)heart[J].Proc Natl Acad Sci USA,2011,108(5):2064-2069.
[7]Liu X,Chen T,Wu Y,et al.Role and mechanism of PTEN in adiponectin-induced osteogenesis in human bone marrow mesenchymal stem cells[J].Biochem Biophys Res Commun,2016,12(29):712-717.
[8]Emmert MY,Weber B,Wolint P,et al.Intramyocardial transplantation and tracking of human mesenchymal stem cells in a novel intra-uterine preimmune fetal sheep myocardial infarction model:a proof of concept study[J].Plos One,2013,8(3):e57759.
[9] Amado LC,Saliaris AP,Schuleri KH,et al.Cardiac repair with intramyocardial injection of allogeneic mesenchymal stem cells after myocardial infarction[J].Proc Natl Acad Sci USA,2005,102(32):11474-11479.
[10]高立华,张旭华.骨髓间充质干细胞对缺血再灌注大鼠急性心肌梗死保护作用研究[J].现代检验医学杂志,2013,28(6):78-81.
[11] Singh A,Singh A,Sen D.Mesenchymal stem cells in cardiac regeneration:a detailed progress report of the last 6 years(2010-2015)[J].Stem Cell Res Ther,2016,7(1):82.
[12] Mangi AA,Noiseux N,Kong D,et al.Mesenchymal stem cells modified with Akt prevent remodeling and restore performance of infarcted hearts[J].Nat Med,2013,9(9):1195-1201.
[13] He H,Zhao ZH,Han FS,et al.Overexpression of protein kinase C varepsilon improves retention and survival of transplanted mesenchymal stem cells in rat acute myocardial infarction[J].Cell Death Dis,2016,7:e2056.
[14]杨锴,陈刚,杨飞燕,等.VEGF基因转染骨髓间充质干细胞移植治疗对心肌梗死大鼠的影响[J].广东医学,2013,34(3):362-364.
[15] Wang H,Wang X,Qu J,et al.VEGF Enhances the Migration of BMSCs in Neural Differentiation by Regulating Focal Adhesion Turnover[J].J Cell Physiol,2015,230(11):2728-2742.
[16]Zhang J,Wu Y,Chen A,et al.Mesenchymal stem cells promote cardiac muscle repair via enhanced neovascularization[J].Cell Physiol Biochem,2015,35(3):1219-1229.
[17] Niyaz M,Gurpinar OA,Oktar GL,et al.Effects of VEGF and BMSCs on vascular regeneration in a trauma model in rats[J].Wound Repair Regen,2015,23(2):262-267.

