立体定向放疗再程治疗局部晚期复发胰腺癌的疗效分析
沈钰新 朱晓斐 居小萍 曹洋森 清水汪 曹飞 耿杨杨 赵宪芝 方芳 贾臻 顾蕾 张火俊
胰腺癌作为一种起病隐匿、预后差的恶性肿瘤,约80%的患者初诊时已经无法接受根治性手术治疗[1-2]。立体定向放射治疗(stereotactic body radiation therapy, SBRT)周期短、毒性反应低,且能安全有效地联合化疗,近年来已成为提高胰腺癌局部控制率的重要手段。针对常规外照射后复发的胰腺癌患者,SBRT能够在一定程度上提高局部控制率以及生存期,并且毒性反应可耐受[3]。本研究回顾性分析接受SBRT再程治疗的局部晚期复发胰腺癌患者病例资料,评估其安全性及有效性。
资料与方法
一、病例资料
收集2014年至2017年间上海长海医院连续收治的7例SBRT再程治疗的胰腺癌患者。入组标准:(1)经细胞学或组织学确认的胰腺恶性肿瘤,或由多学科专家讨论后慎重做出临床诊断的胰腺癌[4];(2)根据美国癌症联合会(American Joint Committee on Cancer, AJCC)2017修订胰腺癌国际TNM分期第8版,初诊为Ⅲ期的胰腺癌;(3)在长海医院放疗中心进行首程以及再程SBRT治疗;(4)影像学检查确认为照射野内复发,且无十二指肠壁或胃壁黏膜层浸润。排除标准:(1)复发同时伴有远处转移;(2)再程放疗前接受胰腺相关手术治疗。
二、SBRT治疗设备及计划参数
全部患者两次SBRT均采用G4系统射波刀®(Accuray Incorporated,Sunnyvale,CA)进行治疗,16排大孔径螺旋CT模拟机®(Philips Incorporated,Amsterdam,NED)进行定位。固定装置为真空袋体模,7例患者均接受计划CT以及胰腺实质增强CT(碘克沙醇对比剂80~100 ml,注射速度2.0~2.5 ml/s,延时45~55 s)定位。扫描范围包括整个胰腺及病灶上下10 cm的范围,CT层厚及图像重建均为1.5 mm。
治疗计划肿瘤靶区(gross tumor volume, GTV)包括两相CT可见病灶的位置和范围,临床靶区(clinical target volume, CTV)等同于GTV,计划靶区(planning target volume, PTV)包含CTV以及CTV外扩2~5 mm的体积。对于紧邻危及器官(如十二指肠)的肿瘤患者,CTV在该方向外扩体积酌情减小。危及器官限制剂量参考美国医学物理学家协会(American Association of Physicists in Medicine, AAMP) TG101报告以及Grimm等[5]的报道。
三、观察指标及评价方法
总生存期(overall survival,OS)定义为从接受SBRT开始到患者死亡的时间。OS-1、OS-2分别为首程以及再程SBRT后的总生存期。局部无复发生存期(locally relapse-free survival, LFRS)定义为从开始执行SBRT到出现疾病局部进展或因任何原因导致死亡的时间。LFRS-1、LFRS-2分别为首程以及再程SBRT后的局部无复发生存期。两次SBRT疗效评估均参照实体肿瘤的疗效评价标准1.1版(RECIST v1.1)。疼痛评价采用数字评分法(numerical rating scale,NRS)。所有不良事件采用美国国立癌症所常见不良事件术语标准(NCI CTC-AE)4.03版进行评估。
四、统计学处理
所有数据均采用SPSS 20.0统计软件包处理。生存分析采用Kaplan-Meier法,组间比较采用两配对样本非参数Wilcoxon秩检验。P<0.05为差异有统计学意义。
结 果
一、一般资料
7例患者中男性5例,女性2例,年龄47~70岁,中位年龄66岁;肿瘤部位:胰头部3例,胰颈部1例,胰体部3例;肿瘤TNM分期:T2 1例、T4 6例,N1 2例、N2 1例,均为M0。病理诊断:2例腺癌,1例腺鳞癌,1例细胞学检查找到癌细胞。
二、治疗方案
SBRT等剂量线范围为63%~75%处方剂量,中位值为68%,危及器官组织限量见表1。
首程SBRT(SBRT_1st)治疗中,7例患者肿瘤中位PTV体积为45.5 cm3(15.6~181.8 cm3)。6例患者接受5次分割SBRT,1例患者因肿瘤体积较大接受7次分割治疗。中位总处方剂量为35 Gy,中位生物有效剂量(biologically effective dose, α/β=10,BED10)为59.5 Gy(52.5~65.5 Gy)。
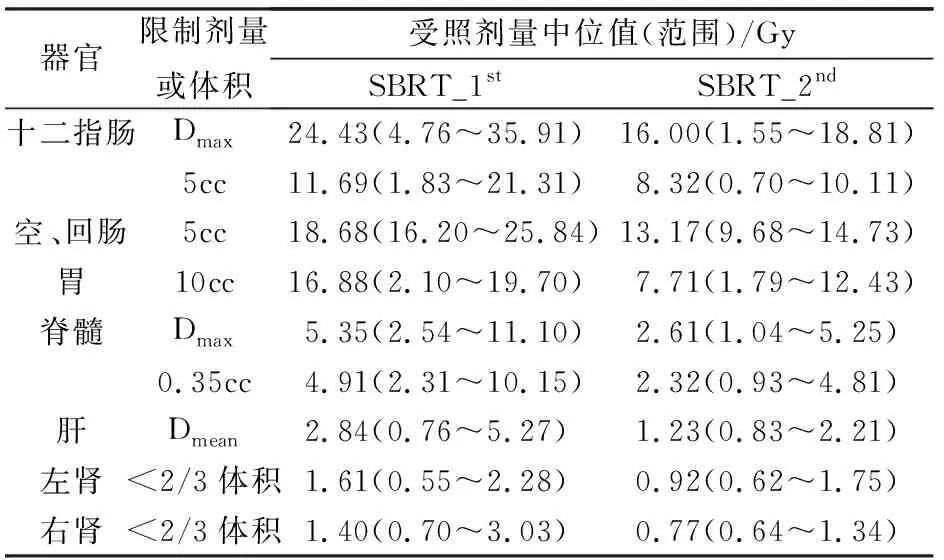
表1 7例患者立体定向放疗危及器官受照剂量
注:SBRT_1st:首程SBRT;SBRT_2nd:再程SBRT;Dmax:最大受照剂量;Dmean:平均受照剂量
再程SBRT(SBRT_2nd)治疗时肿瘤中位PTV体积为21.8 cm3(13.3~64.0 cm3)。4例患者接受5次分割SBRT,1例患者分割次数为6次,余2例为8次。再程SBRT中位总处方剂量为31 Gy,中位BED10为45.8 Gy(40.6~60.9 Gy)。两次SBRT治疗时间间隔中位值为10个月(6~25个月)。
除1例患者拒绝化疗外,其余6例患者治疗过程中均接受至少6个周期的序贯化疗,其中1例于SBRT再程治疗后4个月因CA19-9再次升高要求行姑息性手术治疗。7例患者具体治疗方案见表2。
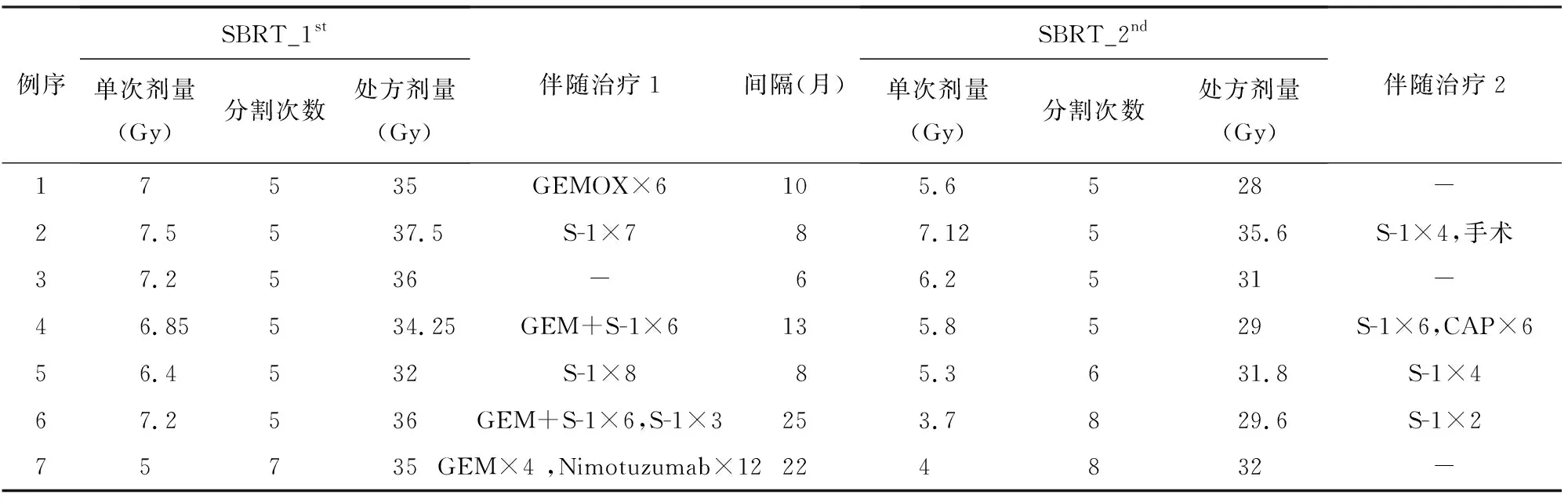
表2 7例患者立体定向放疗及伴随治疗方案
注: -:未接受伴随治疗;GEMOX:吉西他滨+奥沙利铂;S-1:替吉奥;GEM:吉西他滨;CAP:卡培他滨;Nimotuzumab:尼妥珠单抗
三、生存分析
随访截止2017年12月,7例患者中4例死亡,3例存活,分别随访31、32、38个月。7例患者中位OS-1为30个月(15~38个月,图1A),18、24、36个月生存率分别为71.4%、57.1%、42.9%。接受再程SBRT治疗后7例患者中位OS-2为13个月(9~20个月,图1B),12、18个月总生存率分别为71.4%、47.6%。
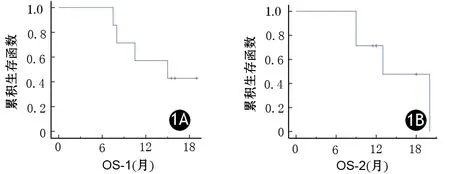
图1 7例患者首程SBRT(1A)及再程SBRT(1B)后生存曲线
7例患者接受首程SBRT治疗后中位LFRS-1为10个月(6~25个月,图2A),6、12、18个月局部无复发生存率分别为85.7%、42.9%、28.6%。再程SBRT治疗后1例患者随访至11.5个月尚未发生局部进展,2例患者分别于治疗后2、11个月发生肝转移。全部患者SBRT再程治疗后中位LFRS-2为11个月(6~15个月,图2B),6、12个月局部无复发生存率分别为71.4%、21.4%。

图2 7例患者首程SBRT(2A)及再程SBRT(2B)后LFRS曲线
四、疗效评估
1.RECIST评估:7例患者初诊时中位靶区最长径为31 mm(22~46 mm)。首程SBRT治疗后1个月1例(14.3%)患者部分缓解(partial response, PR),6例(85.7%)疾病稳定(stable disease, SD);治疗后3个月4例(57.1%)PR,3例(42.9%)SD;治疗后6个月4例(57.1%)维持PR,2例(28.6%)维持SD,1例(14.3%)未接受化疗的患者出现局部复发。
再程SBRT治疗前7例患者肿瘤中位最长径为28 mm(13~43 mm),治疗后1个月7例患者均SD;治疗后3个月3例(42.9%)PR,4例(57.1%)维持SD;治疗后6个月6例评估同前,1例(14.3%)出现病情进展(progression disease, PD)。该患者接受首程SBRT治疗后1个月肿瘤最长径缩小45.7%,达到PR。再程治疗后4个月CA19-9再次升高,肿瘤评估为SD,患者强烈要求下接受姑息性手术治疗,术后2个月出现术区种植转移,导致局部控制失败,术后5个月患者死亡。
2.CA19-9水平变化:7例患者接受首程SBRT治疗后1、3个月,CA19-9水平显著下降(P=0.043,P=0.068),接受再程SBRT治疗后1、3个月,CA19-9水平也随时间延长显著下降(P=0.018,P=0.043),差异均有统计学意义(图3)。再程治疗后未接受化疗患者的CA19-9水平同样显著下降。
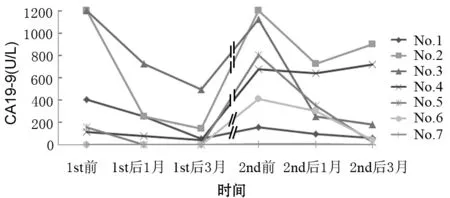
图3 7例患者两次SBRT治疗前后CA19-9变化
3.疼痛程度变化:全部患者SBRT治疗前均存在不同程度的上腹痛,NRS疼痛评分中位值为5分(3~7)。首程SBRT治疗后1个月疼痛明显好转,NRS评分显著下降(0~2分,P=0.017),其中5例首程SBRT结束时疼痛消失。1例治疗前为7分,首程SBRT治疗结束时为4分,治疗后1个月继续下降至2分。再程SBRT治疗前7例患者NRS评分中位值为5分(0~7分),治疗后1月NRS评分显著降低(0~4分,P=0.026),其中4例治疗结束时疼痛消失,2例治疗后1个月疼痛明显好转,1例疼痛较前好转,但仍影响睡眠(图4)。
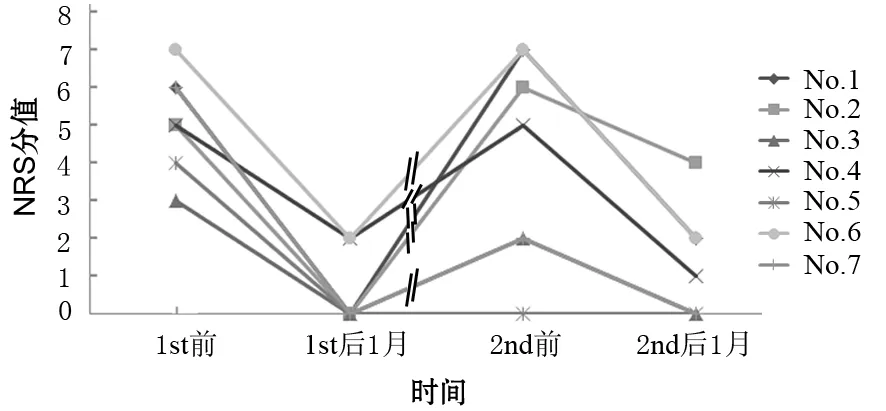
图4 7例患者两次SBRT治疗前后NRS评分变化
4.安全性:全部患者两次SBRT治疗中均未出现3级或3级以上的不良事件。首程SBRT治疗期间1例患者出现2级恶心、呕吐,1例患者出现1级乏力,余5例患者无放疗相关不良事件。再程SBRT治疗期间5例患者出现1级急性反应,主要表现为恶心(4例)、腹泻(1例)、乏力(2例),2例患者出现2级急性反应,分别为腹泻、骨髓抑制,未出现晚期不良反应。
讨 论
胰腺癌起病隐匿,预后差。因胰腺癌初诊患者中仅约20%患者有机会接受根治性手术治疗,因此放疗成为提高胰腺癌患者局部控制率的重要手段[6]。但由于胰腺肿瘤位置的特殊性,常规外照射毒性反应大、治疗周期长,时常影响到全身化疗的应用,进而影响生存获益[7]。
SBRT能够提高靶区分次剂量,降低周围危及器官的剂量,可以有效地提高肿瘤局部控制率及降低不良反应[8],改善患者的总生存[9-10],同时能安全有效地联合化疗治疗[11]。2017年Petrelli等[12]对19项SBRT治疗局部晚期胰腺癌的临床研究进行荟萃分析,1 009例患者的中位生存期为17个月,1年生存率为51.6%。而常规外照射联合吉西他滨或氟尿嘧啶为基础的放化疗综合治疗患者的中位生存期仅为8~11个月[13]。
肿瘤局部控制失败是影响胰腺癌患者生存以及生活质量的重要因素[14]。即使初诊为早中期能够接受根治性手术治疗的患者,不可切除的局部复发同样严重影响其生存。对于既往接受过放疗的局部复发胰腺癌患者,SBRT能够提高其生活质量,延长生存期。Lominska等[3]回顾性分析14例常规外照射治疗后出现局部复发并接受SBRT治疗的胰腺癌患者,中位OS为5.9个月,SBRT中位剂量22.5 Gy/3-5 fx,其中2例接受了分割照射的患者发生3级晚期胃肠道不良反应(肠梗阻、胃穿孔)。Wild等[15]报道18例患者,接受中位剂量25 Gy的5分割SBRT,中位OS为8.8个月,1例患者发生3级晚期胃肠道不良反应(肠梗阻)。Dagoglu等[16]报道30例既往接受放疗(包括常规外照射、SBRT以及挽救性放疗)的胰腺癌复发患者再次行SBRT治疗,其中Ⅰ、Ⅱ期患者14例,Ⅲ期患者16例,中位OS为14个月,复发后SBRT中位剂量为25 Gy/5 Fx, 2例患者出现3级急性不良反应(胃肠道出血及疼痛),2例患者出现3级晚期不良反应(肠梗阻)。Koong等[17]对28例常规外照射后出现复发的胰腺癌行SBRT治疗,其中9例患者接受单次分割SBRT,14例患者接受5次分割SBRT,中位OS为8.5个月,6例患者出现2、3级不良反应,其中4例接受单次分割SBRT治疗。以上研究提示多次分割的SBRT不良反应可耐受,同时对既往接受常规外照射的胰腺癌患者有一定的生存获益。
目前SBRT已经逐渐代替常规外照射,成为胰腺癌,特别是局部晚期胰腺癌的重要局部控制手段。既往研究中仅Dagoglu报道9例患者首程以及再程放疗均为SBRT治疗,但并未单独阐述这9例患者的分期、生存以及不良反应。本研究收集了7例Ⅲ期胰腺癌患者,首程与再程放疗均采用SBRT。中位总OS为30个月,再程SBRT治疗后中位OS为13个月,较既往研究的总体生存时间长,其原因可能是本研究再程SBRT治疗的中位剂量为31 Gy,较文献报道偏高,因此明显提高了局部控制率,改善患者预后。此外,本组患者未出现3级或3级以上不良反应,再程SBRT治疗后1个月多数患者(6/7)疼痛明显好转, CA19-9明显下降, 3例未接受序贯化疗的患者的CA19-9同样呈现显著下降趋势。
综上所述,对于局部晚期胰腺癌SBRT治疗后照射野内复发的患者,再程SBRT治疗能够提高患者的局部控制率,延长生存期,改善患者生活质量,且不良反应可耐受,可能成为胰腺癌复发患者有效的治疗方式。
参 考 文 献
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018[J]. CA Cancer J Clin, 2018, 68(1): 7-30. DOI: 10.3322/caac.21442.
[2] Taieb J, Pointet AL, Van Laethem JL, et al. What treatment in 2017 for inoperable pancreatic cancers?[J]. Ann Oncol, 2017, 28(7): 1473-1483. DOI: 10.1093/annonc/mdx174.
[3] Lominska CE, Unger K, Nasr NM, et al. Stereotactic body radiation therapy for reirradiation of localized adenocarcinoma of the pancreas[J]. Radiat Oncol, 2012,7:74. DOI: 10.1186/1748-717X-7-74.
[4] 中国临床肿瘤学会胰腺癌专家委员会. 胰腺癌综合诊治中国专家共识(2014年版)[J]. 临床肿瘤学杂志, 2014(04):358-370.
[5] Grimm J, LaCouture T, Croce R, et al. Dose tolerance limits and dose volume histogram evaluation for stereotactic body radiotherapy[J]. J Appl Clin Med Phys, 2011,12(2):3368.
[6] Sener SF, Fremgen A, Menck HR, et al. Pancreatic cancer: a report of treatment and survival trends for 100,313 patients diagnosed from 1985-1995, using the National Cancer Database[J]. J Am Coll Surg, 1999,189(1):1-7. DOI: 10.1016/S1072-7515(99)00075-7.
[7] Vernerey D, Hammel P, Pagetbailly S, et al. Prognosis model for overall survival in locally advanced pancreatic cancer (LAPC): an ancillary study of the LAP 07 trial[J]. Ann Oncal, 2014, 25(suppl 2):ii105-ii105. DOI: 10.1093/annonc/mdu193.2.
[8] Moningi S, Marciscano AE, Rosati LM, et al. Stereotactic body radiation therapy in pancreatic cancer: the new frontier[J]. Expert Rev Anticancer Ther, 2014,14(12):1461-1475. DOI: 10.1586/14737140.2014.952286.
[9] Yechieli RL, Robbins JR, Mahan M, et al. Stereotactic body radiotherapy for elderly patients with medically inoperable pancreatic cancer.[J]. Am J Clin Oncol, 2017, 87(2):22-26. DOI: 10.1097/COC.0000000000000090.
[10] Kim CH, Ling DC, Wegner RE, et al. Stereotactic body radiotherapy in the treatment of pancreatic adenocarcinoma in elderly patients[J]. Radiat Oncol, 2013,8:240. DOI: 10.1186/1748-717X-8-240.
[11] Makherjee S, Hurt CN, Bridgewater J, et al. Gemcitabine-based or capecitabine-based chemoradio therapy for locally advanced pancreatic cancer(SCALOP): a multicentre, randomised, phase 2 trial[J]. Lancet Oncol, 2013, 14(4):317-326. DOI: 10.1016/S1470-2045(13)70021-4.
[12] Petrelli F, Comito T, Ghidini A, et al. Stereotactic body radiation therapy for locally advanced pancreatic cancer: a systematic review and pooled analysis of 19 trials[J]. Int J Radiat Oncol Biol Phys, 2017,97(2):313-322.DOI: 10.1016/j.ijrobp.2016.10.030.
[13] Loehrer PS, Feng Y, Cardenes H, et al. Gemcitabine alone versus gemcitabine plus radiotherapy in patients with locally advanced pancreatic cancer: an Eastern Cooperative Oncology Group trial[J]. J Clin Oncol, 2011, 29(31):4105-4112. DOI: 10.1200/JCO.2011.34.8904.
[14] Tseng JF, Raut CP, Lee JE, et al. Pancreaticoduodenectomy with vascular resection: margin status and survival duration[J]. J Gastrointest Surg, 2004,8(8):935-949, 949-950. DOI: 10.1016/j.gassur.2004.09.046.
[15] Wild AT, Hiniker SM, Chang DT, et al. Re-irradiation with stereotactic body radiation therapy as a novel treatment option for isolated local recurrence of pancreatic cancer after multimodality therapy: experience from two institutions[J]. J Gastrointest Oncol, 2013,4(4):343-351. DOI: 10.3978/j.issn.2078-6891.2013.044.
[16] Dagoglu N, Callery M, Moser J, et al. Stereotactic Body Radiotherapy (SBRT) Reirradiation for Recurrent Pancreas Cancer[J]. J Cancer, 2016,7(3):283-288. DOI: 10.7150/jca.13295.
[17] Koong AJ, Toesca D, von Eyben R, et al. Reirradiation with stereotactic body radiation therapy after prior conventional fractionation radiation for locally recurrent pancreatic adenocarcinoma[J]. Adv Radiat Oncol, 2017,2(1):27-36. DOI: 10.1016/j.adro.2017.01.003.

