金蛭方对缺血性中风大鼠caspase-3、Bax、Bcl-2蛋白表达的影响
1.河北省迁安市中医医院,河北 迁安 064400;2.河北省迁安市人民医院,河北 迁安 064400; 3.河北中医学院,河北 石家庄 050000
缺血性中风所致脑损伤的病理机制尚不完全清楚,目前有多种研究,其中细胞调亡在缺血半暗带损伤级联反应过程中起着十分重要的作用[1],因此关于神经细胞调亡机制的探索及基于抗调亡为靶点的治疗药物探究是缺血性中风的研究热点。金蛭方系课题组经过多年筛选出的治疗缺血性中风的效方,临床应用10余年,疗效明显,但其作用机制不十分明确,本研究以期从细胞凋亡角度探讨金蛭方对缺血性中风的作用机制。
1 材料与方法
1.1 动物 健康雄性SD大鼠60只,清洁级,体重250~300 g,由河北省实验动物中心提供,合格证号:1119069。
1.2 药物与试剂 金蛭方组成:水蛭、郁金、川芎、冰片(由迁安市中医医院制剂室制备),上4味除冰片外水提浓缩成高、低剂量后加入相应研磨冰片,所含生药分别为:0.30 g/mL(高剂量)、0.15 g/mL(低剂量)。尼莫地平片(郑州瑞康制药有限公司提供,国药准字:H41022175,规格:20 mg/片)。按体重0.00 1g/mL配制成水溶液。
Caspase-3(ab13585),Bcl-2抗体(ab692),Bax抗体(ab77566),Actin 抗体(ab5694),bolt 封闭液(ab184868)均由艾博抗(上海)贸易有限公司提供。
1.3 主要仪器 DYCZ-24DN型双垂直电泳槽(济南德高实验室设备有限公司),DYCZ-40D型转移槽(济南德高实验室设备有限公司),LT-X型实验室温控摇床(Adolf Kuhner公司),WH-300-LCD型电泳仪(上海双琪生物科技有限公司),AR0136-04型PVDF膜(博士德生物工程公司)。
1.4 造模方法 参考改良的Longa法[2]:颈部正中切口,用3-0手术丝线结扎颈外动脉(ECA)远端及枕动脉,在结扎线距分叉部2 mm处剪断ECA,将一端已加工成光滑球形的尼龙线从ECA残端插入进行结扎,将尼龙线经颈总动脉(CCA)分叉部插入颈内动脉(ICA),此时松开CCA,ICA套线恢复血流,线栓推送顺滑,无出血。将线栓向上深入至分叉以上18~19 mm达到大脑中动脉开口处,将颈总动脉连同尼龙线一起结扎,缝合切口后外留尼龙线0.5 cm,放到单笼中,2 h后外拉尼龙线使其球端回至ECA进行缺血后再灌注。参照Longa评定法,进行神经功能缺损程度的评价,分为5个等级4分:0分,无明显可见的缺损改变;1分,对侧前肢可见屈曲、内收;2分,向偏擁侧转圈;3分,向偏雜侧倾倒;4分,不能自主行走,意识不清;1~3分造模成功,0分与4分均为不合格模型,需要剔除。造模成功率100%。
1.5 实验分组与给药[3]60只大鼠自由进食饮水,饲养于18~22 ℃明暗各12 h的清洁级动物实验室内,喂养1周后,随机分为5组。①假手术组:手术时仅作颈部手术切口,钝性分离颈前肌,游离暴露颈总、颈外、颈内动脉,术后当日灌服蒸馏水;②模型对照组(简称模型组):造模当日灌服蒸馏水;③金蛭方低剂量组(简称低剂量组):造模当日灌服金蛭方,每日用药剂量为1.5 g/kg(相当于成人剂量的10倍);④金蛭方高剂量组(简称高剂量组):术后当日灌服金蛭方,每日用药剂量为3.0 g/kg (相当于成人剂量的20倍);⑤阳性药尼莫地平片对照组(简称对照组):术后当日灌服尼莫地平片,每日用药剂量为0.01g/kg (相当于成人剂量的20倍)。各组1次/d灌胃,每次用药体积均按1 mL/100g计算,连续给药2周。因给药操作不当,模型组低剂量组各死亡1只大鼠,高剂量组死亡2只大鼠。
1.6 检测方法 实验2周末,于最后1次给药禁食12 h后,戊巴比妥钠45 mg/kg腹腔注射麻醉,迅速断头冰浴中取右脑皮质与白质部分,滤纸吸干血迹,将大鼠皮质部分放入冻存管,存入液氮中备用。
1.7 western-blot检测蛋白含量
1.7.1 溶液配制 ①1.5M Tris-HC1(PH8.8):准确称量Tris碱18.15g,去离子水80 mL,用浓盐酸调PH值至8.8,定容至,100 mL。②1.0M Tris-HC1(PH6.8);准确称量12.1g,去离子水80 mL,用浓盐酸调PH值至6.8,定容至,100 mL。③10%过硫酸胺:准确称量过硫酸胺0.1g溶于1 mL去离子水中,现用现配。④10%SDS:180 mL水中溶解20g电泳级SDS,加热至68 ℃水浴助溶,用浓盐酸调至PH值至7.2,加水定容至200 mL。⑤Tris甘氨酸电泳缓冲液(5×):准确称量碱15.1 g,甘氨酸94 g,SDS5 g,适量去离子水溶解,定容至1000 mL。⑥电转移缓冲液:准确称量甘氨酸2.9g, Tris碱5.8 g,SDS0.37 g,甲醇200 mL,加去离子水定容至1000 mL。⑦TBS-T(0.05%):准确称量Tris碱2.42 g,NaCl8 g,适量去离子水溶解,盐酸调PH值至7.6,Tween-20 0.5 mL,加水定容至1000 mL。
1.7.2 祥本蛋白提取 依照电泳上样量需要,用水及5×loading buffer调整蛋白浓度,100 ℃煮沸变性5 min。
1.7.3 丙烯酰胺凝胶电泳 ①根据目的蛋白的分子量,配制15%的分离胶,5%浓缩胶。②待检测蛋白样品上样量:上样50 μg。③电泳条件;浓缩胶恒压80 v,约20 min;分离胶恒压120 v,电泳至溴酚蓝到凝胶底部。
1.7.4 湿转转膜 ①转膜方法;准备一张大小合适的PVDF膜,浸泡于甲酵中30sec,再转移至电转液中,备两张与膜大小一样的厚滤纸浸泡于电转液中备用;切除多余凝胶部分,按照滤纸、凝胶、PVDF膜、滤纸的顺序放入海绵垫夹层中,起尽气泡。②转膜条件:按照电流300 mA恒流转膜;0.22 um孔径PVDF膜,转膜时间40 min
1.7.5 WB检测目的蛋白 ①封闭;转移结束后将PVDF膜浸泡于Western blot封闭液中,摇床中轻摇1 h。②一抗稀释:用1%BSA/5%milk化稀释一抗。③一抗孵育:封闭结束后,将PVDF膜置于杂交袋中,加入2中配制好的一抗,用封膜机封口,4 ℃解育过夜。④洗膜;TBST洗膜3次,每次6 min。⑤二抗孵育:用Western blot封闭液稀释二抗,羊抗兔-HRP、羊抗小鼠-HRP1:5000稀释,室温轻摇50 min。⑥洗膜:TBST洗膜3次,每次5 min。⑦ECL反应、胶片曝光:将PVDF膜浸泡于ECL显色液中1 min,暗室中曝光、显影并定影。

2 结果
模型组大鼠缺血侧皮质区Bcl-2蛋白表达较假手术组明显降低(P<0.01);caspase-3、Bax蛋白表达较假手术组明显升高(P<0.01)。用药后各治疗组大鼠缺血侧皮质区Bcl-2蛋白表达明显升高(P<0.05,P<0.01);caspase-3、Bax蛋白表达明显降低(P<0.05,P<0.01)。高、低剂量组在增强Bcl-2蛋白表达和降低caspase-3、Bax蛋白表达方面的作用优于对照组(P<0.05)。详见图1,表1。

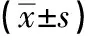

组别鼠数caspase-3BaxBcl-2假手术组120.204±0.017∗∗0.241±0.026∗∗0.943±0.031∗∗模型组110.558±0.0420.667±0.0430.361±0.037高剂量组100.213±0.043∗∗▲0.349±0.064∗∗▲0.566±0.023∗∗▲低剂量组110.295±0.063∗∗▲0.342±0.0321∗∗▲0.551±0.038∗∗▲对照组120.416±0.037∗0.457±0.0841∗∗0.476±0.056∗∗
注:与模型组比较,*P<0.05,**P<0.01;与对照组比较,▲P<0.05。
3 讨论
课题组通过对中风病临床症候学研究认为缺血性中风患者多是在气血内虚的基础上,加之劳倦内伤、忧思恼怒、嗜食厚味、烟酒等诱因,导致气血逆乱,直冲犯脑,致气血瘀滞,脑脉痹阻。气滞、血瘀、络阻为本病的主要病机,“气行则血行”,行气、活血、通络为其有效治则,笔者根据金蛭方,研制院内制剂“金蛭胶囊”(制剂号:冀药制字Z20051013)治疗缺血性中风10余年,疗效满意。方中水蛭破血逐瘀、通经活络,《本草汇言》曰:“水蛭逐恶血、散瘀血之要药也”;郁金行气活血,化痰降火,《本草汇言》曰:郁金其性清扬,能散郁滞,顺逆气,上达高巅,善行下焦;川芎行气活血,历代医家认为其:“善治中风,治风圣药”[4];冰片醒神通窍,《本草衍义》曰:“芳香走窜,引药上行,独行则势弱,佐使则有功”,四药合用,共奏活血、化瘀、通络之功。
程序性死亡是保持细胞生存和死亡间平衡的关键因素。而凋亡作为程序性死亡的最主要类型,一直是医学研究的热点[5]。在缺血性脑损伤中,与坏死的细胞相比,凋亡细胞仅占死亡细胞总数的小部分[6],而就缺血半暗带而言,凋亡细胞死亡却是最主要的死亡方式[7]。Caspase-3是Caspase家族成员之一,它在细胞调亡执行阶段中起着核心作用,活化的Caspase-3导致神经元细胞DNA断裂,抑制细胞増殖,并且破坏细胞之间的平衡状态[8]。Caspase-3表达上调的细胞调亡是缺血性和出血性脑损伤的重要标志[9]。Bcl-2蛋白家族是细胞凋亡过程中的调控基因,Bcl-2蛋白具有抑制细胞调亡的功能,Bax蛋白则具有促进细胞调亡的功能[10]。Bcl-2通过介导线粒体外膜通透转运孔道复合体的开放,抑制和调亡诱导因子AIF等促调亡蛋白的释放阻止调亡的进程。Bax只有收到调亡信号刺激被激活后,发生分子构造改变,移位并插入线粒体外膜后形成Bax大孔道,破坏线粒体膜的完整性,并与Bcl-2等抑制调亡的蛋白对抗,阻止其抗调亡作用的发挥。因此,检测caspase-3和Bcl-2、Bax缺血性卒中后的表达情况,即可说明细胞调亡的状况。
本研究表明,缺血性中风大鼠模型缺血侧皮质区caspase-3、Bax蛋白表达明显升高,Bcl-2蛋白表达明显降低。经药物干预后,各治疗组可降低大鼠模型缺血侧皮质区caspase-3、Bax蛋白表达,升高Bcl-2蛋白表达表达,表明金蛭方通过调节caspase-3、Bax、Bcl-2蛋白表达,以达到减轻脑缺血细胞凋亡、改善神经功能、预防和治疗缺血性中风的作用,但其深入的作用机制有待进一步的探讨。
[1]张明慧.地黄饮子加减方对脑缺血再灌注模型大鼠细胞稠亡机制的影响[D].北京:北京中医药大学,2017,20.
[2]Zea- Longa EL,Weinstein PR,Carlson S,et al.Reversible Middle Cerebral Artery Occlusion without Craniectomy in Rats[J].Stroke,1989,20(l):84-91.
[3]AsmarR,MakonnaO,BrisacAM,et al. Comparison between the effects of angiotensin-converting-enzyme inhibitors and angiotens inⅡantagonists [J].Therapie,1998,53(3):253-270.
[4]陈可冀.瘀血证与活血化瘀源流概述[J].中医杂志,1979(9):51-57.
[5]Suzanne M,Steller H.Shaping organisms with apoptosis[J]. Cell Death Differ, 2013(20): 669-675.
[6]Love S,Barber R,and Wilcock GK.Neuronal death in brain infarcts in man[J].Neuropathol Appl Neurobiol,2000(26):55-66.
[7]Sairanen T, Karjalainen-Lindsberg ML, Paetau A, et al. Apoptosis dominant in the periinfarct area of human ischaemic stroke--a possible target of antiapoptotic treatments[J].Brain,2006,129:189-199.
[8]Baek SS,Jun TW,Kim KJ,et al.Effects of postnatal treadmill esercise on apoptotic neuronal cell death and cell proliferation of matemal-sparatedratpups[J].Brain Dev,2012,34(1):45-56.
[9]Simard JM,Geng Z,Woo SK lvanova S,et al.Glibenclamide reduces inflammation,vasogenic edema,and caspase-3 actination after subarachnoid hemorrhage[J]Cereb Blood Flow Metab,2009,29(2):317-330.
[10]Bosoi CR,Yang X,Huynh J,et al.Systemic oxidative Stress is implicated in the pathogenesis of brain edema in rats with chronic liver failure[J].Free Radic Biol Med,2012,52(7):1228-1235.

