男性乳腺包裹性乳头状癌合并浸润性导管癌1例
吴佳玲,侯秀昆,杨 光,孙丽鹏
(大连医科大学附属第一医院 超声科,辽宁 大连 116011)
1 临床资料
患者,男,40岁,以“发现左乳肿物4个月”为主述,于2015年5月11日收住于大连医科大学附属第一医院乳腺外科。患者1年前曾有乳腺外伤史,未予诊治,于4个月前无意发现左侧乳腺有一肿物,花生米大小,无胀痛、刺痛、隐痛,4月以来肿物逐渐增大,5月5日常规超声检查示:左胸壁皮下囊实混合型占位,以囊性为主,形态规整,界清,大小约7.5 cm×4.7 cm,实性部分见少许血运。入院专科查体:双乳头无糜烂、刺痛及瘙痒,无乳头溢液,左乳腺内可触及8 cm×4 cm大小肿物,质韧,实质感,界清,活动度可,表面皮肤有红肿,同侧腋窝未触及肿物,周围淋巴结未触及。5月12日常规超声结合自动乳腺全容积成像(automobile breast volume scan imaging, ABVS)发现:双侧乳头下方见腺体样低回声区,左侧可见一囊实混合性回声团,椭圆形,大小约85 mm×49 mm,界清,实性部分形态不规则,内可探及少许血运,测及高阻动脉频谱,其旁可见异常低回声区,回声不均,范围约25 mm×18 mm, 边界不清(图1)。超声提示:双侧男性乳腺发育,左侧乳腺混合性占位及左乳异常低回声区(BI-RADS 4B类)。钼钯X线检查示:右侧乳腺增生(BI-RADS 2类),左乳腺肿物影,建议手术切除(BI-RADS 4A类)。术前诊断左乳肿物,拟行左乳肿物切除术。5月14日行手术, 术中见一9.0 cm×5.0 cm×5.0 cm高张力肿物,包膜完整,边界清,内有流动感,沿肿物包膜钝性游离并完整切除肿物及其包膜,肿物未侵及胸大肌,剖开,内有大量暗红色血性液溢出,其中可见一约3.0 cm×3.0 cm红褐色菜花性肿物,术中病理示左乳腺癌,缝合切开,于外上象限分5点分别注射纳米碳约0.5 mL,共取出9枚0.5~1.0 cm蓝染淋巴结,术中冰冻提示:0/9未见癌转移。术后大体病理所见:左乳腺组织内剖面见一囊腔,大小为4.5 cm×3.5 cm×1.5 cm,内容物已流失,囊内见不规则肿物,部分肿物已游离,大小为3.0 cm×2.5 cm×1.2 cm,肿物灰红色,表面粗糙,肿物未累及皮肤,于囊性肿物远离皮肤一侧囊壁外见少许乳腺组织,内可触及一灰白肿物,大小约1.5 cm×1.0 cm×0.6 cm,肿物无包膜,界不清,质硬,周围乳腺灰白间淡黄,质软。光镜下:囊壁内导管上皮细胞异性增生,细胞核大深染,胞浆少,核浆比增大,可见核分裂,呈实性、筛状或乳头状膨胀生长,局灶异型细胞呈巢状浸润生长,细胞巢间有纤维束间隔,细胞大小较为一致,呈圆形/卵圆形,浆核比例失调,胞浆嗜酸性。见图2。免疫组化结果显示:CK5/6(-),EGFR(-),ER(+++>75%),Her-2(0),Ki-67(+20%~30%),PR(+++>75%),P53(弱+25%~50%)。 诊断为乳腺包裹性乳头状癌伴浸润性导管癌(SBRⅡ级),两病灶,大小分别为3.0 cm×2.5 cm×1.2 cm,1.5 cm×1.0 cm×0.6 cm,未见明确神经及脉管侵犯。术后6日,患者生命体征平稳,切口外敷料洁,引流管通畅,引出极少量浆液性液体,拔出引流管,观察手术切口愈合良好,予以出院,建议3~5 d换药1次,普外科门诊随诊。未予化疗,术后3年电话随访,患者自述外院超声复查未见复发及转移。
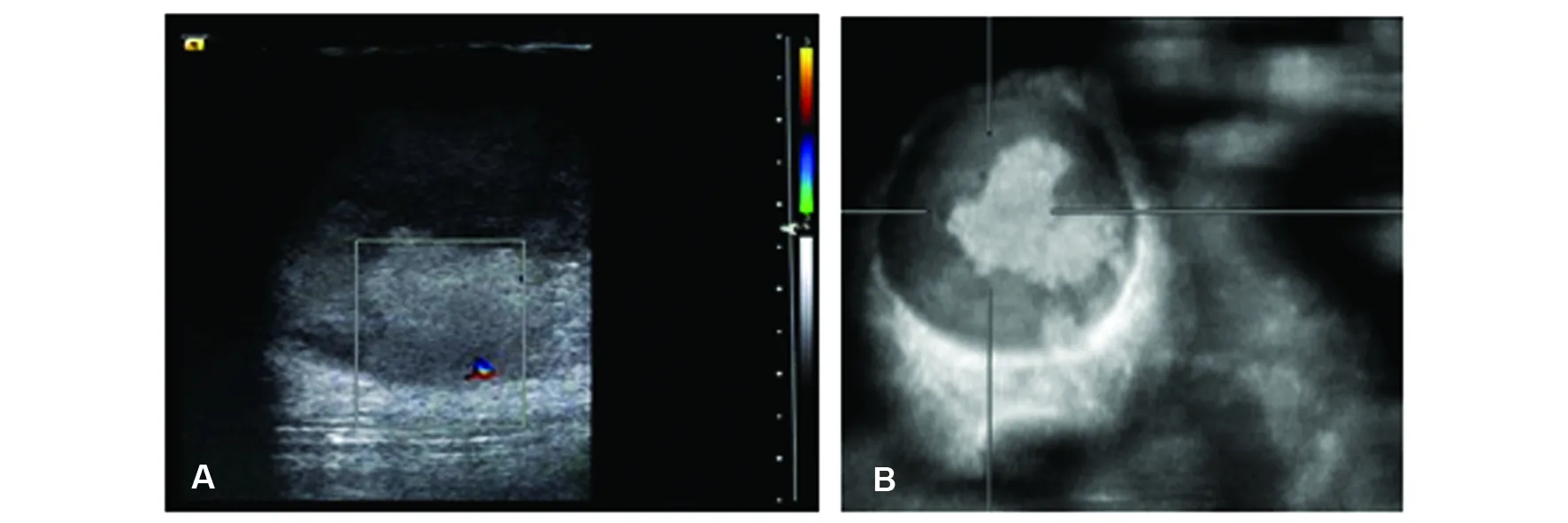
A:彩色多普勒超声可见一囊实混合性包块,实性部分内可见血流信号;B: ABVS冠状面清晰显示囊壁及囊内实性结节成分图1 常规超声二维切面及ABVS冠状面声像图表现Fig 1 Images of routine ultrasound cross-section and ABVS coronary section

A: 癌组织成乳头状生长,乳头表面被覆大小一致的肿瘤性上皮细胞(HE×200); B: 局部呈浸润性生长的肿瘤细胞巢,但未突破囊壁 (HE×200)图2 病理切片结果Fig 2 Results of postoperative pathological sections
2 讨 论
乳腺包裹性乳头状癌 (encapsulated papillary carcinoma,EPC) 是一种罕见的乳腺癌,又名囊内乳头状癌、包被型乳头状癌、囊内乳头状癌的非特殊型,是乳头状癌的一种变异型,低、中分级肿瘤性上皮细胞被覆在纤维脉管轴心,周围被纤维性囊围绕[1]。2012 年,WHO 乳腺肿瘤组织学分类[3]将其归为与导管内乳头状癌并列的一种乳腺癌类型,EPC与导管内乳头状癌的不同之处在于,其周边一般肌上皮层少见或者缺失。EPC 肿瘤生长在囊壁内,囊内常有陈旧性出血,囊壁可见含铁血黄素沉积,囊壁内衬细胞的筛状、微乳头状及实性结构才是囊内乳头状癌的特征性改变,也是与导管内乳头状癌进行鉴别的要点之一[3]。EPC多见于绝经后妇女,男性亦可发生,发病年龄56~92岁,占乳腺恶性肿瘤的 0.5%~2.0%[4-5]。临床表现为可触知的乳房肿块,一般病史很长,伴或不伴有乳头溢液(清亮或血性),大多位于乳晕下或近乳晕区,直径1.5~10.0 cm,早期常无明显疼痛不适,肿瘤增大时可出现肿胀不适,就诊时肿块一般比较大。
少数浸润性导管癌也可为囊实性,但与EPC表现具有差异性,前者多表现为形态不规则、边界不清的分叶状肿块,实性成分为主,血流信号明显,超声较X线检查能更进一步明确EPC的部分特征性表现[6]。也有学者认为EPC没有特殊的临床及影像学特征,但通常较普通乳头状病灶大[7]。本次病例发现的EPC病灶,肿瘤最大径达9 cm,囊壁边界清楚,ABVS成像发现腺体内异常低回声,提示BI-RADS 4B类,术后病理证实为EPC合并浸润性导管癌。手术方式取决于病变是否合并其他恶性病变,
当邻近组织没有浸润性癌时,包裹性乳头状癌应按照原位癌来处理。治疗方法推荐包裹性乳头状癌组织连同周围乳腺组织完整切除,术后应进行广泛的取材病理检查,这些对于治疗和评估局部复发的危险是最基本的和必需的[8]。
[1] Rakha EA, Tun M,Junainah E, et al. Encapsulated papillary carcinoma of the breast: a study of invasion associated markers[J].J Clin Pathol,2012,65(8): 710-714.
[2] World Health Organization. WHO classification of tumor of the breast[R].Geneva: WHO, 2012: 106-107.
[3] 卢晓梅,柳玮华.乳腺囊内乳头状癌4例临床病理分析[J].临床和实验医学杂志,2012,11(1): 36-39.
[4] CollinsL C, CarloV P, H wangH, et al. Intracystic papillary carcinomas of the breast a reevaluation using a panel of myoepithelial cellmarkers[J].Am J Surg Pathol, 2006, 30(8): 1002-1007.
[5] Rakha E A, Varga Z, Elsheik S, et al.High-grade encapsulated papillary carcinoma of the breast:an under-recognized entity[J].Histopathology, 2015,66(5):740-746.
[6] 王泽坤,黄波,罗娅红,等. 乳腺包裹性乳头状癌的影像学特点分析[J]. 肿瘤影像学,2017,26(3):170-176.
[7] Lakhani SR, Ellis IO, Schnitt SJ, et al. WHO classification of tumors of the breast[M].Geneva: WHO Press, 2012:1-240.
[8] 牛昀.2012 年版《WHO 乳腺肿瘤分类》新变化与临床治疗的关系[J].中华乳腺病杂志(电子版) ,2014,8 (3):1-5.

