低强度脉冲超声和吡格列酮对脂多糖诱导的OA软骨细胞IGF-1/mTOR/PGE2通路的影响
张婷婷,李雪萍
骨关节炎(osteoarthritis,OA)是一种以关节软骨基质、滑膜以及关节周围组织退变为特征,涉及生化、机械和遗传因素的复杂作用疾病[1-2]。不仅包括细胞分解代谢反应的增加,如II型胶原和I型胶原的净分解代谢,以及细胞外基质合成反应的减少,从而使软骨关节面出现纤维化,形成基质裂缝和垂直裂隙[3]。低强度脉冲式超声(Low intensity pulsed ultrasound, LIPUS)作为一种局部机械刺激,可增加软骨细胞的迁移率和增殖率、外基质蛋白多糖的合成以及促进骨髓间充质干细胞向软骨细胞分化,具有软骨保护作用[4-5]。吡格列酮是临床上较为常用的降糖药物,可以调节细胞内脂质代谢、能量平衡、炎症反应等[6]。近年来研究发现吡格列酮可以激活细胞过氧化物酶体增殖剂激活受体γ(Peroxisome proliferator activated receptors γ, PPARγ),上调自噬相关蛋白(autophagy-related proteins,Agt)、微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)等表达,促进自噬活动,减少炎性因子的累积,起到软骨保护作用[7-8]。研究表明,肿瘤坏死因子(tumor necrosis factor,TNF)、多种白细胞介素(interleukin,IL)、脂多糖(lipopolysaccharide, LPS)在体内外中被认为是软骨组织中较为常见的促炎性细胞因子[9],这些刺激物通过刺激软骨细胞生成基质蛋白酶及其他炎症产物加速OA病理生理进展过程。因此,本研究通过胰岛素生长因子1(insulin-like growth factor-1, IGF-1)/雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)/前列腺素E2(prostaglandin E2,PGE2)途径探讨吡格列酮和LIPUS对LPS诱导的OA软骨细胞的作用比较。
1 材料与方法
1.1 材料 ①实验细胞:所有软骨标本均取自健康新西兰大白兔膝关节。②试剂与设备:胰蛋白酶、高糖完全DMEM(Dulbecco's Modified Eagle's Medium, DMEM)培养基、II型胶原(Type Ⅱ Collagen,COL2)抗体(中国 武汉博士生物工程有限公司)、mTOR抗体、GAPDH抗体(Abcam公司)、实时聚合酶链式反应(realtimepolymerase chain reaction,RT-PCR)相关试剂(美国Invitrogen公司)、细胞活性检测试剂盒(Cell Counting Kit-8,CCK-8) 、IGF-1、PGE2酶联免疫吸附测定 (enzyme-linked immunosorbent assay, ELISA)试剂盒(中国 南京建成生物工程研究所)、免疫化学染色试剂盒(中国 福州迈新生物科技有限公司)、全蛋白提取试剂盒、LPS、吡格列酮(美国sigma公司)、Western电泳仪、湿式电转移槽(美国Bio-Rad公司)。
1.2 方法 ①软骨细胞的分离和培养:取24只体质量约为2.0~3.0kg的健康成年雄性新西兰大白兔,从膝软骨标本表面完好部分提取正常软骨细胞。将膝软骨标本用PBS液冲洗3次并切碎至1.0mm3的小碎片,移入15ml离心管,加入2ml 0.25%胰蛋白酶于37℃恒温箱中消化30min,移去胰蛋白酶液,加入3ml 0.25% II型胶原酶和3ml完全高糖DMEM培养基(含10%的胎牛血清),静置于37℃恒温箱中过夜。次日,取出上清,离心10min(转速1200r/min),弃上清,加入完全高糖DMEM培养基吹打均匀后将细胞种植于培养瓶中,置于37℃恒温箱中。每天用光学显微镜观察细胞生长情况,待细胞铺满瓶底90%左右时传代[4]。②实验分组:选取最佳吡格列酮干预浓度:用1uM,10uM,50uM,100uM不同浓度的吡格列酮分别干预LPS诱导的OA软骨细胞,应用CCK-8检测技术,测定各组软骨细胞的增殖能力,选取增殖能力最强的吡格列酮干预浓度,用于下一步研究。实验分为4组,每组6只,正常组、LPS组、LIPUS组(LPS+LIPUS)、吡格列酮组(LPS+100uM吡格列酮,Pioglitazone组)4组,LIPUS组和Pioglitazone组干预前4h给予LPS预处理,剂量同LPS组(2ug/ml)。③LIPUS及吡格列酮干预软骨细胞:将LIPUS探头涂抹耦合剂后置于培养瓶底部,自由模式,通断比20%,频率为3MHz,强度为40mW/cm2,每次照射20min,1次/d,共7d[10-11]。吡格列酮干预的细胞在含有100uM吡格列酮培养基中连续培养7天,每2天更换一次含有100uM吡格列酮的培养基。④LPS诱导OA软骨细胞方法[12-13]。本研究使用含2ug/ml LPS加入培养基中培养软骨细胞4h建立OA模型。
1.3 检测指标 ①CCK-8检测增值率:取各组软骨细胞进行消化、计数,配制细胞悬液1.2×105个/ml, 96孔细胞培养板中每孔加入100μl细胞悬液。根据CCK-8试剂盒说明书进行增殖率测定。②ELISA检测IGF-1和PGE2的浓度:取各组软骨细胞培养上清液,分别根据ELISA试剂盒说明书进行浓度测定。③免疫化学染色法测定COL2表达:每张爬片滴加2滴3% H2O2-甲醇溶液,室温封闭10min。滴加即用型山羊血清,室温孵育20min。滴加COL2抗体(1∶100稀释)50~100ul,室温孵育2h,PBS浸洗3次。滴加增强剂,室温湿盒孵育30min。PBS浸洗3次。滴加通用型IgG抗体-Fab段-HRP多聚体50ul,室温孵育30min。PBS浸洗3次。每张片子加2滴新鲜配制的二氨基联苯胺溶液。自来水冲洗,将切片放入苏木素染液,染色10min,蒸馏水冲洗,用二甲苯浸泡10min。晾干后在切片上加中性树胶,加盖玻片。光学显微镜下观察软骨细胞中COL2的表达情况,拍照保存。④免疫蛋白印迹法测定mTOR含量:提取细胞蛋白:取出长满软骨细胞的培养皿,去除培养液,用PBS洗一遍,在培养皿中加入1ml的裂解液,充分晃动均匀,使裂解液和细胞充分接触。在冰上裂解20min后用细胞刮将细胞刮下,将细胞移入EP管,放入4℃离心机,15min,12000转。取上清至新的EP管,加入5xSDS-PAGE蛋白上样缓冲液。混合后,放入100℃,加热15min。用于下一步聚丙烯酰胺凝胶电泳。采用聚丙烯酰胺凝胶电泳,湿式电泳槽转膜,聚偏二氟乙烯膜在5%的封闭液中常温震荡封闭2h,分别加mTOR抗体、GAPDH抗体(1∶1000),4℃孵育过夜,缓冲液洗膜3次,加二抗,常温孵育2h,缓冲液洗膜3次,显影液显影,机器曝光。⑤RT-PCR测定mTOR含量。按照PCR试剂盒说明书进行软骨细胞的mTOR,GAPDH的RT-PCR检测。GAPDH作为内参基因。利用 2-ΔΔCT法进行分析软骨细胞mTOR基因表达。引物信息见表1。

表1 RT-PCR引物序列

2 结果
2.1 正常组与模型组软骨细胞比较与鉴定 免疫细胞化学染色示正常软骨细胞COL2染色均成阳性,细胞胞浆内有棕黄色颗粒,胞核基本无着色(图1A)。LPS组LPS诱导的软骨细胞COL2呈弱阳性,细胞胞浆内颗粒少且淡黄,胞核基本无着色(图1B)。
2.2 CCK-8证实吡格列酮促进软骨细胞增殖 与正常组相比,1uM组软骨细胞增殖活力无明显变化,10uM组,50uM组,100uM组软骨细胞增殖活力较强(均P<0.05)。其中,100uM组软骨细胞增殖活力较10uM、50uM组强(均P<0.05)(图2A)。因此,本研究选取100uM吡格列酮与LIPUS进行研究对比。

图1A正常组软骨细胞COL2染色形态学表现(×400)
图1BLPS组软骨细胞COL2染色形态学表现(×400)
(软骨细胞核用黑色箭头表示,细胞内外所表达的COL2染色阳性用红色箭头表示)
2.3 ELISA证实吡格列酮和LIPUS对LPS诱导的OA软骨细胞IGF-1、PGE2的表达作用 干预后,与正常组相比,LPS组的IGF-1表达水平明显降低(P<0.05),而LIPUS组的IGF-1表达水平明显上升(P<0.05),而Pioglitazone组无明显变化。与LPS组相比,Pioglitazone组和LIPUS组的软骨细胞IGF-1表达水平均上升(均P<0.05)。与LIPUS组相比,Pioglitazone组IGF-1水平明显下降(P<0.05)(图2B)。与正常组对比,其余各组PGE2均升高,但仅LPS组和LIPUS组差异有统计学意义(均P<0.05)。与LPS组相比,LIPUS组和Pioglitazone组的软骨细胞PGE2表达水平明显下降(均P<0.05);与LIPUS组相比,Pioglitazone组PGE2明显下降(P<0.05)(图2C)。
2.4 RT-PCR和Western blot证实LIPUS、吡格列酮对LPS诱导的OA软骨细胞mTOR的作用 干预后,与正常组对比,LPS组和LIPUS组软骨细胞mTOR mRNA水平和蛋白含量均升高(均P<0.05),Pioglitazone组的软骨细胞mTOR mRNA水平和蛋白含量降低(均P<0.05);与LPS组相比,LIPUS组和Pioglitazone组的软骨细胞mTOR mRNA水平和蛋白含量明显下降(均P<0.05);与LIPUS组相比,Pioglitazone组mTOR mRNA水平和蛋白含量明显下降(均P<0.05)(表2,图3,图4)。

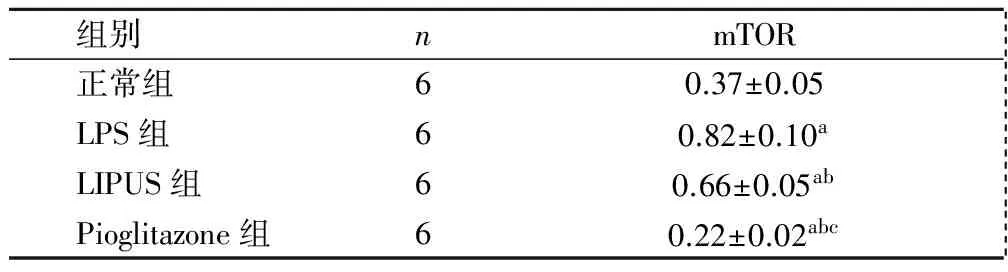
组别nmTOR 正常组60.37±0.05 LPS组60.82±0.10a LIPUS组60.66±0.05ab Pioglitazone组60.22±0.02abc
与正常组比较,aP<0.05;与LPS组比较,bP<0.05;与LIPUS组比较,cP<0.05
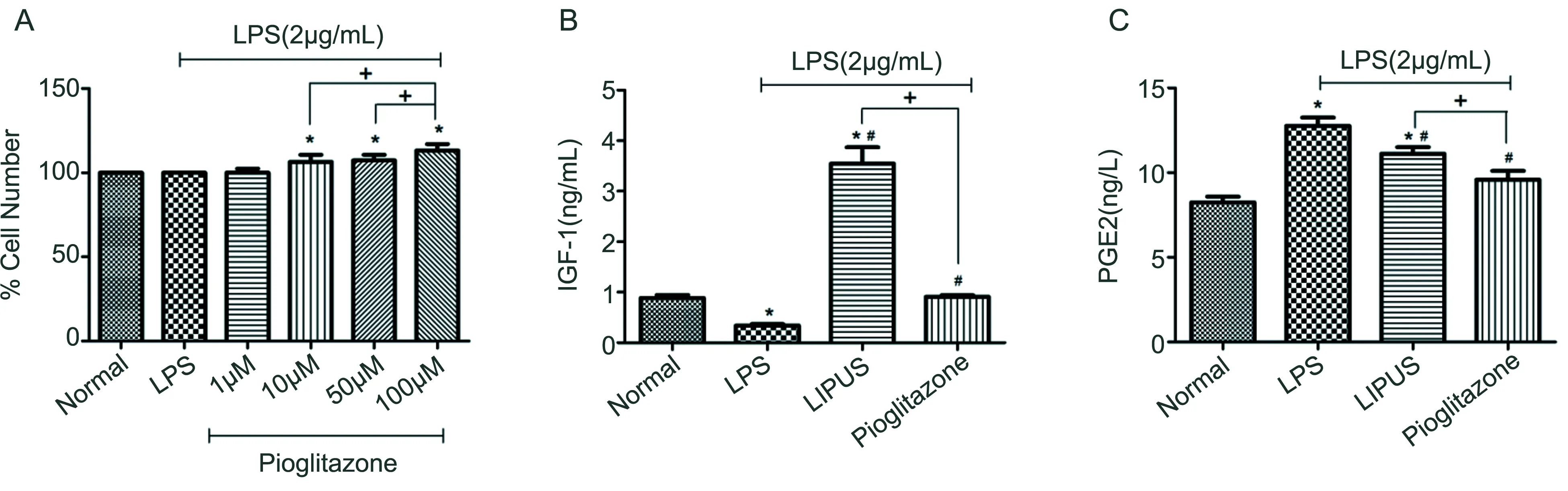
图2 各组软骨细胞增殖活力以及IGF1、PGE2表达水平
(*表示与正常组比较,P<0.05,#表示与LPS组比较,P<0.05,+表示与Pioglitazone组比较,P<0.05)

图3RT-PCR检测各组软骨细胞mTOR的mRNA表达水平比较
(所有数据均以GAPDH为参数)
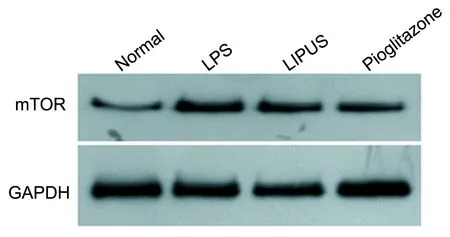
图4Western blot检测各组软骨细胞mTOR蛋白含量比较
(所有数据均以GAPDH为参数)
3 讨论
本研究结果显示,LIPUS可以增加LPS诱导的OA软骨细胞IGF-1的表达增高,且作用较吡格列酮强。IGF-1作为软骨细胞的合成性细胞因子,是各种生长因子中第一个被确认对关节软骨中有分泌调节作用的细胞因子,发挥合成代谢作用,在促进细胞的生存、生长和代谢中起着至关重要的作用,其分泌减少与OA的发生发展密切相关[14-15]。IGF-1在软骨组织工程研究中起到相当重要的角色,主要与抑制软骨细胞内多个信号通路,如:磷脂酰肌醇3-激酶(phosphoinositide 3-kinases,PI3K)/ 蛋白激酶(Akt)/mTOR和Ras/Raf-1/ERK信号通路,通过有丝分裂、抗凋亡作用和刺激软骨细胞外基质的合成有关[16-17]。Li等[18]用3D技术培养体外软骨细胞证明IGF-1可以促进COL2的表达,并且认为≤100ng/ml的IGF-1可以促进关节软骨细胞增殖,呈剂量依赖性。Ikeda等[19]将IGF-1基因转染到人滑膜间充质干细胞,发现其成软骨能力、增殖能力均明显增强,并且呈现出高营养和成骨特性,极大的促进了对受损软骨细胞的修复作用。研究者用吡格列酮治疗30例胰岛素抵抗的多囊卵巢综合征患者后发现血清IGF-1水平显著增加,这可能与直接或间接改善胰岛素敏感性有关[20]。而关于LPIUS对软骨细胞IGF-1的影响研究甚少,LIPUS可以上调骨髓来源的ST2细胞的骨钙蛋白和IGF-1, 并刺激ST2细胞的向软骨细胞分化[21]。Tang等[22]利用超声微泡转染IGF-1cDNA至软骨细胞提高大鼠跟腱损伤愈合速度。
本研究结果显示,LIPUS可以降低LPS诱导的OA软骨细胞PGE2的表达增高,但吡格列酮作用较LIPUS强。PGE2被认为是骨关节炎的促炎症细胞因子和分解代谢介质,可以促进基质金属蛋白酶(Matrix metalloproteinases,MMPs)的合成,抑制COL2和蛋白多糖的生成,从而改变软骨基质修复和降解的平衡状态,加重关节退化和临床症状[23]。王涛等[24]使用聚焦超声单次治疗慢性软组织30min后出现受损组织的PGE2含量降低,提示超声可以较快缓解组织炎症。而在成骨细胞中,LIPUS可以导致PGE2的释放增加以及环氧合酶的表达上调[25]。Chen等[26]用高糖诱导人软骨细胞PGE2,IL-6,MMP-13高表达,但这些被吡格列酮所逆转,且呈剂量依赖性。
mTOR是一种存在于哺乳动物中的Ser/Thr激酶,阻断各种对软骨细胞的生长刺激信号,负性调控软骨细胞的生长代谢,参与OA的病理学进展[27-28]。超声治疗可以选择性抑制巨噬细胞磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/mTOR信号通路起到抑制炎症、抗凋亡、抗脂质聚集作用[29]。而吡格列酮通过PPARα和PPARγ依赖性自噬途径增加细胞脂肪分解,β-氧化和自噬减轻肝脏脂肪变性[30]。本研究结果显示,LIPUS和吡格列酮分别可以减少LPS诱导的OA软骨细胞mTOR的表达。因此,我们猜测LIPUS和吡格列酮可能通过抑制IGF-1/ mTOR/PGE2信号途径减轻软骨细胞炎症反应,促进受损软骨组织修复,阻断关节软骨退变或骨关节炎的发生[31]。
综上所述,LIPUS和吡格列酮可能通过IGF-1/mTOR/PGE2信号通路上调LPS诱导的OA软骨细胞IGF-1的表达,同时抑制PGE2表达,起到OA软骨细胞保护作用。LIPUS促进LPS诱导的OA软骨细胞IGF-1的表达作用较吡格列酮强,而吡格列酮抑制PGE2的表达作用较LIPUS强。
[1] Benito MJ, Veale DJ, FitzGerald O, et al. Synovial tissue inflammation in early and late osteoarthritis[J]. Ann Rheum Dis, 2005,64(9):1263-1267.
[2] Goldring MB, Goldring SR. Articular cartilage and subchondral bone in the pathogenesis of osteoarthritis[J]. Ann N Y Acad Sci, 2010,119(2): 230-237.
[3] Antoniou J, Steffen T, Nelson F, et al. The human lumbar intervertebral disc: evidence for changes in the biosynthesis and denaturation of the extracellular matrix with growth, maturation, ageing, and degeneration[J]. J Clin Invest, 1996,98(4):996-1003.
[4] 夏鹏, 李雪萍, 林强, 等. 低强度脉冲超声对兔膝骨性关节炎软骨细胞整合素-局部粘着斑激酶-促分裂原活化蛋白激酶力化学转导通路相关蛋白表达的影响[J]. 中华物理医学与康复杂志, 2014,36(3):165-170.
[5] Uddin SM, Richbourgh B, Ding Y, et al. Chondro-protective effects of low intensity pulsed ultrasound[J]. Osteoarthritis Cartilage, 2016,24(11):1989-1998.
[6] Li Y, Zhang Y, Chen C, et al. Establishment of a rabbit model to study the influence of advanced glycation end products accumulation on osteoarthritis and the protective effect of pioglitazone[J]. Osteoarthritis Cartilage, 2016,24(2):307-314.
[7] Hsiao PJ, Chiou HC, Jiang HJ, et al. Pioglitazone Enhances Cytosolic Lipolysis, beta-oxidation and Autophagy to Ameliorate Hepatic Steatosis[J]. Sci Rep, 2017,7(1):9030-9037.
[8] Cheng NT, Meng H, Ma LF, et al. Role of autophagy in the progression of osteoarthritis: The autophagy inhibitor, 3-methyladenine, aggravates the severity of experimental osteoarthritis[J]. Int J Mol Med, 2017,39(5):1224-1232.
[9] Nguyen QT, Jacobsen TD, Chahine NO. Effects of Inflammation on Multiscale Biomechanical Properties of Cartilaginous Cells and Tissues[J]. ACS Biomater Sci Eng, 2017,3(11):2644-2656.
[10] Cheng K, Xia P, Lin Q, et al. Effects of low-intensity pulsed ultrasound on integrin-FAK-PI3K/Akt mechanochemical transduction in rabbit osteoarthritis chondrocytes[J]. Ultrasound Med Biol, 2014,40(7):1609-1618.
[11] 瞿燕萍, 程凯, 林强. 低强度脉冲超声经整合素-FAK-p38 MAPK通路对膝关节脂肪垫共培养下软骨细胞的影响[J]. 中华物理医学与康复杂志,2017,39( 4 ): 241-246.
[12] Campo GM, Avenoso A, Campo S, et al. Molecular size hyaluronan differently modulates toll-like receptor-4 in LPS-induced inflammation in mouse chondrocytes[J]. Biochimie, 2010,92(2):204-215.
[13] Campo GM, Avenoso A, Campo S, et al. Purified human plasma glycosaminoglycans reduced NF-kappaB activation, pro-inflammatory cytokine production and apoptosis in LPS-treated chondrocytes[J]. Innate Immun, 2008,14(4):233-246.
[14] Tuncel M, Halici M, Canoz O, et al. Role of insulin like growth factor-I in repair response in immature cartilage[J]. Knee, 2005,12(2):113-119.
[15] Blunk T, Sieminski AL, Gooch KJ, et al. Differential effects of growth factors on tissue-engineered cartilage[J]. Tissue Eng, 2002,8(1):73-84.
[16] 任莎莎, 李雪萍, 林强, 等. 低强度脉冲超声经 PI3K/Akt 通路调控兔膝骨性关节炎软骨细胞凋亡的作用机制研究[J]. 中国康复, 2015,30(2):83-87.
[17] Cailotto F, Bianchi A, Sebillaud S, et al. Inorganic pyrophosphate generation by transforming growth factor-beta-1 is mainly dependent on ANK induction by Ras/Raf-1/extracellular signal-regulated kinase pathways in chondrocytes[J]. Arthritis Res Ther, 2007,9(6):122-129.
[18] Li Y, Fan Q, Jiang Y, et al. Effects of insulin-like growth factor 1 and basic fibroblast growth factor on the morphology and proliferation of chondrocytes embedded in Matrigel in a microfluidic platform[J]. Exp Ther Med, 2017,14(3):2657-2663.
[19] Ikeda Y, Sakaue M, Chijimatsu R. IGF-1 Gene Transfer to Human Synovial MSCs Promotes Their Chondrogenic Differentiation Potential without Induction of the Hypertrophic Phenotype[J]. 2017,20(7)::58041-58047.
[20] Glintborg D, Stoving RK, Hagen C, et al. Pioglitazone treatment increases spontaneous growth hormone (GH) secretion and stimulated GH levels in polycystic ovary syndrome[J]. J Clin Endocrinol Metab, 2005,90(10):5605-5612.
[21] Naruse K, Mikuni-Takagaki Y, Azuma Y, et al. Anabolic response of mouse bone-marrow-derived stromal cell clone ST2 cells to low-intensity pulsed ultrasound[J]. Biochem Biophys Res Commun, 2000,268(1):216-220.
[22] Tang Y, Leng Q, Xiang X, et al. Use of ultrasound-targeted microbubble destruction to transfect IGF-1 cDNA to enhance the regeneration of rat wounded Achilles tendon in vivo[J]. Gene Ther, 2015,22(8):610-618.
[23] Koch B, Baum W, Burmester GR, et al. [Prostaglandin E2, interleukin 1 and gamma interferon production of mononuclear cells of patients with inflammatory and degenerative joint diseases][J]. Z Rheumatol, 1989,48(4):194-199.
[24] 王涛, 苏静, 陈文直, 等. 聚焦超声单次治疗慢性软组织损伤兔局部肌组织前列腺素E2、pH值以及血浆β-内啡肽的变化[J]. 中国组织工程研究与临床康复, 2008,12(13):2451-2454.
[25] Kokubu T, Matsui N, Fujioka H, et al. Low intensity pulsed ultrasound exposure increases prostaglandin E2 production via the induction of cyclooxygenase-2 mRNA in mouse osteoblasts[J]. Biochem Biophys Res Commun, 1999,256(2):284-287.
[26] Chen YJ, Chan DC, Lan KC, et al. PPARgamma is involved in the hyperglycemia-induced inflammatory responses and collagen degradation in human chondrocytes and diabetic mouse cartilages[J]. J Orthop Res, 2015,33(3):373-381.
[27] Carames B, Taniguchi N, Otsuki S, et al. Autophagy is a protective mechanism in normal cartilage, and its aging-related loss is linked with cell death and osteoarthritis[J]. Arthritis Rheum, 2010,62(3):791-801.
[28] 王浩, 曹飞, 斯海波, 等. 雷帕霉素调控自噬在骨关节炎软骨细胞退变中的机制研究[J]. 中华骨与关节外科杂志, 2017,10(3):248-253.
[29] 王和峰, 翟纯刚, 庞文会, 等. PI3K/Akt/mTOR信号通路在巨噬细胞自噬及动脉粥样硬化斑块不稳定中的作用[J]. 中国病理生理杂志, 2013,29(3):390-397.
[30] Zheng L, Li Y, Li X, et al. Combination of Hydroxyl Acetylated Curcumin and Ultrasound Induces Macrophage Autophagy with Anti-Apoptotic and Anti-Lipid Aggregation Effects[J]. Cell Physiol Biochem, 2016,39(5):1746-1760.
[31] Ouyang J, Jiang H, Fang H, et al. Isoimperatorin ameliorates osteoarthritis by downregulating the mammalian target of rapamycin C1 signaling pathway[J]. Mol Med Rep, 2017,16(6):9636-9644.

