绿绒蒿属藏药植物ndhF和rbcL序列片段特征分析
(西南林业大学 园林植物与观赏园艺省高校重点实验室 园林学院,云南 昆明 650224)
绿绒蒿属Meconopsis Vig.是著名的观赏植物,共49种,1种产于西欧,其他产于亚洲温带的中南部,以喜马拉雅及我国西南部为分布中心,东达湖北西部。我国约有38种,西藏产约27种[1-3]。在我国藏族集居地区,自古以来就有记载绿绒蒿属部分种类可以入药,如公元八世纪的《月王药诊》[4],以及后世的《四部医典》[5]、《晶珠本草》[6]等[7]。本属植物的分布范围局限、生境狭窄,且在西藏不同地区作为藏药使用的种仅靠花色区分,存在同名异物的问题,易于混淆。藏药“欧贝”有清热解毒、利尿消炎、止痛的功效[8]。而在藏医学中又认为不同花色的绿绒蒿具有不同的治疗功效,因此在“欧贝”下又分了蓝色花的“欧贝完保”(五脉绿绒蒿M.quintuplinervia、毛瓣绿绒蒿M.torquata、长叶绿绒蒿M.lancifolia)、红色花的“欧贝玛保”(红花绿绒蒿M.punicea)和黄色花的“欧贝赛保”(全缘叶绿绒蒿M.integrifolia),但是在花干以后很难辨别起品种。局部地区也将滇西绿绒蒿作“欧贝完保”使用,将尼泊尔绿绒蒿、锥花绿绒蒿作“欧贝赛保”的替代品使用[3]。藏药“刺儿恩”有更统一的来源认知(总状绿绒蒿M.racemosa和多刺绿绒蒿M.horridula)有活血化瘀和止痛的功效[9]。
由于藏药来源渠道的多样性以及传统分类学鉴别方法的局限性,需要更准确的鉴别方法来对药材进行鉴别。随着分子生物技术的快速发展,DNA条形码被大量应用于不同物种。DNA条形码是指生物体内能够代表该物种的、标准的、有足够变异的、易扩增且相对短的DNA片段,当前获得普遍接受的是叶绿体的rbcL(ribulose-15-bisphosphate carboxylase/oxygenase large)、trnL-F、matK(maturase K)、ndhF(NADH dehydrogenase)和psbA-trnH序列,以及核基因的ITS(internal transcribed spacer)序列[10-13]。已有学者应用叶绿体psbA-trnH序列结合核基因ITS进行绿绒蒿属藏药植物的鉴别[13]。DNA条形码因其能准确、快速的鉴别物种,被大量应用于药材的鉴别,对解决长久以来的植物辨识错误具有明显的优势。rbcL和ndhF序列的PCR扩增产物长度适宜,比对容易,而且表现出较高水平的遗传变异。但至目前为止,还没有学者利用叶绿体ndhF片段结合rbcL片段进行绿绒蒿属藏药植物的鉴别。
本实验采集了“欧贝”和“刺儿恩”不同种的基原植物材料,通过ndhF和rbcL序列扩增测序并分析差异,以期为藏药植物的分子鉴别方法提供基础资料。
1 材料与方法
1.1 材 料
本实验所需材料为哈佛大学标本馆采集的标本和野外采集的野生植物样本,材料来源如表1所示。

表1 样品来源与标本凭证Table 1 Sample sources and voucher specimens
1.2 方 法
取样品材料放入1.5 mL离心管中,加液氮冷冻样本,用手持匀浆机快速研磨至样品成粉末状,然后用Omega试剂盒进行总DNA的提取,1%琼脂糖凝胶电泳检测DNA提取结果,并用分光光度计测DNA的浓度和纯度。rbcL序列的引物参考五脉绿绒蒿M.quintuplinervia FJ626613.1和虞美人(apaver rhoeas L.DQ912900.1;ndhF序列的引物参考五脉绿绒蒿M.quintuplinervia JX087831.1和砖红罂粟JX087813 Papaver lateritium JX087813。所用PCR反应试剂为上海近岸科技有限公司所生产的2×Power Taq PCR MasterMix,总反应体系为50 uL:2×MasterMix 25 uL;DNA模板1 uL;上游引物2 uL;下游引物2 uL;ddH2O 20 uL。PCR 条件为 98 ℃ 2 min,98 ℃ 10 s,56 ℃ 10 s,72 ℃10 s,72 ℃5 min,4 ℃终止保存,1%琼脂糖凝胶电泳检测扩增结果。扩增产物送昆明硕擎生物技术有限公司进行纯化并测序。
1.3 数据分析
rbcL序列的边界根据GenBank 中的近缘种五脉绿绒蒿FJ626613.1和虞美人DQ912900.1的序列来确定;ndhF序列的边界根据GenBank 中的近缘种五脉绿绒蒿JX087831.1和砖红罂粟JX087813的序列来确定。用DNAstar中的EditSeq软件进行序列编辑,所得DNA序列经ClustalX进行多重对比排列,对测序议误读和漏读的个别碱基进行人工校对,调整减少排列所需的gap的数目。将数据导入MEGA6.0软件进行统计和聚类分析,计算各序列间的Kimura2遗传距离,以遗传距离距阵为基础构建分子系统树并且计算转换/颠换率。
2 结果与分析
2.1 六种绿绒蒿序列长度与GC含量分析
2.1.1 rbcL序列长度与GC含量分析
绿绒蒿rbcL序列长度与GC含量,如表2所示。

表2 8个分类群rbcL序列长度和GC含量Table 2 8 taxa of rbcL sequence length and GC content
2.1.2 ndhF序列长度与GC含量分析
绿绒蒿ndhF序列长度与GC含量,如表3所示。

表3 4个分类群ndhF序列长度和GC含量Table 3 4 taxa of ndhF sequence length and GC content
2.2 遗传距离
rbcL序列和ndhF序列成对比较时不同分类群间存在能明显区分各分类群的变异位点,差异位点如表4和表5上三角区所示。
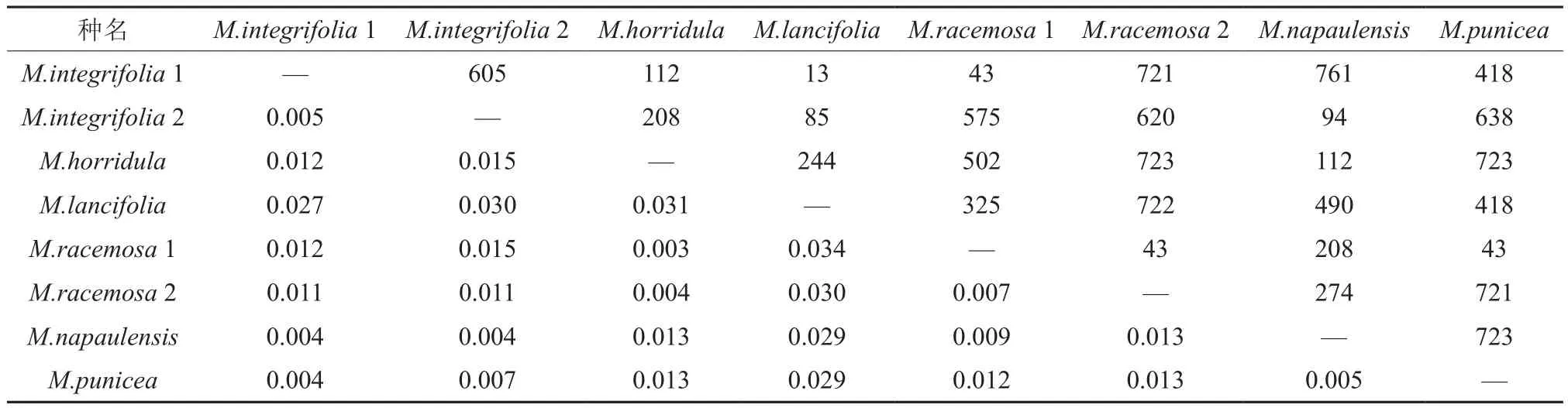
表4 8个分类群rbcL序列成对比较时的遗传距离(上三角:变异位点;下三角:遗传距离)Table 4 8 taxa rbcL genetic distance (the upper triangle: mutation; triangle: genetic distance)

表5 7个分类群ndhF序列成对比较时的遗传距离(上三角:变异位点;下三角:遗传距离)†Table 5 7 taxa ndhF genetic distance (the upper triangle: mutation; triangle: genetic distance)
2.3 变异位点分析
2.3.1 rbcL序列变异位点分析
8个分类群和2个外类群rbcL序列末端截齐后总长度为761 bp,成对比较后共有个729保守位点,保守位点占总位点的95.79%;除去外类群有31个变异位点(表6所示)。任意两组比较,均有位点变异情况。其中全缘叶绿绒蒿两个居群间存在5个不相同的变异位点,总状绿绒蒿两个居群间存在5个不相同的变异位点。
2.3.2 ndhF序列变异位点分析
7个分类群和2个外类群ndhF序列末端截齐后总长度为949 bp,成对比较后共有918个保守位点,保守位点占总位点的96.73%;除两个外类群外共有31个变异位点,6个缺失位点。除多刺绿绒蒿与总状绿绒蒿(居群2)无差异外,任意两组比较,均有位点变异情况。
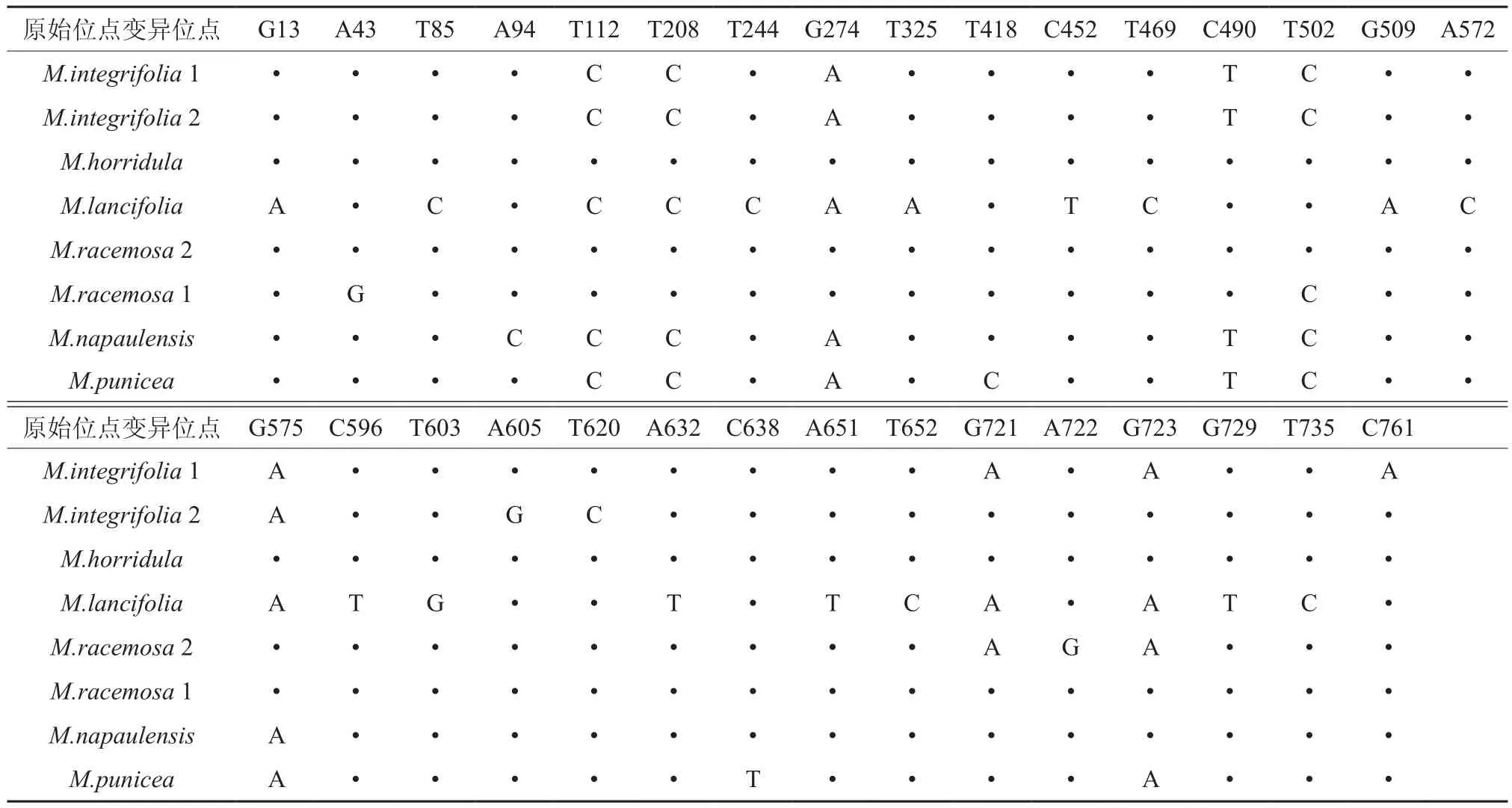
表6 8个分类群rbcL序列成对比较时的变异位点值†Table 6 8 taxa rbcL sequence mutation
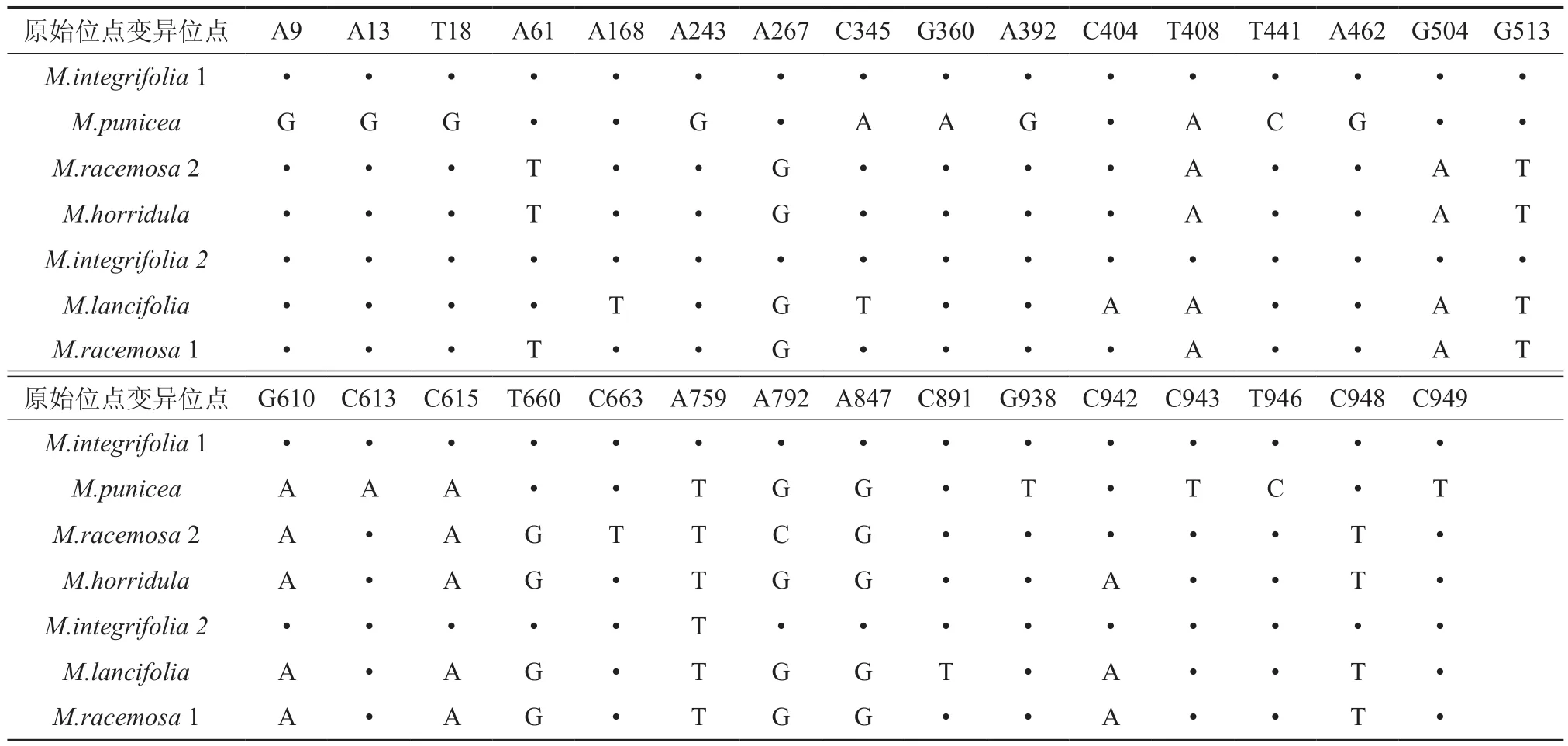
表7 7个分类群ndhF序列成对比较时的变异位点值Table 7 7 taxa ndhF sequence mutation
2.4 系统发育树的构建
rbcL聚类树如图1所示,外类群罂粟属植物虞美人首先分离为一枝,表现出与绿绒蒿属有较远的亲缘关系;总状绿绒蒿居群2与多刺绿绒蒿聚为一枝,与总状绿绒蒿居群1聚类;红花绿绒蒿与长叶绿绒蒿分别单独为一枝;尼泊尔绿绒蒿与五脉绿绒蒿聚为一枝,与全缘叶绿绒蒿居群1和居群2聚类,表现出了更近的亲缘关系。
如图2所示,外类群罂粟属植物砖红罂粟首先分离为一枝,表现出与绿绒蒿属有较远的亲缘关系;多刺绿绒蒿与总状绿绒蒿(居群1)聚为一枝,与总状绿绒蒿(居群2)和长叶绿绒蒿聚为一类;红花绿绒蒿与五脉绿绒蒿聚为一枝;全缘叶绿绒蒿居群1与全缘叶绿绒蒿居群2聚为一枝;五脉绿绒蒿、红花绿绒蒿和全缘叶绿绒蒿之间表现出了更近的亲缘关系。
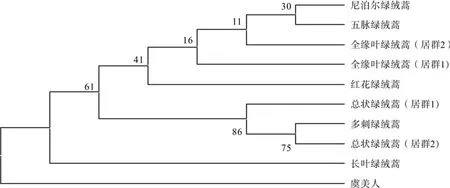
图1 基于rbcL序列的系统发育树(邻聚法)Fig.1 The phylogenetic tree of rbcL gene (Neighber-joining)
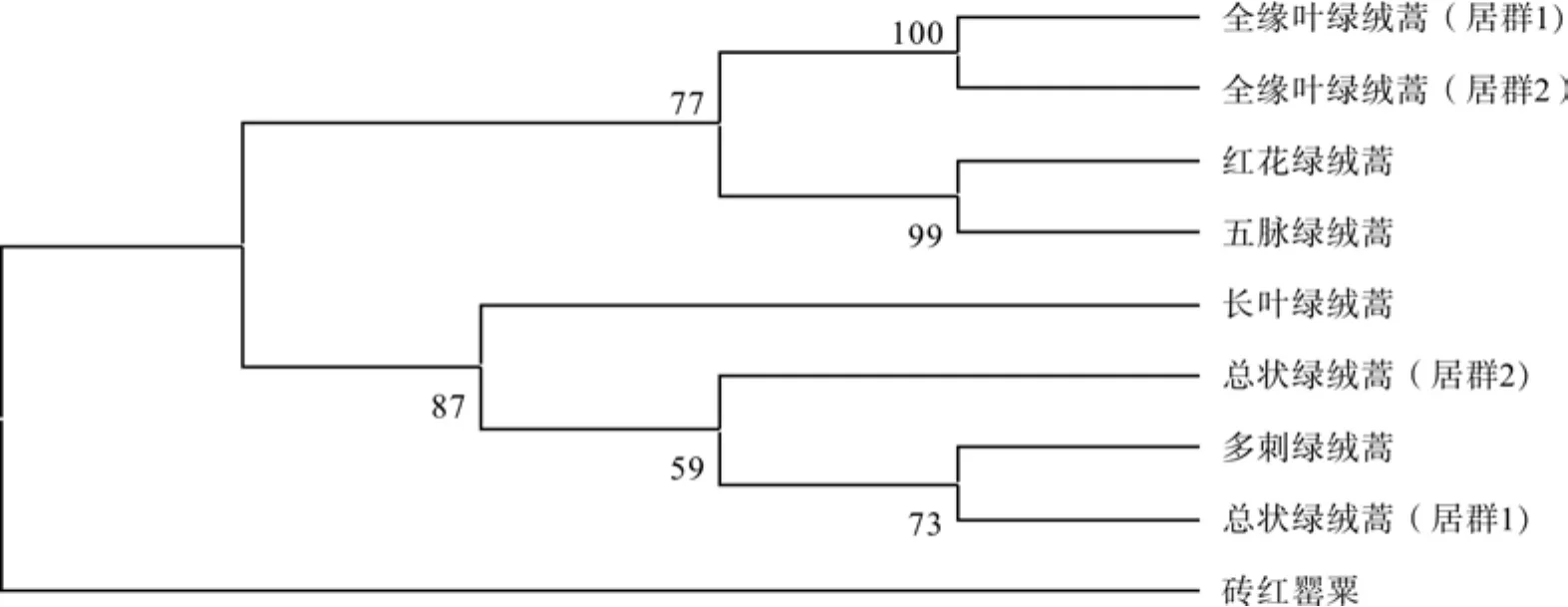
图2 基于ndhF序列的系统发育树(邻聚法)Fig.2 The phylogenetic tree of ndhF gene (Neighber-joining)
3 结论与讨论
本次实验的主要目的是通过比对6种藏药绿绒蒿基源植物的rbcL和ndhF序列的特征和差异,为准确的进行绿绒蒿属常见药材鉴别提供依据。为了获得更加准确可靠的实验结果,从GenBank下载了五脉绿绒蒿、虞美人与砖红罂粟三个近缘物种的rbcL和ndhF序列与之共同进行比对分析。实验结果表明,同种植物不同居群之间GC含量和遗传距离存在一定差异;在对任意两组序列进行变异位点比较时,均能通过位点变异的情况进行区分;系统发育树的构建可以更直观的看出藏药欧贝和刺儿恩之间亲缘关系的远近,欧贝完保、欧贝赛保、欧贝玛保分别聚为一枝,可以通过聚类分析进行区分。运用rbcL序列构建的系统发育树中尼泊尔绿绒蒿与藏药“欧贝”有比较近的亲缘关系,运用rbcL序列构建的系统发育树中尼泊尔绿绒蒿单独聚为一枝,与藏药“欧贝”、“刺儿恩”有较明显的差异。
倪梁红等学者[10]在利用核基因序列ITS和叶绿体片段psbA-trnH进行绿绒蒿属藏药鉴别时发现,ITS分析显示多刺绿绒蒿和总状绿绒蒿的序列一致,结合叶绿体片段psbA-trnH可将两者有效区分。有学者基于ITS序列的分析[14],建议多刺绿绒蒿应与总状绿绒蒿合并为一个种,或结合形态学差异,将其中一个处理为另一个的变种。本实验中的总状绿绒蒿居群1与居群2和多刺绿绒蒿rbcL序列有不同的变异位点,由于样品采集生境的不同,不确定是否是环境影响导致出现变异位点;ndhF序列中总状绿绒蒿居群1与多刺绿绒蒿无明显差异,这一结果将对两者的分类地位提供有价值的参考。
从同一药材的不同产地来看,总状绿绒蒿居群1采自青海省,总状绿绒蒿居群2采自云南省,其不同居群间仍然存在位点变异。全缘叶绿绒蒿不同居群之间也存在位点差异,这些差异可能是因为生态环境、标本采集年份等造成的影响。因此,这还需要进一步进行居群的采样和药材产地的生态环境的分析。
本实验选用的rbcL序列是稳定性较好的常用DNA条形码,而ndhF基因比其他叶绿体编码基因的碱基替代速率高、进化速率快。但由于绿绒蒿属杂交频繁,染色体多倍化现象较为普遍,因此后续研究应进行叶绿体DNA片段的有效筛选,再适当增加用于分析的叶绿体片段数目,采用多片段联合分析的方法将更有利于绿绒蒿属鉴别。同时,应该注意的是,叶绿体采用单亲遗传,且相对保守,可用于系统发育重建的信息有限。近年来通过转录组测序,获得具有单拷贝或低拷贝的直系同源的核基因已被广泛用于科及科以下的亲缘关系分析,如有学者从17种十字花科植物中得到了5个编码蛋白的单核拷贝基因序列,重建了它们之产的亲缘关系,结果表明,这些基因能提供更多的信息位点[15]。因此,后续研究可以通过获得核基因,结合叶绿体片段联合分析,将更加全面深入地为绿绒蒿属的分类及系统发育提供借鉴。
根据文献记载,在西藏部分地区,尼泊尔绿绒蒿作为“欧贝赛保”全缘叶绿绒蒿的代替品使用,具有清热止咳的疗效。rbcL序列聚类分析结果显示尼泊尔绿绒蒿与五脉绿绒蒿聚为一枝,藏药“欧贝”一般按照花色进行分类使用,尼泊尔绿绒蒿花为蓝色,作为“欧贝赛保”使用还是作为“欧贝完保”使用更为合适还需进行下一步实验的验证。现今藏药基源植物与典籍记载的传统来源有不少出入,品种较多、来源较复杂直接降低了藏药鉴别的准确性,利用多片段相结合,如核基因序列ITS与叶绿体基因序列(rbcL、matK、trnL-F、psbL-psbK、psbA-trnH等)相结合[16-18],可以更为快速准确的对物种进行鉴别,对未来种间和种内的遗传变异和遗传多样性研究[19-21]提供科学准确的物种信息有着重要意义,对绿绒蒿属藏药植物的合理开发利用提供科学依据。
[1]中国科学院中国植物志编辑委员会.中国植物志(32卷)[M].北京:科学出版社,1999.
[2]吴征镒,等.西藏植物志[M].北京:科学出版社,1985(2):227.
[3]中国科学院昆明植物研究所.云南植物志(第二卷)[M].北京:科学出版社,1979.
[4]马世林著,毛继祖译.月王药诊[M].上海:上海科学技术出版社,2012.
[5]宇妥·元丹贡布著,李永年译.四部医典[M].北京:人民卫生出版社,1983.
[6]帝玛尔·丹增彭措.晶珠本草[M].毛继祖,罗达尚译.上海:上海科学技术版社,1986.
[7]WANG B, SONG X H, CHEN C M, et al.Studies on species of Meconopsis as Tibetan medicines[J].Chinese Wild Plant Resources, 2003,22(4):43-46.
[8]王 彬,宋学华,濮社班.藏药“欧贝”和“刺儿恩”的性状鉴定研究[J].江苏药学与临床研究2003,11(3):23-25.
[9]Chen S L,Yao H, Song J Y, et al.Identif i cation of Chinese herbal medicines based on technology of DNA barcoding[J].World Science and Technology/ Modernization of Chinese Medicine and Materia Medica, 2007,9(3):7-12.
[10]NI L H, ZHAO Z L, MENG Q W, et al.ITS and psbA-trnH sequence identif i cation of Meconopsis as Tibetan medicines[J].Chinese Traditional and Herbal Drugs, 2014,45(4):541-545.
[11]YU J, XUE J H, ZHOU S L.New universal matK primers for DNA barcoding angiosperms[J].Journal of Systematics and Evolution, 2011,49(3):176-181.
[12]WANG Y J, LIU J Q.A preliminary investigation on the phylogeny of Saussurea (Asteraceae: Cardueae) based on chloroplast DNA trnL-F sequences[J].Journal of Systematics and Evolution, 2004,42(2):136-153.
[13]JI S G, HUO K K, WANG J, et al.A molecular phylogenetic study of Huperziaceae based on chloroplast rbcL and psbA-trnH sequences[J].Journal of Systematics and Evolution, 2008, 46(2): 213-219.
[14]谢庶洁,杨加伟,许文雅,等.用ITS基因探讨多刺绿绒蒿与总状绿绒蒿的分类地位[A].中国植物逆境生理生态与分子生物学学术研讨会[C],2006.
[15]DING M, ZENG L P, MA H, et al.The Use of Low-copy Nuclear Genes for Reconstructing the Phylogeny of Low-level Taxonomic Hierarchies:Evidence from Brassicaceae[J].Plant Diversity and Resources,2012,34(3):211-221.
[16]GOU C Y, ZHANG S S, GENG S L.Phylogenetic Position and Genetic Relationship of Osmunda mildei (Osmundaceae):Evidence from rbcL Gene and trnL-trnF Region.[J].Acta Botanica Boreali-Occidentalia Sinica,2008,28(11):2178 -2183.
[17]LI X Q, MA J, LI M, et al.Taxonomic Status of Fauriella Besch.Inferred from ITS, trnL-F and rps4 Gene Regions.[J].Acta Botanica Boreali-Occidentalia Sinica,2014,34(1):0072-0076.
[18]LAI S P,SHEN C J,ZHOU S D , et al.Phylogeny and Interspecif i c Relationship of Lilium Section Leucoliron Based on Three Gene Sequences[J].Acta Botanica Boreali-Occidentalia Sinica, 2016,36(8):1541-1550.
[19]FU J M, SUO Y J,LIU H M, et al.Analysis on codon usage in the chloroplast protein-coding genes of Diospyros spp.[J].Nonwood Forest Research, 2017,35(2):38-44.
[20]LIANG G X, LIU K, MA J L, et al.Molecular taxonomy and identifcation of Camellia osmantha[J].Nonwood Forest Research, 2017,35(1):26-29.
[21]FU J M, SUO Y J, ZHANG J J, et al.Exploitation of cpDNA molecular markers and genetic variation of Diospyros spp.[J].Journal of Central South University of Forestry & Technology,2017, 6(6):1-6.

