读取·抽取·调取·获取·思取——例谈五步解题法在解题中的应用
山东
胡海昊 张传迎
对于一些以信息给予形式给出的工艺流程题或者综合性的实验题,一直是学生学习化学的一个难点,也是教学的一个难点。由于这些试题信息量比较大,综合性比较强,也是学生考试中频频失分之所在。下面笔者结合几个例题谈谈五步解题法在解这些试题中的应用,通过读取题干、抽取信息、调取储备、获取答案和思取收获这五个步骤予以突破这类试题,供同仁们参考。
类型一、五步解题法在工艺流程题中的应用
【例1】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。(已知氧化性:Co2O3>Cl2)。从废料中回收氧化钴(CoO)的工艺流程如下:
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为_________________________________________。
(2)过程Ⅱ中加入稀硫酸酸化后,再加入Na2S2O3溶液浸出钴,则浸出含钴物质的反应化学方程式为(产物中只有一种酸根)________________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因:___________________________________________________。
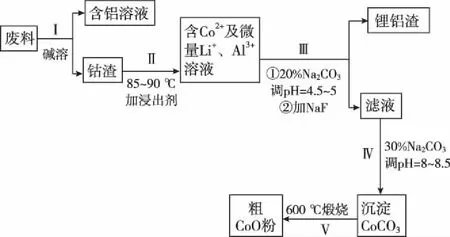
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式:_____________________________________________。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用:_________________________________。
【五步解读】

读取题干审读流程知原材料和产物抽取信息①Co2O3的氧化性>Cl2的氧化性;②加入试剂作用;③“主线”反应和“辅线”反应调取储备①物质分离提纯方法;②沉淀剂的选择方法;③调节pH方法获取答案【解读】本题属于工业生产与实际相关联试题,属于分离提纯流程题。其思维模板:①看准工艺流程中的反应,主体物质是谁?②投料的物质有哪些?本质上有何变化?③判断未反应和生成的物质是什么?④通过电子守恒、原子守恒进行配平。(1)Al是“两性”金属,与NaOH溶液反应,反应的离子方程式为2Al+2OH-+2H2O2AlO-2+3H2↑。(2)废料中Co元素化合价为+3价和+2价,经过过程Ⅱ后溶液只含有Co2+,则可知Co3+氧化S2O2-3,还原产物为Co2+,由产物中只有一种酸根可知氧化产物只有SO2-4。(3)Al3+与CO2-3可以发生双水解生成Al(OH)3沉淀。(4)由过程Ⅳ中提示加入Na2CO3后调节pH及产生CoCO3沉淀可获得其在该过程中的作用。【答案】(1)2Al+2OH-+2H2O2AlO-2+3H2↑(2)4Co2O3·CoO+Na2S2O3+11H2SO412CoSO4+Na2SO4+11H2O Co2O3·CoO可氧化盐酸生成Cl2,污染环境(3)2Al3++3CO2-3+3H2O2Al(OH)3↓+3CO2↑(4)调节pH,提供CO2-3,使Co2+沉淀为CoCO3思取收获高考往往以化工生产流程图为载体,考查物质的化学性质、分离提纯、反应原理、实验操作、产率计算等知识点。此类题目与工业生产息息相关,做题时应先对题目中的流程图进行分析,大体确定各个步骤的作用,从而提取解答题目的有用信息,然后看清问题,准确规范解答
【归因导学】
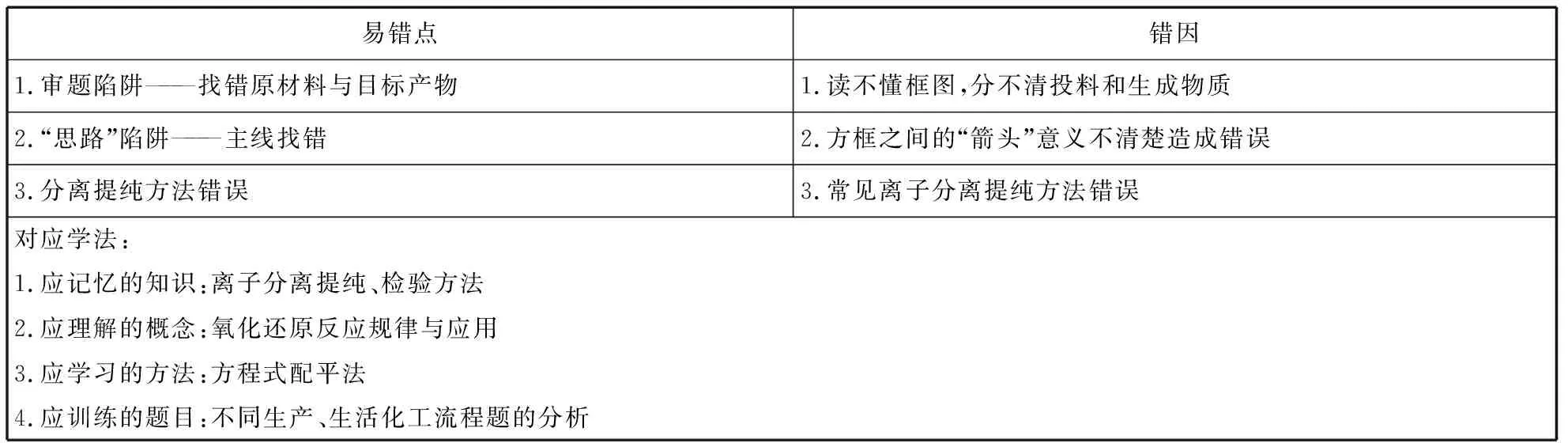
易错点错因1.审题陷阱———找错原材料与目标产物1.读不懂框图,分不清投料和生成物质2.“思路”陷阱———主线找错2.方框之间的“箭头”意义不清楚造成错误3.分离提纯方法错误3.常见离子分离提纯方法错误对应学法:1.应记忆的知识:离子分离提纯、检验方法2.应理解的概念:氧化还原反应规律与应用3.应学习的方法:方程式配平法4.应训练的题目:不同生产、生活化工流程题的分析
【满分导考】

此类试题的常考题型、分值、难度、考频失分陷阱化工与生产实际结合的流程题是高考试卷中的常考题型,考查频率极高,难度较大。该知识点的常考题型为“陌生流程、陌生情景”,结合实际,体现化学实用性,分值为15分,如2017年全国卷Ⅰ第27题1.新信息读不懂,不知道元素守恒思想是工艺流程图的“主线”;2.不能把教材知识与实际生产相结合造成知识互不衔接无法作答;3.不考虑绿色环保,在流程上选错试剂,造成环境污染
【得分要点满分秘诀】
制备类工艺流程题一般由多步连续的操作组成,每一步操作都有其具体的目标、任务。审题的重点要放在与题设有关操作的目标、任务上,分析时要从成本角度(原料是否廉价易得)、环保角度(是否符合绿色化学的要求)、现实角度等方面考虑;解答时要同时兼顾框内框外,里外结合;边分析,边思考,易处着手;先局部,后全盘,逐步深入。而且还要看清问题,不能答非所问。要求用理论回答的试题应采用“四段论法”:本题改变了什么条件(或是什么条件)→根据什么理论→所以有什么变化→结论。
类型二、五步解题法在综合实验题中的应用
【例2】(2017·全国卷Ⅱ,28题)水中溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
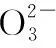
回答下列问题:
(1)取水样时应尽量避免搅动水体表面,这样操作的主要目的是________________________________。
(2)“氧的固定”中发生反应的化学方程式为____________________________________。
(3)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除________及二氧化碳。
(4)取100.00 mL水样经固氧、酸化后,用amol·L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为____________________________________;若消耗Na2S2O3溶液的体积为bmL,则水样中溶解氧的含量为________ mg·L-1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏________(填“高”或“低”)。
【五步导解】

读取题干审读题意知目的和信息反应抽取信息①溶解氧测定原理;②滴定步骤;③关系式寻找;④误差判断调取储备①溶液的配制方法;②氧化还原滴定实验终点判断方法;③电子守恒和关系式的计算策略获取答案【解读】本题属于化学与环境试题,采用碘量法测定水中溶解氧的含量,从属于氧化还原滴定。其思维模板:具体化学反应→化合价怎么变化(或是否变化)→寻找(氧化剂、还原剂、氧化产物、还原产物)→根据中和滴定思想迁移至氧化还原反应滴定。(1)取水样时若扰动水体表面,会造成水体杂质进入水样中,或者水体中的氧气因为搅拌溶解度降低而逸出,造成误差。(2)根据氧化还原原理,Mn(OH)2 被氧化为MnO(OH)2,Mn的化合价由+2价→+4价,化合价升高2价,氧气中的O元素化合价由0价→-2价,整体降低4价,根据电子守恒,“氧的固定”中发生反应的化学方程式为O2+2Mn(OH)22MnO(OH)2。 (3)Na2S2O3溶液不稳定,使用前还需标定,因此配制该溶液时不需要精确配制,需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和量筒,并不需要容量瓶;Na2S2O3溶液不稳定,加热可以除去蒸馏水中溶解的氧气和二氧化碳,减少Na2S2O3的损失。

续表
【归因导学】
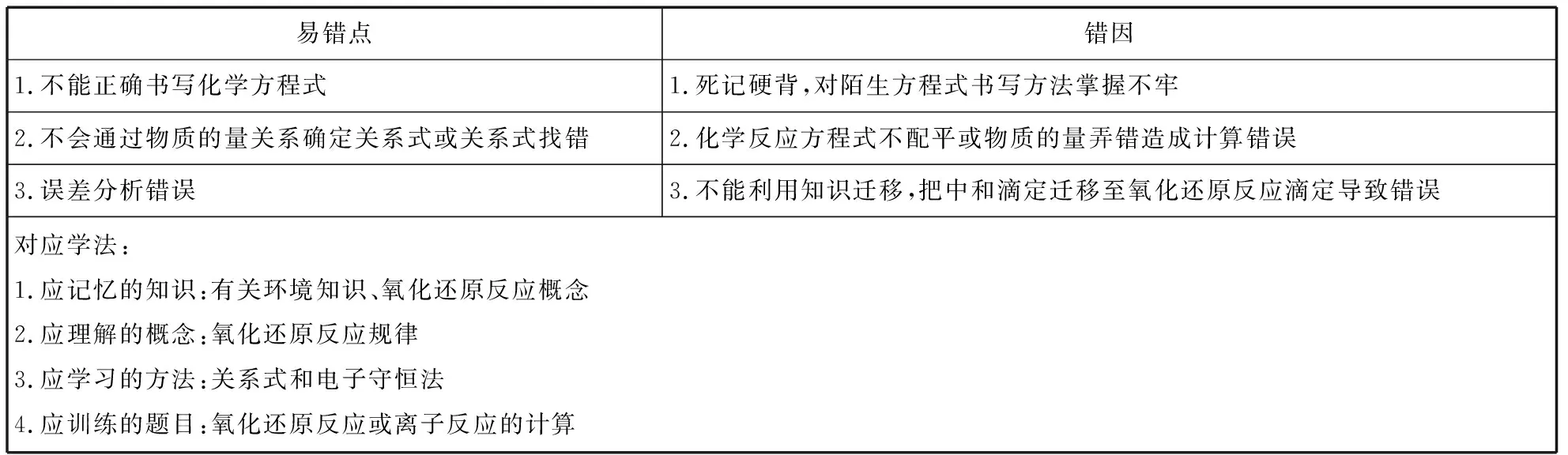
易错点错因1.不能正确书写化学方程式1.死记硬背,对陌生方程式书写方法掌握不牢2.不会通过物质的量关系确定关系式或关系式找错2.化学反应方程式不配平或物质的量弄错造成计算错误3.误差分析错误3.不能利用知识迁移,把中和滴定迁移至氧化还原反应滴定导致错误对应学法:1.应记忆的知识:有关环境知识、氧化还原反应概念2.应理解的概念:氧化还原反应规律3.应学习的方法:关系式和电子守恒法4.应训练的题目:氧化还原反应或离子反应的计算
【满分导考】

此类试题的常考题型、分值、难度、考频失分陷阱生产实际与氧化还原反应结合是高考试卷中的常考题型,考查频率极高,难度较大。该知识点的常考题型为“陌生情境、陌生反应”,结合实际,体现化学的实用性,分值为15分,如2017年全国卷Ⅱ理综第28题、2017年江苏卷第19题等1.审题失误。新信息读不懂,不能与相应化学知识衔接;2.不会“庖丁解牛”,各个击破。对于复杂新颖的试题,采用“切块法”,把互不关联的小题分别解答;3.知识、方法匮乏。如陌生氧化还原反应书写、配平方法掌握不牢固等
【得分要点满分秘诀】
解答生产实际与氧化还原反应综合类试题时,首先分析题目中的信息,与相应化学知识接轨,确定氧化剂、还原剂及氧化产物、还原产物。必要时,还要写出并配平氧化还原反应的方程式(化合价升降法),这样有利于计算电子转移数目、判断物质的氧化性或还原性等,然后根据题目要求,确定答案。解答有关氧化还原反应试题的步骤如下:



