藤梨根皮部与木部的显微鉴定及其多糖中单糖的构成分析
王亚琼,张华锋,汪映宇,钟水生,周 坚
(苏州市药品检验检测研究中心,苏州 215104)
历代本草记载藤梨根为猕猴桃科(Actinidiaceae)植物中华猕猴桃ActinidiachinensisPlanch.的干燥根,秋季采挖,切片,晒干[1-3]。市场上藤梨根的商品药材多以木部为主,且目前尚无典型的化学成分可作为液相或气相的质量控制依据。近年来,有关天然药物中多糖的药物活性及其作用机制研究成为研究热点[4-5]。多糖是藤梨根中的重要抗肿瘤成分,对其提取、分离及药理药效的研究也逐渐受到研究者们的重视[6-8]。将现有不同的分析技术用于糖的分离和测定,包括化学分析、比色分析、纸色谱、TLC法和HPLC法等[9-20]。考虑用HPLC法测定糖的定性和定量分析具有快速、灵敏、样品处理简单等优点,本实验先采用显微鉴别法区别藤梨根原根的不同部位,再用柱前衍生HPLC法分析藤梨根不同部位多糖水解产物中的单糖组分,为藤梨根药用部位的正确使用提供参考。
1 仪器与试药
1.1仪器 DFY-300粉碎机(温岭市林大机械有限公司);标准药筛(辽宁省辽阳金属制品厂);XMTD-204电热恒温水浴锅(上海跃进医疗器械有限公司);Agilent 1260 高效液相色谱仪,配VWD检测器,ZORBAX SB-C18(250 mm×4.6 mm,5 μm)色谱柱,美国安捷伦公司;Sorvall ST 8 台式离心机(美国Thermo公司);AG245电子天平(瑞士梅特勒-托利多仪器有限公司);FD240烘箱(德国Binder公司);CM1860冰冻切片机,DM2000显微镜(德国徕卡公司)。
1.2试药 3批藤梨根原药材分别采自安徽大别山、福建宁德和南京六合,其余3批药材饮片购自药材市场,均由苏州市药品检验检测研究中心吴银生主任中药师鉴定为中华猕猴桃ActinidiachinensisPlanch.的干燥根;D-无水葡萄糖(批号110833-201205)、盐酸氨基葡萄糖(批号140649-201304)和甘露糖(批号140651-201403),均购自中国食品药品检定研究院;阿拉伯糖、半乳糖及岩藻糖(Sigma-Aldrich公司);无水乙醇、1-苯基-3-甲基-5-吡唑啉酮(PMP)和氢氧化钠均为分析纯,购自国药集团化学试剂有限公司;三氟乙酸(TFA,美国天地有限公司);超纯水(美国Millpore公司)。
2 藤梨根原根横切面显微鉴别
取原根泡水软化后,冰冻切片机切片,水合氯醛透化后,置于显微镜下观察可见:木栓层细胞数列至10余列,其间有石细胞分布,单个散在或2~4个切向排列。栓内层狭窄,韧皮部细胞多含红棕色的色素块;黏液细胞含大量草酸钙针晶。形成层不明显。木质部宽广;导管直径较大,多单个散在;射线细胞1~5列,径向延长。见图1。
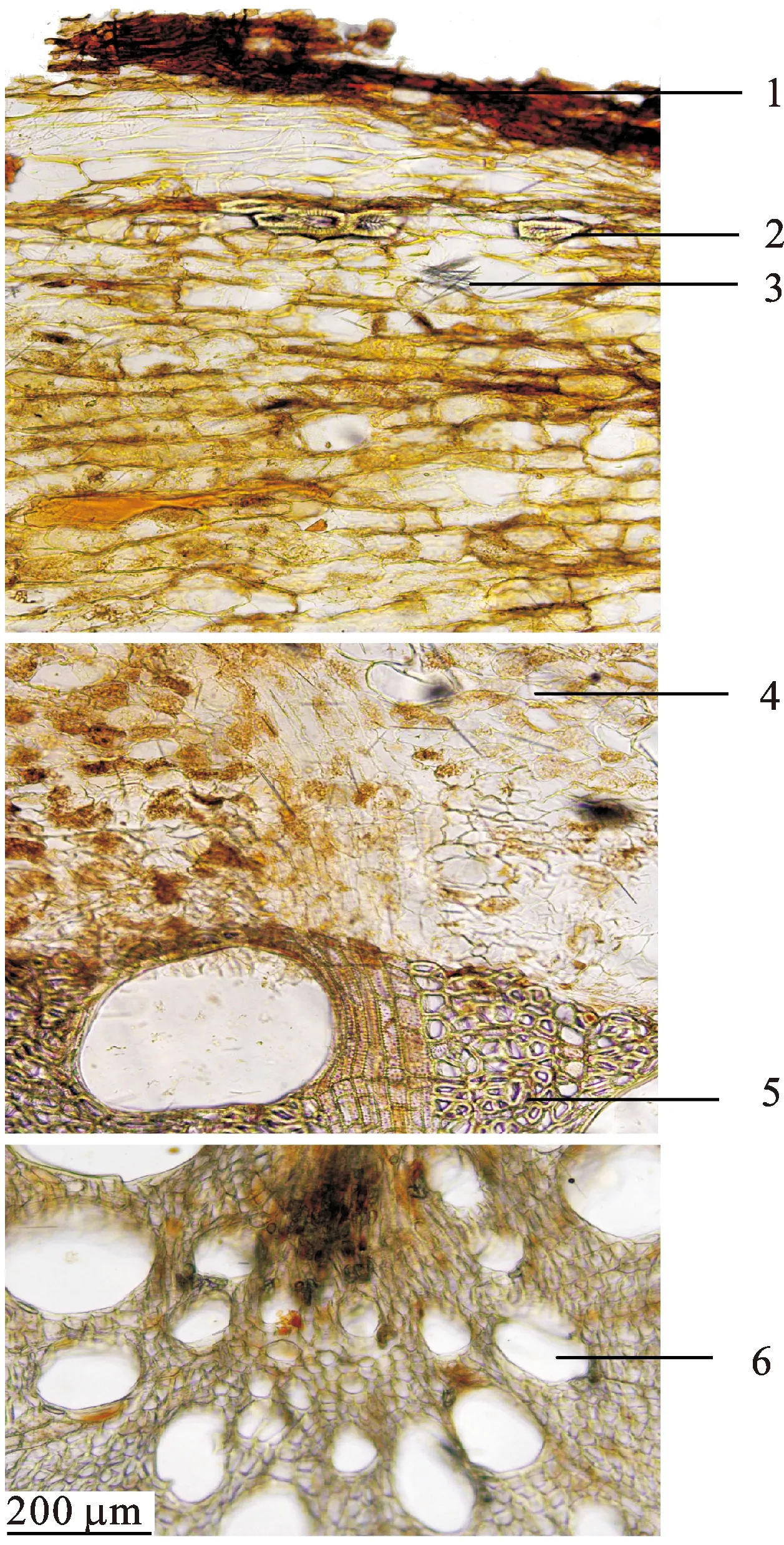
图1藤梨根原根横切面(×100)
)1.木栓层;2.石细胞;3.草酸钙针晶;4.韧皮部;5.木质部;6.导管。
Fig.1 Crude root cross-section of RadixActinidiaechinensis(×100)
)1.cork layer;2.stone cell;3.needle-like calcium oxalate crystals;4.phloem;5.xylem;6.vessel.
3 多糖中单糖的分析
3.1多糖供试品溶液的制备 取供试药材细粉2 g,精密称定,加超纯水60 mL,沸水浴热回流3 h,放冷,以3 500 r·min-1离心5 min,精密量取上清液3 mL,置于15 mL离心管中,精密加入无水乙醇9 mL,摇匀,4 ℃冷藏过夜,取出,以3 000 r·min-1离心5 min,弃上清液,沉淀加1.5 mL水溶解,摇匀,即得。
3.2内标溶液的配制 取盐酸氨基葡萄糖适量,精密称定,加水制成质量浓度为12 mg·mL-1的内标溶液。
3.3衍生化 取多糖供试品溶液1 mL,加入3.2项下制备的内标溶液20 μL,置于顶空瓶中,加TFA,封口,混匀,110 ℃水解,放冷,用氢氧化钠溶液调节pH值至中性,吸取400 μL,加0.5 mo1·L-1的PMP甲醇溶液与0.3 mol·L-1的氢氧化钠溶液各400 μL,混匀,70 ℃水浴反应。再加入0.3 mo1·L-1的盐酸溶液500 μL,混匀,用三氯甲烷洗涤3次,每次2 mL,弃去三氯甲烷液,水层离心为衍生化的样品溶液。
3.4色谱条件 以乙腈-0.02 mol·L-1的乙酸铵溶液(20∶80)为流动相,样品由安捷伦SB-C18色谱柱分离分析;柱温为35 ℃;流速为1 mL·min-1;检测器为紫外检测器;波长为250 nm。将衍生化的样品溶液通过0.22 μm微孔滤膜,取10 μL进样,测定。
3.5实验条件的选择 分别以含量较高的4种单糖(葡萄糖、半乳糖、阿拉伯糖和岩藻糖)的峰面积为指标,测试不同TFA浓度、水解时间及衍生化时间对多糖水解程度的影响。结果显示,随TFA浓度的增加和水解时间的延长,多糖逐步水解,单糖量逐渐增加。根据实验结果确定最终实验条件为:TFA浓度为3 mol·L-1,水解时间和衍生化时间均为1 h。
3.6方法学考察
3.6.1标准曲线 取单糖混合对照品溶液 5 份,加入不同体积的纯水稀释成系列质量浓度梯度溶液,按照3.3项下方法进行衍生化反应,按照3.4项下色谱条件进样,记录各质量浓度下的单糖峰面积,结果显示,单糖质量浓度(x)与单糖峰面积/内标峰面积比值(y)之间线性关系良好,见表1。
表1单糖的标准曲线及线性范围
Tab.1 Standard curves and linear ranges of monosaccharides

单糖标准曲线r线性范围/μg·mL-1甘露糖 y=0.587x-0.0220.999 90.045^45.0葡萄糖 y=0.191x+0.0120.999 70.112^56.0半乳糖y=0.211x-0.0060.999 50.103^51.5阿拉伯糖 y=0.186x-0.0170.999 90.110^55.0岩藻糖y=0.235x+0.0110.999 90.099^49.5
3.6.2精密度实验 将制备的藤梨根供试品溶液进样 5 次,测定各组分的峰面积并分别计算其含量及RSD值。结果显示,各单糖组分含量的RSD值在0.42%~1.5%之间,提示该方法的精密度符合实验要求。
3.6.3加样回收率实验 取已知多糖含量藤梨根供试品,精密称定,置于量瓶中,分别精密加入相当样品含有量的各单糖对照品,按照3.3项下方法进行衍生化反应,依照3.4项下色谱条件测定。结果甘露糖、葡萄糖、半乳糖、阿拉伯糖和岩藻糖的平均回收率分别为93.1%(RSD=1.5%),95.7%(RSD=1.2%),98.6%(RSD=0.9%),98.1%(RSD=1.5%)和93.6%(RSD=0.8%),表明该方法符合实验要求。
3.6.4稳定性实验 将供试品溶液分别在0,2,4和8 h进样,根据各单糖组分的峰面积计算其各组分的RSD值。结果表明,各组分峰面积的RSD值在0.69%~1.8%之间,说明山豆根多糖的供试品溶液在8 h 内保持稳定,满足分析要求。
3.7样品测定与结果分析 将收集的3批商品药材及3批自采原药材分别取皮部及木部,按照3.1项下方法进行制备,按照3.4项下色谱条件进样测定,色谱图见图2,单糖的测定结果见表2和表3。
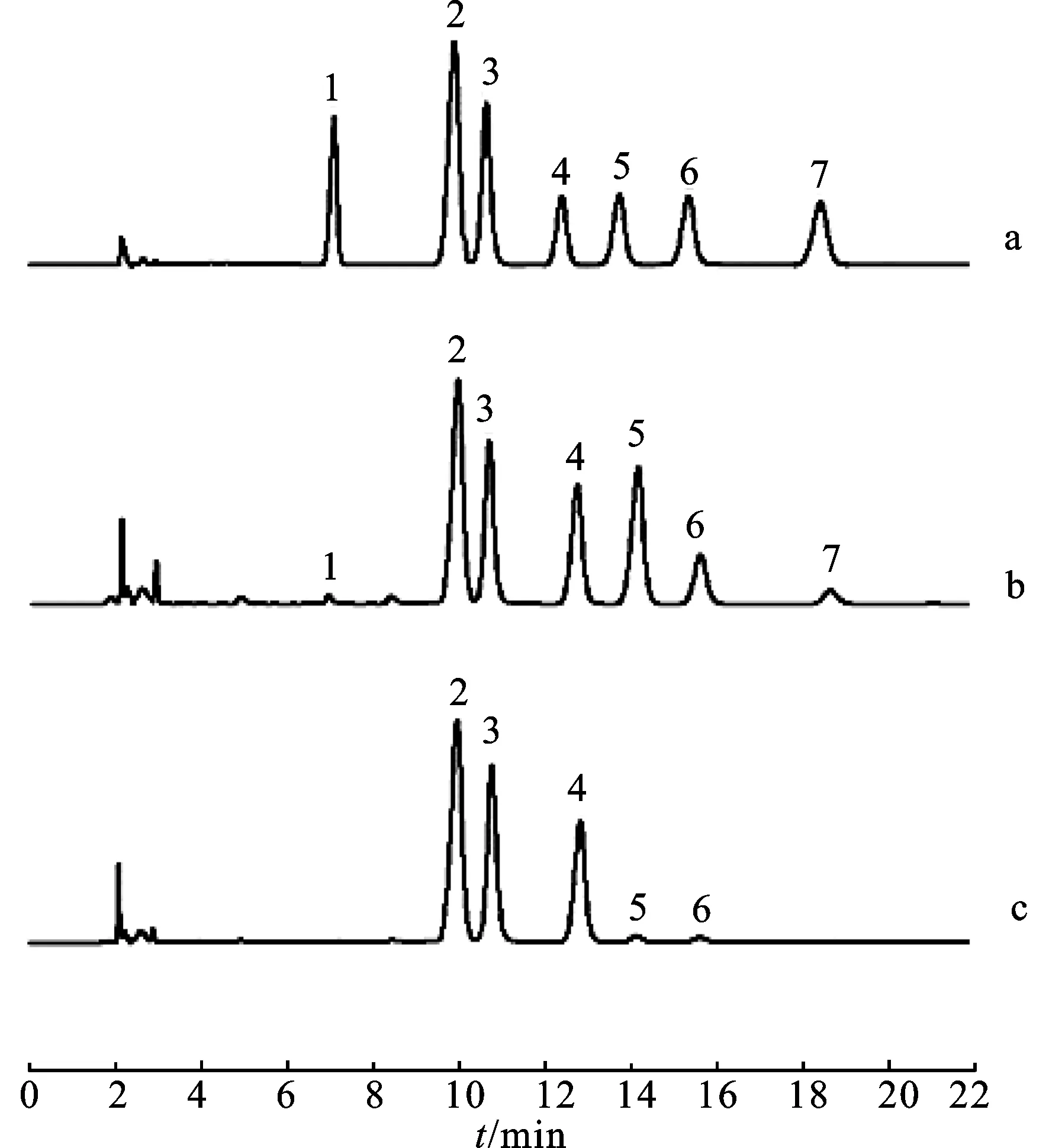
图2藤梨根样品多糖水解产物中单糖衍生化产物HPLC图
)a.混和对照品;b.皮部样品;c.木部样品;1.甘露糖;2.PMP;3.内标;4.葡萄糖;5.半乳糖;6.阿拉伯糖;7.岩藻糖。
Fig.2 HPLC chromatograms of derivatization products of monosaccharides hydrolyzated from polysaccharides in RadixActinidiaechinensissample
)a.mixed reference material;b.cortex sample;c.xylem sample;1.mannose;2.PMP;3.internal standard;4.glucose;5.galactose;6.arabinose;7.fucose.
表2多糖水解产物中单糖的测定结果
Tab.2 Analysis results of monosaccharides hydrolyzed from polysaccharides(mg·g-1)
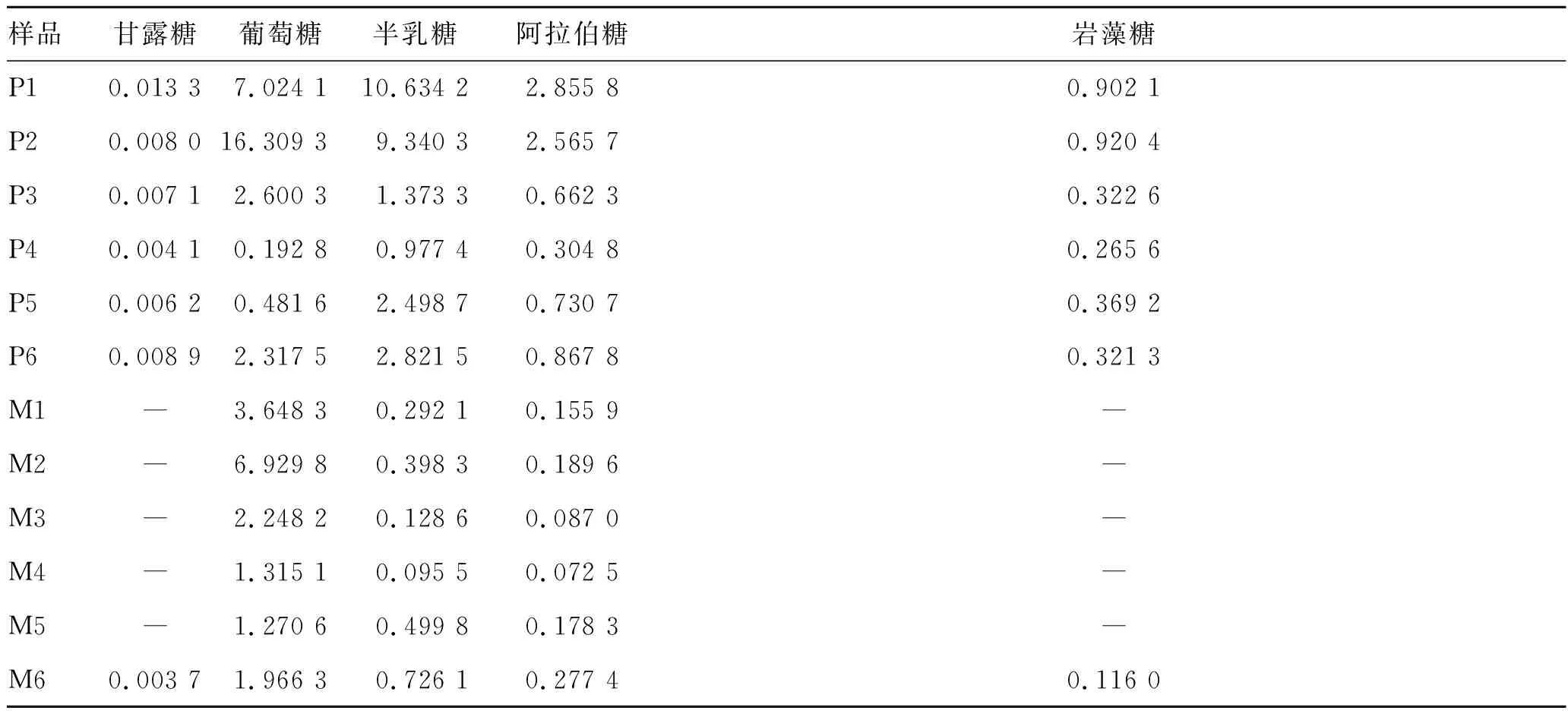
样品甘露糖 葡萄糖 半乳糖阿拉伯糖 岩藻糖P10.013 37.024 110.634 22.855 80.902 1P20.008 016.309 39.340 32.565 70.920 4P30.007 12.600 31.373 30.662 30.322 6P40.004 10.192 80.977 4 0.304 80.265 6P50.006 20.481 62.498 70.730 70.369 2P60.008 92.317 52.821 50.867 80.321 3M1―3.648 30.292 10.155 9―M2―6.929 80.398 30.189 6―M3―2.248 20.128 60.087 0―M4―1.315 10.095 50.072 5 ―M5―1.270 60.499 80.178 3―M60.003 71.966 30.726 10.277 40.116 0
注:P表示皮部;M表示木部;-表示低于检测限。
表3多糖中单糖的摩尔质量百分数计算结果
Tab.3 Calculated results of the number of moles of monosaccharides hydrolyzed from polysaccharides
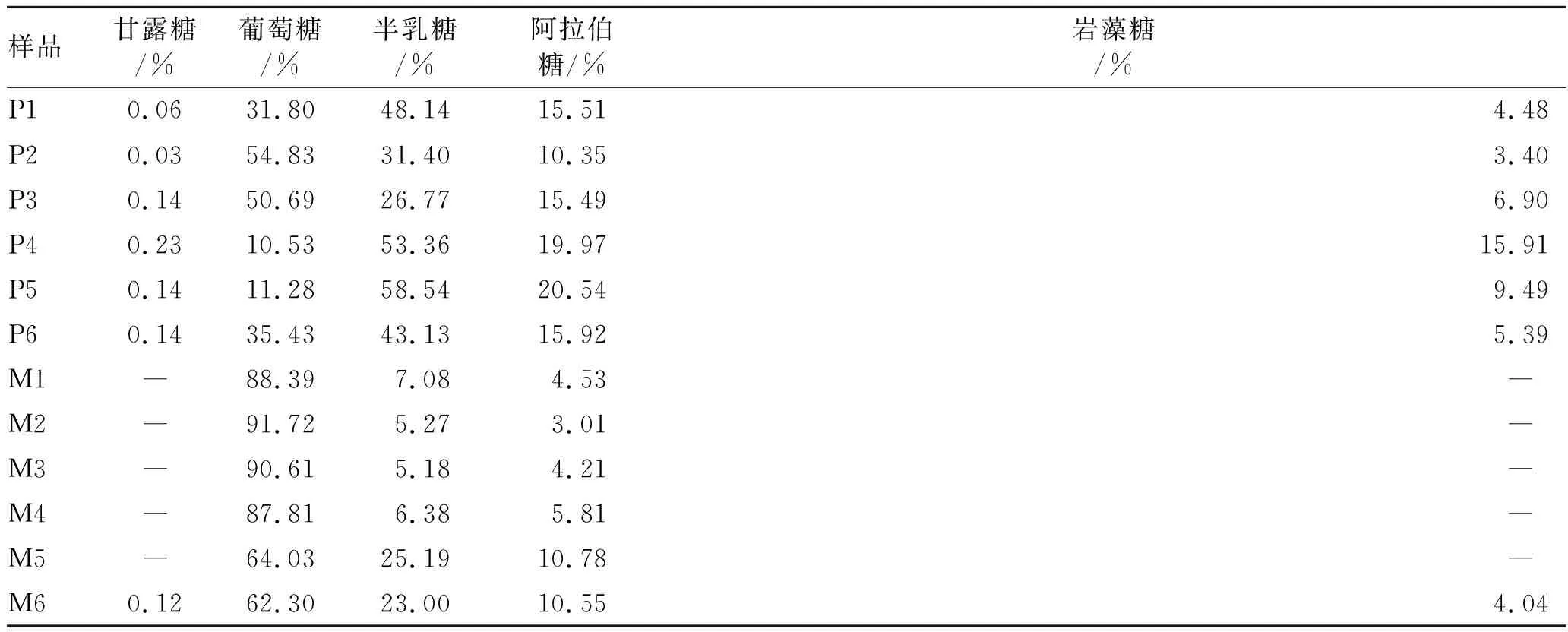
样品甘露糖/%葡萄糖/% 半乳糖/%阿拉伯糖/%岩藻糖/%P10.0631.8048.1415.514.48P20.0354.8331.4010.353.40P30.1450.6926.7715.496.90P40.2310.5353.3619.9715.91P50.1411.2858.5420.549.49P60.1435.4343.1315.925.39M1―88.397.084.53― M2―91.725.273.01― M3―90.615.184.21― M4―87.816.385.81― M5―64.0325.1910.78― M60.1262.3023.0010.554.04
注:P表示皮部;M表示木部;-表示低于检测限。
样品中各组分含量的比例有明显差异,说明药材的产地和生长环境对多糖组分有较大影响。尽管如此,在不同药用部位中也显示出一些共有特征。皮部和木部单糖组分的含量分别在0.004 1~16.303 9和0.003 7~6.929 8 mg·g-1之间,皮部含量明显高于木部。另外,自采原药材中单糖组分的含量也明显高于市场上销售的饮片。皮部多糖均含有甘露糖、葡萄糖、半乳糖、阿拉伯糖和岩藻糖,而木部除了一批药材测出甘露糖和岩藻糖外,多糖多由葡萄糖、半乳糖和阿拉伯糖构成。皮部多糖主要以葡萄糖、半乳糖和阿拉伯糖为构成主体,而木部主要以葡萄糖为构成主体。
4 结论
本文基于显微鉴定技术在组织构造上分析了藤梨根药材皮部与木部的区别。由于组织构造差异大,导致商品药材在现代薄片切制工艺的过程中皮部易脱落,饮片外观以木质部为主。同时皮部也比木部有更多的细胞后含物,这些后含物往往是活性成分的重要来源。因此,商品药材中仅以木质部为主不但与传统的药用部位相违背,也缺失了可能的活性成分。
多糖的单糖组成对其生物活性有重要的影响,糖单元的组成决定了多糖的种类,其生物活性也受其影响,更复杂的单糖构成印证更好的活性。本文采用显微鉴定技术界定皮部与木部,分别对皮部与木部的多糖进行提取,再水解后衍生化处理,采用化学计量学分析药材中皮部与木部的区别,结果发现,自采原药材中单糖组分的含量明显高于市场上销售的饮片,皮部中多糖单糖的组分种类与含量明显高于木部。多糖结构的测定还有待进一步研究。随着多糖生物活性越来越受到重视,含量高且组分多的皮部是藤梨根药效发挥中不可或缺的药用部位,本实验为藤梨根药用部位的正确使用提供参考依据。

